Бутилированная вода — Википедия
 | Эта статья или раздел описывает ситуацию применительно лишь к одному региону, возможно, нарушая при этом правило о взвешенности изложения. Вы можете помочь Википедии, добавив информацию для других стран и регионов. |
Бутилированная вода — пищевой продукт, представляющий собой воду, разлитую в стеклянные или пластиковые бутылки для розничного распространения. Объём тары колеблется от 0,33-литровых бутылочек до 19-литровых бутылей для кулеров. Содержимое бутылок может представлять собой:
Критерии качества питьевой бутилированной воды[править | править код]
 Автомат разливает воду в бутылки равного объёма
Автомат разливает воду в бутылки равного объёмаВ отличие от столовых и минеральных вод, не имеющих чётких критериев отнесения вод к данной категории (кроме параметра общей минерализации), для питьевых бутилированных вод разработана нормативная документация, чётко регламентирующая состав и позволяющая классифицировать бутилированную воду как «Питьевую воду первой категории» и «Питьевую воду высшей категории».
В настоящее время в России основные требования по качеству и безопасности питьевой бутилированной воды определяются двумя нормативными документами:
- ГОСТ 32220-2013 «Питьевая вода, расфасованная в ёмкость»;
- СанПиН 2.1.4.1116-2002 «Питьевая вода. Гигиенические требования к качеству воды, расфасованной в ёмкости. Контроль качества»;
- [[Гл II Р 9. «Единые санитарно-эпидемиологические и гигиенические требования к товарам, подлежащим санитарно-эпидемиологическому надзору (контролю)», утверждённые решением Комиссии Таможенного союза от 28.05.2010 № 299]]
Согласно этим документам питьевая вода должна быть безопасна для потребления человеком по микробиологическим, паразитологическим и радиологическим показателям, безвредна по химическому составу, иметь благоприятные органолептические свойства. Соответствующая таким требованиям вода может потребляться человеком неограниченно на протяжении всей его жизни. В настоящее время оценку соответствия (сертификацию) питьевой воды проводят по 86 показателям безопасности (9 — критерии эстетических свойств, 55 — критерии безвредности химического состава, 2 — критерии радиационной безопасности, 11 — критерии эпидемической безопасности, 9 — критерии физиологической полноценности макро- и микроэлементного состава). По общему солесодержанию питьевая вода не должна превышать 1 г/дм³.
ГОСТ Р 52109-2003[править | править код]
19-литровые бутыли с водойДанный ГОСТ распространяется на питьевую воду, расфасованную в ёмкости и предназначенную для питьевых целей, а также для приготовления пищевых продуктов, в том числе детского питания, напитков, пищевого льда, и устанавливает общие технические условия производства, поставки, реализации и использования.
Согласно ГОСТ Р 52109-2003, расфасованную воду, в зависимости от качества водоподготовки, подразделяют на две категории:
- питьевая вода первой категории
- питьевая вода высшей категории — выдвигаются более жёсткие требования к процессу водоподготовки, химическому составу, органолептическим, радиологическим и другим показателям.
Прочие критерии отнесения воды к конкретной категории определяются СанПиН 2.1.4.1116-02 «Питьевая вода. Гигиенические требования к качеству воды, расфасованной в ёмкости. Контроль качества».
СанПиН 2.1.4.1116-2002[править | править код]
Данные санитарно-эпидемиологические правила и нормативы устанавливают гигиенические требования к качеству питьевой воды, расфасованной в ёмкости: бутылки, контейнеры, пакеты, предназначенной для питьевых целей и приготовления пищи, а также требования к организации контроля её качества.
 | Настоящие санитарные правила имеют целью обеспечить население высококачественной и оптимальной по содержанию биогенных элементов расфасованной водой для укрепления здоровья и предотвратить появление в торговой сети и специальных службах обеспечения (при чрезвычайных ситуациях) некачественных расфасованных вод, потребление которых может привести к нарушению здоровья населения.П.2.1 СанПиН |  |
СанПиН 2.1.4.1116-02 регламентирует:
- 8 критериев эстетических свойств питьевых вод
- 54 критерия химического состава
- 2 показателя радиационной безопасности
- 10 микробиологических и паразитологических показателей
- 9 нормативов характеризующих физиологическую полноценность макро- и микроэлементного состава расфасованной воды
Так же, данный СанПиН регламентирует 3 вида консервантов (среди которых присутствует наиболее популярный — диоксид углерода).
Ёмкости с бутилированной водой могут быть помечены как:
- «бутилированная»
- «питьевая»
- «артезианская»
- «минерализованная»
- «ключевая»
- «колодезная»
- «газированная».
Бутилированная вода также подразделяется на воду для персонального и хозяйственного употребления. Последняя, как правило, негазированная вода в ПЭТ бутылях (3 и более литров).
Бутилированная вода подразделяется на минеральную и питьевую.
Минеральная вода — это вода соответствующим образом зарегистрированного подземного источника (скважины) с сохранённым первоначальным составом минеральных веществ. Минеральные воды оказывают лечебный эффект, но при соблюдении ряда условий (определённой температуры, схемы приёма и, зачастую, немедленного потребления у источника). Пить минеральную воду литрами и считать это лечением — заблуждение, а иногда и вред. Лечиться водой можно и нужно, но желательно на курорте или, если вне курорта, то под обязательным контролем врача.
С осознанием этой проблемы, проведя маркетинговые исследования, производители бутилированной воды сегодня увеличивают предложение столовой и питьевой воды на рынке абсолютно безвредных по показателю минерализации, то есть упор в продвижении своего товара они делают на чистоту бутилированной воды в сравнении с проблемной водой из-под крана и лучшую «жаждоутоляемость» в противовес газированным напиткам. Средняя минерализация такой воды 0,1-0,35 г/л считается безопасной и рекомендована для повседневного потребления. При розливе природной воды по СанПиНам не допускается изменение состава добываемой воды. Если же производитель очищает воду с помощью оборудования, то ужесточаются требования именно к составу, а не к источнику. В любом случае оценить качество воды можно только с помощью химического и микробиологического анализа.
Розлив бутилированной воды производят при помощи специальных машин. Существуют как полуавтоматические устройства для розлива, так и комплексные полностью автоматические линии для розлива и упаковки готовой бутилированной продукции. В зависимости от требуемой производительности и количества использования ручного человеческого труда подбирают наиболее подходящий состав машин и аппаратов участка розлива.
«Единые санитарно-эпидемиологические и гигиенические требования к товарам, подлежащим санитарно-эпидемиологическому надзору (контролю)», утверждённые решением Комиссии Таможенного союза от 28.05.2010 г.№ 299 Глава II Раздел 9. Требования к питьевой воде, расфасованной в ёмкости
Питьевая вода — формула жизни / Статьи о воде
Наша вода уникальна. Исходную воду для приготовленияфирменной воды «Н2О» добывают из артезианской скважины, уходящей под землю на 125 метров в Наро-Фоминском районе Московской области и достигающей залегания известковых пород девонского периода. Чистота и состав воды на такой глубине не зависят от того, что творится на поверхности. Между поверхностью и уровнем забора воды существуют еще две подземные реки с мощным течением, которые уж точно не пропустят сверху ничего ниже уровня своего течения.
Питьевая вода «Н2О» уже давно приобрела зарегистрированный в Роспатенте рекламный слоган: «Н2О — формула жизни», что по многим основаниям может соответствовать содержанию нашего продукта. (Об этом — смотри «Статьи»).
Питьевая вода «Н2О — формула жизни» имеет ярко выраженный индивидуальный вкус.
Во-первых, мы никогда не позволяем себе подмешивать к природной питьевой воде подмешивать очищенную водопроводную воду, чем не брезгуют зачастую известные производители питьевой воды
Во-вторых, наша вода действительно уникальна, она забирает из отложений девонских известняков все полезные минеральные соединения и, очищаясь через голубую глину, сохраняет свой полноценный состав.
В-третьих, вода «Н2О — формула жизни» очень мягкая и приятная на вкус, быстро утоляет жажду.
В-четвертых, вода, которую мы производим, имеет нейтральный кислотно-щелочной баланс (РН около 7,0), поэтому ее могут пить дети и люди с любым уровнем кислотности желудочно-кишечного тракта.
В-пятых, наш продукт перед употреблением не нуждается в кипячении или отстаивании, не имеет осадка.
Благодаря низкому содержанию натрия и присутствию таких минеральных веществ как кальций, сульфаты, и бикарбонаты вода «Н20 — формула жизни» оказывает благоприятное влияние на человеческий организм.
«Н20 — формула жизни»обладает я рко выраженным своеобразием: это вода питьевая со сбалансированной минерализацией, обладающая вкусом, идеально подчеркивающей кулинарные изыски различных блюд и ароматы вин.
«Н20 — формула жизни» с её тонким, нейтральным вкусом наилучшим образом подходит для употребления во время еды.
| п/п | Наименование показателей | Размерность | Содержание | Суммарная погрешность | ПДК | Метод анализа |
| 1 | pH | Ед. | 7.6 | 0.1 | 6.5-8.5 | потенциометрич. |
| 2 | Окисляемость перманганатная | мгО/дм3 | 1.2 | 0.23 | 3.0 | ЦВ 1.01.14-98 |
| 3 | Бикарбонаты | мг/дм3 | 358,68 | 9.8 | 400 | РД 33.5.3.07-96 |
| 4 | Цветность | град | 2 | 5 | ГОСТ 3351 | |
| 5 | Мутность | ЕМФ | 0,01 | 1,0 | ||
| 6 | Запах при 20С | балл. | 0 | 0 | ||
| 7 | Запах при 60С | балл. | 0 | 0 | ||
| 8 | Нитрат-ион | мг/дм3 | 1,1 | 0.06 | 20.0 | ГОСТ 18826-73 |
| 9 | Нитрит-ион | мг/дм3 | 0.01 | 0.5 | ГОСТ 4192-82 | |
| 10 | Аммиак и аммоний-ион | мг/дм3 | 0,02 | 0.1 | ГОСТ 4192-82 | |
| 11 | Хлориды | мг/дм3 | 1,72 | 0.5 | 250 | ГОСТ 4245-72 |
| 12 | Сульфаты | мг/дм3 | 5,1 | 3.1 | 250 | ГОСТ 4389-72 |
| 13 | Жесткость общ. | мг-экв/дм3 | 0,2 | 0.2 | 7.0 | ГОСТ 4151-72 |
| 14 | Фосфаты (по PO4) | мг/дм3 | 0,13 | 0.01 | 3.5 | ГОСТ 18309-72 |
| 15 | Цианиды | мг/дм3 | <0.01 | 0.035 | ГОСТ 51680-2000 | |
| 16 | Сероводород | мг/дм3 | отсутествует | 0.003 | ПНДФ 14.1:2.114-97 | |
| 17 | Барий | мг/дм3 | 0.1 | 0.08 | 0.07 | ГОСТ Р 51309-99 |
| 18 | Бор | мг/дм3 | 0.1 | 0.5 | ||
| 19 | Бериллий | мг/дм3 | <0.0001 | 0.0002 | ||
| 20 | Молибден | мг/дм3 | 0,005 | 0.07 | ||
| 21 | Магний | мг/дм3 | 0,62 | 0.8 | 65 | |
| 22 | Кальций | мг/дм3 | 2,3 | 1.3 | 130 | |
| 23 | Марганец | мг/дм3 | 0.005 | 0.008 | 0.05 | |
| 24 | Железо | мг/дм3 | 0.05 | 0.03 | 0.3 | |
| 25 | Калий | мг/дм3 | 5,33 | 0.8 | 20 | |
| 26 | Цинк | мг/дм3 | 0,03 | 5.0 | ||
| 27 | Кадмий | мг/дм3 | 0.0001 | 0.001 | ||
| 28 | Свинец | мг/дм3 | 0.001 | 0.01 | ||
| 29 | Медь | мг/дм3 | 0,001 | 1.0 | ||
| 30 | Мышьяк | мг/дм3 | 0,001 | 0.01 | ||
| 31 | Натрий | мг/дм3 | 138,97 | 2.4 | 200 | |
| 32 | Алюминий | мг/дм3 | <0.01 | 0.2 | ||
| 33 | Никель | мг/дм3 | 0.0001 | 0.02 | ||
| 34 | Селен | мг/дм3 | 0,001 | 0.01 | ||
| 35 | Стронций | мг/дм3 | 1,12 | 0.02 | 7.0 | |
| 36 | Хром | мг/дм3 | <0.001 | 0.05 | ||
| 37 | Олово | мг/дм3 | — | — | ||
| 38 | Титан | мг/дм3 | — | — | ||
| 39 | Ванадий | мг/дм3 | — | — | ||
| 40 | Кобальт | мг/дм3 | <0,001 | 0,1 | ||
| 41 | Кремний | мг/дм3 | — | — | ||
| 42 | Фтор | мг/дм3 | — | — | ГОСТ 4192-82 | |
| 43 | ПАВ | мг/дм3 | — | — | ГОСТ Р 51211-98 | |
| 44 | Ртуть | мг/дм3 | <0.0001 | 0.0005 | ГОСТ 51212-98 | |
| 45 | Сухой остаток | мг/дм3 | 504,47 | 7.0 | 1000 | ГОСТ 18164-72 |
| 46 | Нефтепродукты | мг/дм3 | <0.001 | 0.05 | РД 52.24.476-95 | |
| 47 | Бромид-ион | мг/дм3 | <0.2 | 0.2 | ГОСТ 23268.16-78 | |
| 48 | Йод | мг/дм3 | — | — | ГОСТ 23268.15-78 | |
| 49 | Двуокись углерода | % | — | — | ГОСТ 23268.2-78 |
Формула воды в химии
Химическая и структурная формула воды
Химическая формула: Н2O
Структурная формула:
Молярная масса: 18,01528 г/моль.
Альтернативные названия: оксид водорода, гидроксид водорода, гидроксильная кислота, монооксид дигидрогена, оксидан, дигидромонооксид.
В молекуле воды атом кислорода находится в состоянии sp3–гибридизации, поскольку в образовании гибридных орбиталей участвуют не только валентные электроны, но и неподеленные электронные пары. Гибридные орбитали направлены к вершинам тетраэдра:
Вследствие большой разницы электроотрицательностей кислорода и водорода связи в молекуле сильно поляризованы, и происходит смещение электрон ной плотности в сторону кислорода. Молекула воды обладает большим дипольным моментом, поскольку полярные связи расположены несимметрично.
С сильной поляризацией связи О – Н связано образование водородных связей между молекулами воды. Каждая молекула воды может образовывать до четырёх водородных связей – две из них образует атом кислорода, а еще две – атомы водорода:
Образование водородных связей определяет более высокую температуру кипения, вязкость и поверхностное натяжение воды по сравнению с гидридами аналогов (серы селена и теллура).
Изотопные модификации воды
В зависимости от типа изотопов водорода, входящих в состав молекулы, выделяют следующие изотопные модификации воды:
| Название | Формула |
|---|---|
|
Легкая вода (основной компонент природной воды) |
H2O |
|
Тяжёлая вода (дейтериевая) |
D2O |
|
Сверхтяжёлая вода (тритиевая) |
T2O |
|
Тритий-дейтериевая вода |
TDO |
|
Тритий-протиевая вода |
THO |
|
Дейтерий-протиевая вода |
DHO |
С учетом того, что у кислорода три стабильных изотопа (16O, 17O и 18O), можно составить 18 формул молекул воды, различающихся изотопным составом. Как правило, природная вода содержит все эти разновидности молекул.
Примеры решения задач по теме «формула воды»
Открыт химический состав воды
 Генри Кавендиш.
Генри Кавендиш.Воду определённо можно назвать одним из самых легкодоступных химических веществ. Означает ли это, что её свойства стали известны учёным раньше, чем характеристики других, куда более редких соединений? Как ни странно, нет. В течение долгого времени вода вообще считалась простым веществом, поскольку известные на тот момент способы разложения химических соединений не позволяли разложить молекулу H2O на составляющие. Да и стабильность, присущая воде, подтверждала эту гипотезу.
Состав воды был открыт почти случайно. В 1783 г. британский химик Генри Кавендиш (Henry Cavendish) проводил опыты с так называемым «жизненным воздухом» или кислородом. В процессе эксперимента Кавендиш смешал один объём «жизненного воздуха» с двумя объёмами «горючего воздуха» (водорода). После того, как через смесь был пропущен электрический разряд, содержимое колбы вспыхнуло, а на стенках появились капельки жидкости. Изучив эти капли, Кавендиш обнаружил, что это чистая вода.
Учёный крайне удивился — судя по результатам опыта, вода, гасящая огонь, сама образовывалась… из пламени. А формула проведённой Кавендишем реакции выглядела так:
2H2 + O2 → 2H2O + 136,74 ккал.
Сейчас эта реакция известна каждому школьнику, но в XVIII веке открытие Кавендиша стало революционным.
Опытами британского коллеги заинтересовали известного французского химика Антуана Лавуазье (Antoine de Lavoisier). Он воспроизвёл эксперименты Кавендиша, а затем ознакомил членов Французской академии наук с результатами своих трудов. Название доклада Лавуазье для современного читателя звучит немного забавно — выступление называлось «О природе воды и экспериментах, по-видимому, подтверждающих, что это вещество не является, строго говоря, элементом, а может быть разложено и образовано вновь». Однако предосторожности оказались не напрасными. Доклад Лавуазье подвергли жёсткой критике, поскольку он противоречил господствовавшим в то время в научной среде теориям. А вспомнили об этих наработках лишь спустя 2 года, когда воздухоплавателям понадобился газообразный водород в больших количествах — его Лавуазье с коллегами и стали добывать из воды при помощи реакции с обычным железом.
Химическое строение воды
Из школьного курса химии мы знаем, что вода — это неорганическое соединение двух элементов. Формула проста — h3O, то есть два атома водорода и один атом кислорода. Вода имеет несколько агрегатных состояний, самое распространенное из них — жидкость. Два других состояния: твердое — лед и газообразное — пар.

Значение воды для жизни на Земле трудно переоценить. Без этой субстанции в принципе невозможно существование биологических форм. Кроме того, она участвует в обменных процессах на самой планете и в организмах живых существ.
Получение воды
Воду можно получить не только путем соединения водорода и кислорода. Например, разложением пероксида углерода получают 2Н2О и О2, гидрокарбонат натрия при контакте с уксусной кислотой дает воду, ацетат натрия и углекислый газ. Жидкость можно получить при взаимодействии кислоты и щелочи — химическая реакция называется нейтрализация, или путем восстановления оксидов металла водородом.
Как вода участвует в химических реакциях?
Н2О взаимодействует со всеми веществами на Земле. Например, с металлами, неметаллами и их соединениями. При контакте с металлами выделяется кислород, правда, для этой реакции подходят только щелочноземельные и щелочные группы I и II. Реакция с неметаллами проходит менее активно и только путем нагревания.
При соединении с оксидами образуются новые химические реагенты. Так при контакте с оксидом серы IV группы — сернистая кислота, а с тем же оксидом VI группы — серная кислота, с диоксидом углерода — угольная кислота. Химическое соединение воды с оксидом кальция дает гашеную известь. Однако не все оксиды хорошо взаимодействуют с водой. Например, оксиды титана, цинка, хрома не растворяются в жидкой среде. Именно поэтому их используют для защиты металлических поверхностей от влаги и коррозии.
При пропускании электрического тока через воду происходит окислительно-восстановительная реакция, в которой вода выполняет сразу две функции — окисляет и восстанавливает. Результатом таких реакций с оксидом металла получаются водород и кислород.
h3O участвует в биосинтезе, в ходе которого выделяется кислород. Данная реакция происходит при помощи двуокиси углерода и солнечного света.
Чистая вода — доступность для человека
Воздействие воды на человеческий организм изучается не первое столетие. Современная наука установила, что вода активно участвует в обменных процессах. Именно поэтому жидкость может нести в себе не только пользу, но и угрозу. Например, если в составе содержатся различные примеси, бактерии и опасные химические соединения. Если Вы заботитесь о своем здоровье и здоровье близких, необходимо обеспечить доступ к чистой питьевой воде дома и в офисе. Это сделать не так уж и сложно – достаточно позвонить в нашу компанию «Воды здоровья» и заказать продукт в 19-литровых бутылях, добытый из артезианских скважин или природных источников.
Помимо доставки чистой и полезной воды, мы предлагаем в аренду водораздаточные устройства — кулеры с опцией подогрева и охлаждения жидкости. Специалисты установят оборудование и будут вовремя его обслуживать, очищать и проводить санацию. Звоните по телефонам на сайте, заказывайте воду. Доставим в любое удобное время в Москве и Санкт-Петербурге!
Уважаемые читатели!
Спасибо, что читаете наш блог! Получайте самые интересные публикации раз в месяц оформив подписку. Новым читателям предлагаем попробовать нашу воду бесплатно, при первом заказе выберите 12 бутылок (2 упаковки) минеральной воды BioVita или питьевой воды Stelmas. Операторы свяжутся с Вами и уточнят детали. Тел. 8 (800) 100-15-15
* Акция для Москвы, МО, Санкт-петербурга, ЛО
Спасибо за подписку на нашу рассылку
ВОДА | Энциклопедия Кругосвет
ВОДА – оксид водорода H2O.
В течение многих столетий вода считалась простым веществом. Лишь в 1783 французский химик Антуан Лоран Лавуазье (1743–1794) сумел разложить ее. Он показал, что вода состоит из водорода и кислорода, а в 1789 дал первую оценку ее количественного состава: 15% водорода и 85% кислорода. В дальнейшем количественный анализ воды проводили многие ученые. Долгое время образцовыми считались результаты французского химика и физика Жозефа Луи Гей-Люссака (1778–1850), полученные около 1808: 13,27% водорода и 86,73% кислорода. Только в 1821 шведский химик Йенс Якоб Берцелиус (1779–1848) и французский физик и химик Пьер Луи Дюлонг (1785–1838) сделали более правильный анализ воды и нашли, что она содержит 11,1% водорода и 88,9% кислорода, что очень близко к современным значениям (11,19% водорода и 88,81% кислорода).
Изучая объемные отношения реагирующих газов, Гей-Люссак показал, что один объем кислорода и два объема водорода при взаимодействии дают два объема водяного пара (при температуре выше 100° С). На основании этих результатов с учетом закона Авогадро был сделан вывод, что две частицы водяного пара образуются из одной частицы кислорода и двух частиц водорода. Таким образом была выведена формула воды H2O.
На нашей планете вода играет очень важную роль. В природе она совершает непрерывный круговорот. Под влиянием солнечной энергии жидкая вода (главным образом, в теплых морях и океанах) превращается в пар, который поднимается в верхние слои атмосферы. Это происходит благодаря тому, что водяной пар легче воздуха. Так происходит образование облаков, которые ветрами переносятся в другие части планеты, где в виде дождя и других осадков вода попадает на поверхность земли. Здесь она образует ручьи и реки, которые возвращают испаренную воду в океаны (рис. 1).
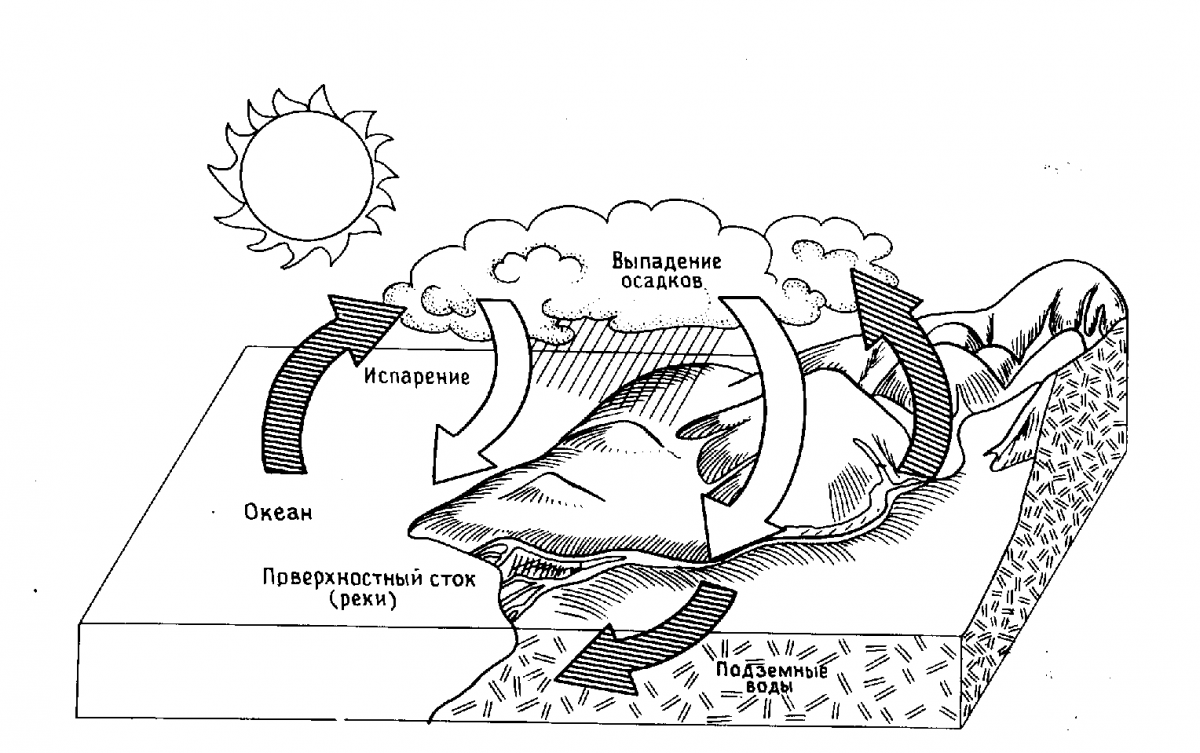
Чистой воды в природе нет. Даже наиболее чистая дождевая вода при падении через атмосферу растворяет газы и захватывает пыль. При ее испарении всегда остается небольшой остаток – около 0,03 г на литр. На поверхности земли вода дополнительно растворяет многие твердые вещества. Часть ее впитывается в почву. В глубине земли продолжается растворение различных веществ, так что при выходе на поверхность вода иногда образует минеральные источники. Ключевая и колодезная вода от растворенных в ней солей часто бывает жесткой.
Речная (пресная) вода содержит до 0,5 г растворенных солей в одном литре. В конце концов, все это попадает в море. Таким образом, море, испаряя чистую воду, получает взамен воду с растворенными в ней веществами. Количество солей, поставляемое реками в моря и океаны, огромно. Так, река Дон ежегодно вносит в Азовское море около 16 млн. т солей, Дунай в Черное море – 9 млн. т.
В океанской воде содержится около 35 г солей в литре. Столько же имеется в водах большинства морей. Однако для закрытых морей встречаются отклонения от средней солености, связанные с числом впадающих рек, средней температурой и другими факторами. Балтийское море содержит лишь 3–8 г солей на литр, а Красное – до 45 г. В соленых озерах содержание солей может быть намного больше: в Мертвом море – 228 г в одном литре, в оз. Эльтон – 270 г. В морской воде растворен, в основном, хлорид натрия; кроме того, имеются и другие соли натрия, магния, кальция.
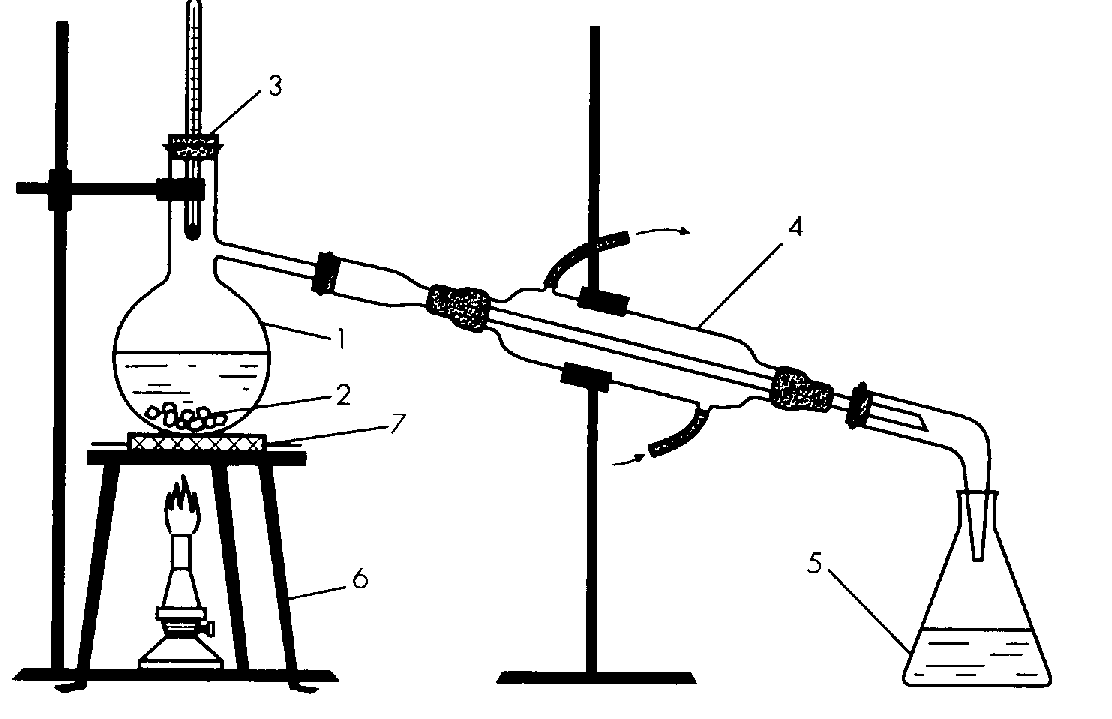
Для научной работы, а также для фармацевтических и других целей, воду перегоняют (рис. 2). Для этого ее превращают в пар, который затем охлаждают, получая чистую дистиллированную воду. Примеси остаются в перегонном сосуде.
Молекула воды имеет угловое строение с длиной связи О–Н 96 пм и валентным углом Н-О-Н 104,5°. Молекула воды полярна, ее дипольный момент равен 1,86 Д.(Д –дебай, 1 Д = 3,34·10-30 Кулон·м).
Природная вода содержит следы «тяжелой» воды (оксида дейтерия) D2O. Физические свойства H2O и D2O заметно различаются.
| H2O | D2O | |
| t плав.,°С | 0,0 | 3,8 |
| t кип., °С | 100,0 | 101,4 |
Свойства воды служат точкой отсчета для многих физических величин. Так, температуры замерзания и кипения воды лежат в основе шкалы Цельсия. Один литр – это объем 1 кг чистой воды, взвешенной при +4 °С (при этой температуре вода имеет максимальную плотность).
Многие физические свойства воды аномальны по сравнению с другими жидкостями. Одной из причин этого служат малые размеры молекул воды – минимальные среди всех жидких веществ при обычных условиях. Однако наиболее важным свойством воды является ее способность образовывать прочные водородные связи.
В водяном паре при температуре кипения и атмосферном давлении присутствует около 1% димеров, в которых молекулы воды объединены в пары водородными связями. В жидком и твердом состоянии каждая молекула воды образует четыре водородные связи: две как донор протонов и две – как акцептор протонов. Водородные связи молекулы воды направлены приблизительно к вершинам правильного тетраэдра (рис. 3.).
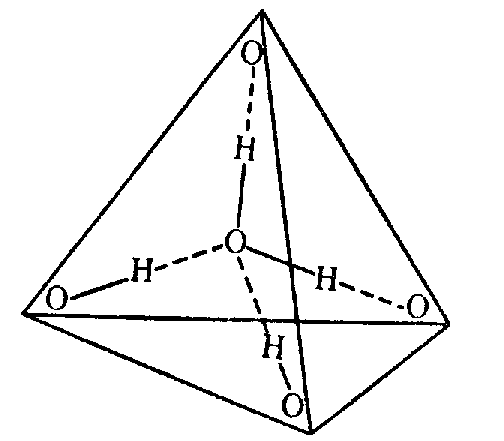
Если бы водородных связей не было, то температуры плавления и кипения воды были бы существенно ниже, как это наблюдается у других водородных соединений неметаллов. Водородные связи являются причиной и другого уникального свойства воды – при плавлении ее плотность возрастает. При 0°С плотность льда (0,9168 г/см3) меньше, чем плотности жидкой воды (0,9998 г/см3), поэтому лед плавает на поверхности воды. Если бы у льда была более высокая плотность, по мере замерзания он опускался бы на дно, что сделало бы жизнь в водоемах зимой невозможной.
Чтобы превратить воду в пар, надо затратить много энергии – около 44 кДж/моль. При обратном переходе пара в жидкую воду выделяется то же количество теплоты.
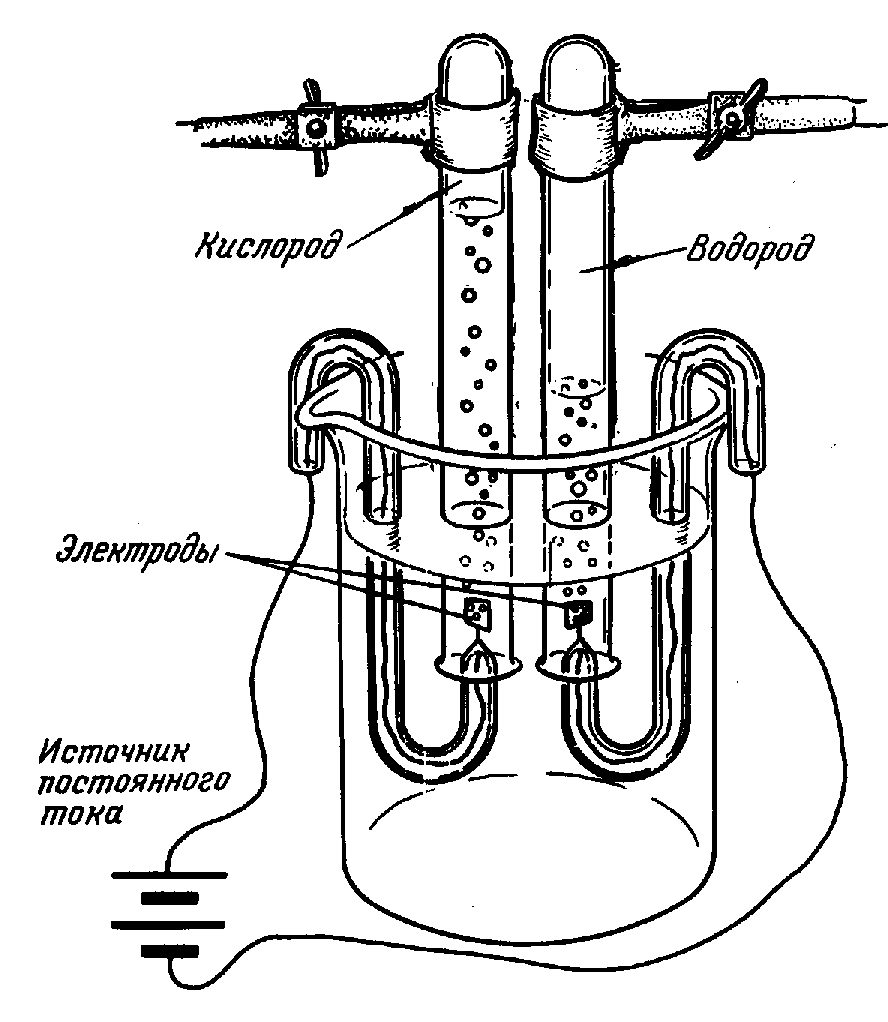
Вода устойчива при нагревании вплоть до 1000°С. При более высоких температурах она частично разлагается на водород и кислород. Эти же продукты образуются при электролизе воды.
Разложение воды искрами электрической машины заметили еще в 1789, а годом позже воду разложили с помощью гальванического электричества. В России это впервые было сделано профессором С.-Петербургской Медико-Хирургической Академии В.В. Петровым летом 1802 посредством огромной «гальвани-вольтовой батареи», состоявшей из 4200 медных и цинковых кружков. Электролиз чистой воды идет очень медленно. Для более быстрого разложения воды электрическим током в нее добавляют какую-либо кислоту, щелочь или соль. Этот процесс иногда используют для получения чистого водорода и кислорода (рис. 4).
Под действием УФ-излучения вода распадается на ионы Н+ и ОН–, а под действием ионизирующего излучения радиоактивных веществ – образует Н2, Н2О2 и свободные радикалы Н*, ОН*, НО2*.
Вода вступает в химическое взаимодействие со многими простыми веществами. Большинство таких реакций протекает при высокой температуре. Только наиболее активные металлы (щелочные и щелочноземельные) и неметаллы (галогены) реагируют с водой при комнатной температуре. Однако при одновременном воздействии воды и окислителей даже при обычной температуре происходит разрушение металлов средней активности (таких как железо) в результате коррозии.
Очень сильными восстановителями вода восстанавливается до водорода, очень сильными окислителями – окисляется до кислорода.
Вода взаимодействует со многими основными оксидами с образованием гидроксидов. В реакциях воды с большинством кислотных оксидов образуются кислоты.
РЕАКЦИИ ВОДЫ
| С простыми веществами: | |
| металлами | неметаллами |
| 2Na + 2H2O = 2NaOH + H2 | Cl2 + H2O⇋ HCl + HClO |
| 2Fe + 3H2O = Fe2O3 + 3H2 (600 °C) | H2O + C ⇋ CO + H2 (800–1000 °C) |
| С оксидами: | |
| основными | кислотными |
| CaO + H2O = Ca(OH)2 | SO3 + H2O = H2SO4 |
| Na2O + H2O = 2NaOH | N2O5 +H2O = 2HNO3 |
| Термическое разложение: 2Н2О⇋ 2Н2 + О2 | |
Некоторые сложные вещества полностью разлагаются водой – подвергаются необратимому гидролизу:
Al2S3 + 6H2O = 2Al(OH)3↓ + 3H2S↑
Вода может служить катализатором. Например, щелочные металлы и водород реагируют с хлором только в присутствии следов воды. Иногда вода является каталитическим ядом, например, для железного катализатора при синтезе аммиака.
В результате образования водородных связей твердая вода (лед) имеет рыхлую структуру с обширными замкнутыми полостями двух типов: больших и малых. В этих полостях могут размещаться молекулы других веществ, имеющие соответствующие размеры. Они удерживаются в них ван-дер-ваальсовыми силами. Так образуются газовые гидраты – клатраты, соединения типа «гость-хозяин», в которых «гостями» являются молекулы газов или легкокипящих жидкостей (благородные газы, галогены, углеводороды и др.), а «хозяевами» – молекулы воды, образующие кристаллический каркас. По внешнему виду газовые гидраты напоминают снег или рыхлый лед, но могут существовать только при повышенном давлении и отрицательной (по Цельсию) температуре. Наиболее важным на сегодняшний день газовым гидратом является гидрат природного газа метана, колоссальные скопления которого обнаружены в недрах земли, в особенности на шельфе морей и океанов.
Газовые гидраты относятся к соединениям переменного состава. Если диаметр молекулы газа менее 0,52 нм (Ar, CH4, H2S), то в предельном случае могут заполниться и большие и малы полости кристаллической решетки. При полном заполнении всех полостей число молекул воды, приходящихся на одну молекулу «гостя», составляет 5,75 (например, 4Ar . 23H2O). Молекулы «гостей» с диаметром от 0,52 до 0,59 нм (Br2, CH3SH, COS) могут заполнять лишь большие полости. В этом случае минимальной число молекул воды, приходящееся на одну молекулу «гостя», равно 7,66 (например, 3Br2 . 23H2O). Гидраты газов с диаметром молекул от 0,59 до 0,69 нм (C3H8, изо-C4H10, CHCl3) имеют другую структуру и состав, например C3H8 . 17H2O.
Вода хорошо растворяет многие вещества, имеющие ионное строение (соли, щелочи), а также вещества, молекулы которых полярны. Наличие в жидкой воде ассоциатов (элементов кристаллической структуры) наряду с большим дипольным моментом молекул приводит к высокой диэлектрической проницаемости воды (ε = 78,3 при 25 °С). Это вызывает заметное ослабление кулоновского притяжения в водной среде, а, следовательно, способствует электролитической диссоциации ионных и полярных ковалентных соединений. При этом полярные молекулы воды участвуют в процессе гидратации за счет притяжения соответствующих полюсов полярных молекул воды к образующимся катионам и анионам. В ряде случаев образующиеся связи являются настолько прочными, что можно говорить о возникновении аквакомплексов. Аквакомплексы обнаружены не только в водных растворах, но и во многих кристаллических структурах.
Твердые вещества, как правило, лучше растворяются при нагревании. При этом вещества с очень прочной кристаллической решеткой мало растворимы в воде. К ним относятся хлориды, бромиды и иодиды серебра и свинца, сульфаты щелочноземельных металлов и свинца, большинство гидроксидов, сульфидов, ортофосфатов и карбонатов металлов.
Газы обычно плохо растворяются в воде. Исключение составляют газообразные вещества, взаимодействующие с водой, например аммиак, хлороводород или диоксид серы. Растворимость всех газов возрастает при увеличении давления и, как правило, понижается при нагревании.
В жидкой воде одна из каждых 10 миллионов молекул диссоциирует, образуя ионы: катионы водорода Н+ и гидроксид-ионы ОН–:
Н2О ⇋ Н+ + ОН–
Чистая вода содержит одинаковую молярную концентрацию катионов водорода Н+ и гидроксид-ионов ОН–, и среда ее нейтральна. Однако при растворении многих веществ в воде концентрации ионов Н+ и ОН– изменяются. Если увеличивается концентрация катионов водорода, среда становится кислотной. При увеличении концентрации гидроксид-ионов среда становится щелочной. Определить характер среды можно с помощью индикаторов.
| Индикатор | Кислотная среда | Нейтральная среда | Щелочная среда |
| Лакмус | Красный | Фиолетовый | Синий |
| Фенолфталеин | Бесцветный | Бесцветный | Малиновый |
| Метиловый оранжевый | Розовый | Оранжевый | Желтый |
Основания диссоциируют в водном растворе с образованием гидроксид-ионов, создавая щелочную среду:
NaOH = Na+ + OH– (сильное основание)
NH3 . h3O ⇋ NH4+ + OH– (слабое основание)
При диссоциации кислот в растворе образуются катионы водорода, и среда становится кислотной.
H2SO4 = 2H+ + SO42– (сильная кислота)
h3CO3 ⇋ H+ + HCO3– (слабая кислота)
| Вещества | Сильные | Слабые |
| Основания | NaOH, KOH, Ca(OH)2, Ba(OH)2 | Nh4 |
| Кислоты | HCl, HBr, HI, H2SO4, HNO3 | H3PO4, H2CO3, H2S |
Соли при растворении в воде диссоциируют на катионы металла и анионы кислоты. Растворы многих солей имеют кислотную или щелочную среду за счет обратимого гидролиза по катиону или по аниону (см. ГИДРАТАЦИЯ, ГИДРАТЫ, ГИДРОЛИЗ).
| СОЛЬ | ГИДРОЛИЗ | СРЕДА РАСТВОРА | рН | |
| Катион | Анион | |||
| сильного основания | сильной кислоты | — | нейтральная | 7 |
| сильного основания | слабой кислоты | по аниону | щелочная | > 7 |
| слабого или малорастворимого основания | сильной кислоты | По катиону | кислотная | < 7 |
| слабого или малорастворимого основания | слабой кислоты | По катиону и аниону | Нейтральная кислотная или щелочная | 7 > 7 < 7 |
Несмотря на свое название, многие кислые соли (например, гидрокарбонат натрия) создают в водном растворе щелочную среду:
NaHCO3 = Na+ + HCO3–
HCO3– + H2O ⇋ H2CO3 + OH–
Вода используется во многих технологических процессах главным образом как охлаждающая жидкость, транспортирующая среда для сыпучих материалов (например, золы), важнейший растворитель, реагент. Тяжелую воду применяют в качестве эффективного замедлителя нейтронов. Обычная вода не токсична, однако тяжелая вода опасна для млекопитающих.
Вода является жизненно важным веществом. Она является обязательным компонентом всех живых существ. Организм взрослого человека массой 65 кг содержит до 40 кг воды. Вода является растворителем, составной частью клеток, участником биохимических реакций. Она играет важную роль в терморегуляции. У взрослого человека суточная потребность в воде составляет примерно 2,4 кг. Сюда включается вода, поступающая в организм с твердой и жидкой пищей, в виде напитков, а также вода, образующаяся в результате дыхательных процессов (около 300 г).
Человек чрезвычайно остро ощущает изменения содержания воды в организме и может прожить без воды лишь несколько суток. Потеря 10–20% воды опасна для жизни. В то же время избыток воды приводит к перегрузке сердечно-сосудистой системы, потере солей.
Очень важен минеральный состав питьевой воды. Человек употребляет для питья воду, содержащую от 0,02 до 2 г минеральных веществ на 1 л. Большое значение имеют вещества, находящиеся в малых концентрациях, но играющие важную роль в физиологических процессах организма. Например, длительное употребление питьевой воды, содержащей фтора менее 0,6 мг/л, ведет к кариесу зубов, а потребление воды с концентрацией фтора более 1 мг/л вызывает флюороз.
Если в питьевую воду попадают возбудители инфекционных заболеваний, она может явиться фактором их распространения. Многие возбудители кишечных инфекций сохраняют свою жизнеспособность в воде в течение нескольких месяцев.
При определении качества питьевой воды немаловажное значение имеют свойства, воспринимаемые органами чувств (органолептические свойства): температура, прозрачность, цвет, запах, вкус, жесткость. Питьевая вода должна быть безопасной в эпидемиологическом отношении, безвредной по химическому составу, благоприятной по органолептическим свойствам. Чтобы использовать для питья природную воду, ее обычно очищают. С этой целью применяют как физические (фильтрование, отстаивание), так и химические (хлорирование, озонирование) методы.
В 1 мл питьевой воды должно быть не более 100 микроорганизмов (число бактерий группы кишечных палочек – не более 3). Не менее жесткие ограничения накладываются на содержание химических веществ.
| Алюминий 0,5 | Полифосфаты 3,5 |
| Бериллий 0,002 | Свинец 0,03 |
| Железо 0,3 | Селен 0,001 |
| Марганец 0,1 | Стронций 7,0 |
| Медь 1,0 | Сульфаты 500,0 |
| Молибден 0,25 | Фтор 0,7–1,5 (для различных климатических районов) |
| Мышьяк 0,05 | Хлориды 350,0 |
| Нитраты 45,0 | Цинк 5,0 |
| Полиакриламид 2,0 |
Общая жесткость питьевой воды должна быть не выше 7,0 ммоль/л, а сухой остаток – 1000 мг/л. Значения рН не должны выходить за пределы 6,0–9,0.
Ресурсы питьевой воды не безграничны. Проблема обеспечения питьевой водой растущего народонаселения является одной из наиболее острых экологических проблем современности. На возобновляемые водные ресурсы – речной сток воды – оказывает влияние не только растущее загрязнение окружающей среды, но и глобальное потепление климата Земли. Хотя в ряде районов России увеличение количества атмосферных осадков и повышение температуры воздуха в холодное время года благоприятно отражаются на стоке воды рек, на северо-западе и юге нашей страны наметилась тенденция к уменьшению количества ежегодно возобновляющихся водных ресурсов.
Для предотвращения водного кризиса, помимо усиления административных мер по охране природных ресурсов, необходимо экологическое образование население. Это должно помочь правильному восприятию взаимосвязей между всеми сферами Земли, включая ее водную оболочку.
Елена Савинкина
Дистиллированная вода — Википедия
Материал из Википедии — свободной энциклопедии
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 1 октября 2019; проверки требуют 2 правки. Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 1 октября 2019; проверки требуют 2 правки.
Дистиллиро́ванная вода́ — вода, почти очищенная от растворённых в ней минеральных солей, органических веществ и других примесей путём дистилляции[1]. Согласно российскому ГОСТ 6709-72, массовая концентрация остатка после выпаривания дистиллированной воды должна составлять не более 5 мг/дм3, pH иметь значение в диапазоне 5,4-6,6, удельная электрическая проводимость при 20 °С составлять не более 5·10−4 См/м[2](соответствует удельному электрическому сопротивлению 2 кОм⋅м).
Характеристики[править | править код]
Дистиллированная вода в РФ нормируется на основании ГОСТ 6709-72 «Вода дистиллированная».
Удельная электропроводность дистиллированной воды невелика (ГОСТ 6709-72 требует не более 0,5 мСм/м[3]).
В дистиллированной воде растворены газы атмосферы: кислород, азот, аргон, углекислый газ и незначительное количество других. Из-за растворённой углекислоты дистиллированная вода имеет слабокислую среду и её pH составляет 5,4—6,6. Для получения полностью нейтральной воды её кипятят до полного удаления углекислого газа (в течение 30 минут) и хранят в герметичной таре.
Будучи очень чистой, в отсутствие посторонних механических включений может быть перегрета выше точки кипения, или переохлаждена ниже точки замерзания без осуществления фазового перехода. Фазовый переход интенсивно происходит при введении механических примесей или взбалтывании.
Основное применение дистиллированной воды — химические лаборатории, где её используют для приготовления растворов, проведения анализов и ополаскивания химической посуды после мытья
Дистиллированная вода сама по себе пригодна для питья. Всемирная организация здравоохранения в 2011 году отметила, что не имеется достаточно данных для установления нижних (и верхних) пределов жёсткости воды[4]. Однако, поскольку питьевая вода может оказаться важным источником кальция и магния для некоторых категорий населения (у которых другие источники этих минералов ограничены), то при использовании деминерализованной воды в источниках водоснабжения рекомендовано добавлять соли кальция и магния до уровней, наблюдаемых в природной воде в данной местности[4].
Применяют для корректировки плотности электролитов, безопасной эксплуатации аккумуляторов, промывки систем жидкостного охлаждения, разбавления концентратов различных жидкостей и для прочих бытовых нужд. Например, для добавления в паровые утюги (полностью исключают появление накипи), для корректировки температуры замерзания незамерзающей стеклоомывающей жидкости и при цветной фотопечати.
Вода, соответствующая требованиям к дистиллированной воде, может быть получена, кроме дистилляции, также методами ионного обмена, обратного осмоса, комбинацией этих способов, или некоторыми другими.
Питьевая вода была дистиллирована из морской воды, по крайней мере, приблизительно с 200 г. н. э., когда процесс был четко описан Александром Афродисийским. Аристотель в своем трактате Метеорология(II.3, 358b16) также говорит о дистилляции воды[5].
Бидистиллированная вода — дважды очищенная вода. Получают перегонкой дистиллированной воды в кварцевом аппарате — бидистилляторе. По свойствам близка к химически чистой воде. Из-за высокой степени очистки при хранении и применении нужно предпринимать особые методы предосторожности для исключения возможности загрязнения бидистиллированной воды. Используют при работе с веществами особой чистоты.
Дальнейшая очистка[править | править код]
Для дальнейшей очистки (от летучих органических примесей) бидистиллят облучают гамма-излучением. После облучения для удаления продуктов радиолиза (в первую очередь углекислого газа) воду продувают очищенным аргоном.