Норма жесткости питьевой воды — как определить и формула расчета
Повышение внимания к норме жёсткости питьевой воды связано с повсеместным распространением стиральных и посудомоечных машин, поскольку определение расчётной загрузки моющих средств и частота очистки машин зависит от фактической степени жёсткости. Однако единицы измерения этого показателя в разных странах отличаются, а, кроме того, отличаются и составляющие для каждой из специфических единиц измерения.
Что такое жёсткая вода и что на неё влияет?
Степень жёсткости воды определяется как совокупность свойств, зависящих от содержания магния, кальция и других растворённых солей. Общий показатель складывается из постоянной и временной составляющей:
- Временная (карбонатная) устраняется кипячением благодаря способности ряда солей выпадать в осадок с образованием накипи. Характеризуется наличием бикарбонатов магния и кальция – при рН>8.3.
- Постоянная (некарбонатная) сохраняется при кипячении. Характеризуется наличием солей магния и кальция хлоридных, сульфатных и нитратных анионов.
На величину жёсткости влияют следующие факторы:
- интенсивность растворения гидропотоками горных пород (известняков, доломитов),
- использование подземных или поверхностных вод (поверхностные при прочих равных более «мягкие»),
- сезонные колебания для поверхностных ресурсов (показатель максимальной «мягкости» отмечается в периоды паводков и половодий с активным поступлением дождевых и талых «пополнений» в источники водоснабжения, а минимальная «мягкость» приходится на зимний период).
Единицы измерения, формулы и расчёты
В России единица измерения содержания солей по данному параметру называется «градус жёсткости» (°Ж), который с помощью распространённых онлайн-калькуляторов пересчитывается в единицы измерения, принятые в других странах (см. таблицу).
| Страна | Единицы измерения | Россия | Германия | Великобритания | Франция | США |
| Россия | 0Ж | 1 | 2.8 | 3.51 | 5 | 50.4 |
| Германия | 0DH | 0.357 | 1 | 1.25 | 1.78 | 17.84 |
| Великобритания | 0Clark | 0.285 | 0.8 | 1 | 1.43 | 14.3 |
| Франция | 0F | 0.20 | 0.56 | 0.70 | 10 | |
| США | ppm | 0.02 | 0.056 | 0.070 | 0.10 | 1 |
Так 1°Ж = 2,8°DH = 3,51°Clark = 5°F = 50,04ppm.
Каждая величина соответствует следующим показателям для воды:
- 1°Ж = 20,04 мг Ca2+ или 12,15 Mg2+ в 1 дм3
- 1°DH = 10 мг CaO в 1 дм3
- 1°Clark = 10 мг CaCO3 в 0,7 дм3
- 1°F = 10 мг CaCO3 в 1 дм3
- 1 ppm = 1 мг CaCO3 в 1 дм3
1°Ж = 1 мг-экв/л (чаще используют в практике) = 1/2 моль/м3 = 20,04 миллиграмма ионов Ca
Формула расчёта жёсткости воды при карбонатном типе:
- Ca2+ + 2HCO3— (при нагревании)= CaCO3↓ + H2O + CO2↑
- Mg2+ + 2HCO3— (при нагревании)= MgCO3↓ + H2O + CO2↑
Общая °Ж определяется как сумма временной и постоянной: Hобщ = Нкарб + Ннекарб
Нормативные требования
- Российские нормативы – СанПиН-ы 2.1.4.1074-01; ГН 2.1.5.1315-03 – определяют норму жёсткости питьевой воды в пределах 7°Ж с установлением нормативного значения для магния – в пределах 50 мг/л и не регламентируя его для кальция.
- Для бутилированного продукта, по СанПиН-ам 2.1.4.1116-02: °Ж находится в интервале 1,5-7 с показателями 25-130 мг/л/кальций, 5-65 мг/л/магний.
- Рекомендации ВОЗ для питьевой воды °Ж не регламентируют, определяя при этом норму 20-80 мг/л/кальций, 10-30 мг/л/магний, что ниже российских нормативных значений, однако фактические значения при водообеспечении, например, для Москвы, укладываются в рекомендации ВОЗ.
По данным московского водоканала, для Москвы (по сравнению с остальными крупными городами мира), характерны следующие показатели (см. таблицу):
| Жесткость, Ж | Кальций, мг/л | ||
| Москва | 2,0 — 5,5 | 46 | 11 |
| Париж | 5,0 — 6,0 | 90 | 6 |
| Берлин | 5,0 — 8,8 | 121 | 12 |
| Нью-Йорк | 0,3 — 0,4 | 6 | 1 |
| Сидней | 0,2 — 1,3 | 15 | 4 |
Если определять степень мягкости по 3 категориям, то деление соответствует следующим величинам:
- до 2°Ж – мягкая,
- в интервале 2-10°Ж – средне-жёсткая,
- свыше 10°Ж – жёсткая.
В некоторых случаях эта шкала детализируется, нередко со смещением, однако для конкретных ситуаций лучше применять не описательные, а точные значения градусов. Так жёсткость воды в аквариуме в норме составляет 3-15°Ж с разделением предпочитаемых интервалов для каждого вида рыб, моллюсков, водорослей. Например, раковина улиток остаётся в лучшем состоянии в жёсткой воде, а для живородящих рыб предпочтителен диапазон в 6-10°Ж. При этом следует учитывать, что содержание кальция в водной среде будет постепенно снижаться за счёт усвоения его обитателями аквариума.
В домашних условиях, помимо кипячения, применяют следующие способы смягчения:
- Реагентный – основан на добавлении кальцинированной соды или гашеной извести с выпадением в осадок нерастворимых соединений солей магния и кальция. Одним из самых эффективных реагентов считается ортофосфат натрия, способный снизить градус до 0,05°Ж.
- Мембранный – благодаря нанофильтрации и обратному осмосу полупронецаемой мембраны задерживаются ионы.
- Магнитный – благодаря магнитогидродинамическому резонансу карбонат кальция не кристаллизуется, а модифицируется в арагонит, который не откладывается на теплообменных поверхностях.
При этом различного типа аэраторные насадки на кран и экономители с поворотным механизмом (http://water-save.com/) благодаря постоянному механическому сдвигу шарниров в незначительной мере могут повлиять на образование накипи, однако ни остановить её образование, ни снизить значение °Ж не способны.
Читайте далее
Оставьте комментарий и вступите в дискуссию
Жесткость воды — норма и ее влияние на качество жизни
Жесткостью воды называют химическое качество, определяющее объем присутствующих в жидкости примесей соляного кальция и магния. Данный показатель — одно из ключевых качеств воды, которое всегда проверяется в процессе анализа жидкости на предмет пригодности для употребления и бытового применения. Знать о норме показателей и о том, как определить жесткость воды, крайне важно. Знание данного качества жидкости позволит сохранить здоровье и продлить работоспособность техники, так или иначе использующей в своей работе воду.Таблица наличия в воде катионов металлов и анионов и тест на жесткость воды позволяют узнать детальней о процессе формирования кристаллов жесткости и характере их развития. Влияние на временную жесткость воды и каждого из металлов является различным и зависит от типа жидкости и источника ее происхождения. К примеру такие металлы, как стронций, железо и марганец могут оказывать на состав и степень жесткости воды менее выраженное воздействие и практически не котироваться при анализе и проведении химической экспертизы. Алюминий оказывает влияние на общую жесткость воды, только если кислотность воды достигает нужного уровня, что встречается исключительно в природных водоемах. Из этого следует, что наличие и патогенное воздействие на воду выше указанных металлов при проверке воды бытового использования практически не учитывается из-за крайне низких показателей. Крайне малое влияние на показатель жесткости воды и способы ее устранения также может оказывать барий.
Какие можно выделить типы жесткости воды?
Проверка воды на показатель жесткости проводится в несколько этапов, с учетом типа водоема, в котором был произведен забор, условий содержания жидкости и цели произведенной экспертизы. Как определить жесткость воды в домашних условиях? Чаще всего жесткость при проверке делят на следующие группы:- Жесткость воды общего типа. В процессе определения вида жесткости воды этого показателя выводится единица наибольшей концентрации солей кальция и магния. Данный показатель рассчитывается путем выведения данных о постоянной жесткости воды и непостоянной, временной жесткости некарбонатного типа. Для того чтобы смягчить воду при завышенных показателях общей жесткости используют ионизирующие фильтрующие установки для воды и таблицу жесткости воды.
- Жесткость карбонатного типа. Проверка позволяет выявить наличие в составе воды карбонатных и гидрокарбонатных элементов солей кальция и магния. Такой вид жесткости нередко может называться временным, поскольку устранить завышенные показатели поможет кипячение и вываривание лишних солей. Нагревание воды способствует тому, что гидрокарбонаты и карбонаты кальция и магния раскладываются и становятся осадочным веществом на дне посудины. Такой тип не постоянной жесткости воды превращается в бытовой налет, который нередко можно наблюдать на посуде, в которой часто кипятится вода. Как устранить жесткость воды? Очистить жесткость такой воды можно также путем использования ионизирующих фильтров или механизмов для устранения лишних солей.
- Жесткость воды некарбонатного типа. Данный тип проверки позволяет выявить в воде присутствие кислот солей кальция и магния сильного воздействия. В число таких кислот входят серная, азотная и соляная кислоты. Данный вид не карбонатной жесткости воды нельзя устранить простым кипячением воды и вывариванием патогенных элементов. Постоянную жесткость нередко очищают ионизирующими фильтрами или растворяющими соль веществами.
В чем измеряется жесткость воды? Стоит отметить, что мировая таблица единиц измерений имеет несколько разных обозначений для типов и разновидностей жесткости. Каждая из этих единиц взаимосвязана с остальными. На территории постсоветского пространства до их пор используют единицу моль для обозначения показателя определения общей жесткости воды. В европейских государствах могут нередко использовать такие обозначения как do, dH, fo. В США используется обозначение ppm CaCO3.
Закажите бесплатно консультацию эколога
Почему вода становится жесткой?
Изначально стоит отметить, что вся жидкость мирового океана имеет определенные показатели жесткости, то есть в ее химическом составе неизменными веществами являются соли кальция и магний, а также несколько других щелочных металлов и земельных веществ. От чего зависит жесткость воды? Такой состав жидкости обуславливается тем, что минеральные воды изначально проистекают на поверхность из залежей многовековых пластов известняка и разных типов доломита. Соли кальция и магний попадают в воду путем химической связи диоксида углерода с группой минералов. Процесс выветривания и химической деформации горных пород приводит к образованию кристаллов жесткости в воде. Их источники — природные залежи известняков, гипса и доломитов. Ионизирующие вещества многовековых залежей, через которые протекает вода, могут появляться из-за еще не изученных биологических реакций и процессов в глубине плит на месте, из которого проистекает жидкость. Добавлять в состав побочные минералы и кристаллы способны и другие химические примеси, сточные воды, элементы и организмы окружающей среды.
Что показывает таблица жесткости воды?
Большинство минерализованной воды, которая попадает в открытые водоемы и становится источником жидкости для бытового и промышленного существования, имеет жесткость, превышающую показатели 75-85%. Как проверить жесткость воды в домашних условиях? Такой высокий показатель свидетельствует о том, что вода содержит повышенное количество солей кальция и магния из-за наличия ионизирующих горных пород. С учетом источника минеральной воды, в ряде случаев уровень жесткости не превышать 60%. Важно отметить, что от показателя минерализации напрямую зависит наличие ионов кальция. Жесткость воды, норма для питьевой воды такова: в открытых водоемах с пресной водой уровень содержания кальция не поднимается выше, чем 1 г из расчета на литр воды; соленые водоемы могут содержать примерно 10-15 г солей кальция на литр.
Стоит сказать, что показатель жесткости и концентрация солей кальция в воде напрямую определяется типом воды и местом ее расположения. Так, поверхностные воды нередко могут иметь наиболее низкие показатели жесткости, тогда как подземные водоемы или озера могут быть максимально жесткими и насыщенными солями. Концентрация солей в воде находится также в прямой зависимости от времен года и сезонных осадков. В конце зимы наличие кристаллов жесткости может увеличиваться, однако в период таяния снега и выпадения мягкой воды в виде снега и дождя кристаллы солей разбавляются и показатели жесткости заметно снижаются. Максимально жесткой вода считается в океанах и морях, где концентрация солей является максимально высокой.
Как может влиять показатель жесткости на качество жидкости?
Жесткость воды и ее показатели являются позволительными и удовлетворительными, в зависимости от цели использования жидкости. Если вода предназначается для использования в бытовых целях, показатели ее жесткости не должны превышать 2-6 мг на литр. Такая концентрация солей кальция считается максимально допустимой для бытового использования и не вредит человеческому здоровью. Прибор для измерения жесткости воды показывает, что промышленные цели использования воды могут повышать показатель жесткости до 10 мг на литр, однако не более этих рамок. Важно отметить, что вода с высоким показателем жесткости является, как правило, слишком горькой и имеет характерный запах, а также может оказывать патогенное воздействие на пищеварительную систему и желудочно-кишечный тракт, что делает ее непригодной для использования в пищевых или бытовых целях.
Важно сказать, что Всемирная организация здравоохранения проводит множество исследований и до сих пор не может найти единого ответа на вопрос о том, насколько велика патогенность влияния жесткой воды на человеческий организм и полезно ли постоянное использование в пищу только мягкой и фильтрованной воды без примесей солей и кальция. Предварительные исследования говорят о том, что некоторые типы вод с повышенным показателем жесткости могут провоцировать сердечно-сосудистые заболевания, проблемы с суставами и каменные болезни.
Специалисты компании ЭкоТестЭкспресс производят качественную аналитику жесткости воды в зависимости от требуемых целей и особенностей проверки. Связаться с нами, оставить заявку можно в онлайн-форме ниже.
Жесткая питьевая вода — что это такое, как определить вид общей жесткости и в чем она измеряется: таблица определения норм в единицах измерения, какой вред человеку наносит и как устранить
25.12.2019 13:29

Сегодня мы расскажем о понятии «жесткость воды», что это такое, ее виды, в каких единицах измерения ее определяют, есть ли допустимые нормы для питья, а также чем она плоха и какой вред для человека она может нанести. С данным термином мы сталкиваемся практически ежедневно при просмотре рекламы, а также при использовании порошка или моющего средства для посудомоечной машины, при установке фильтра. Но зачастую мы не подозреваем, какой показатель именно у нас – общий по городу или индивидуальный.
Вторая распространенная проблема, когда сталкиваются с данной характеристикой, – при монтаже собственной, индивидуальной точки доступа к скважине или колодцу. Обычно требуется произвести химический анализ, чтобы определить, какая фильтрационная система необходима. И при высоком содержании примесей (кальция и магния) требуется специальное оборудование для устранения данных солей. Но если вам не подскажет это специалист, необходимо самостоятельно разобраться в теме. Давайте это и сделаем.
Жесткость воды – что это такое

Это совокупное физико-химическое свойство жидкости, которое предопределяет ее использование и возможности эксплуатации в различных условиях, питьевое качество. Согласно второму определению, это уровень содержания в водном растворе примесей – солей щелочноземельных металлов (они в мельчайших фракциях находятся в подземных слоях), магния, кальция, а также других элементов, которые полностью не растворяются. Для этого следует понять, что Н2О – это только в учебниках химии, а в жизни химический состав гораздо более разнообразен.
Как понять, что вода жесткая, и что это значит? Легко определить повышенную жесткость можно в домашних условиях обычным кипячением. Если по краям после такого теста остался белый след, который красится как меловая крошка, то, скорее всего, это кальциевые отложения.

Данное свойство очень важно с точки зрения хозяйственного значения и потребительских качеств. Особенно это значимо с двух сторон:
-
для здоровья потребителей при употреблении в качестве напитка, а также при использовании в гигиенических процедурах, ведь волосы после мытья такой водой могут стать безжизненными и сухими, а кожа грубой;
-
для долговечности работы нагревательных элементов в стиральной и посудомоечной машинах (ТЭНы), чайниках и иных нагревателях – на них образуется накипь и они быстро выходят из строя.
Также это оказывает негативное воздействие на качество стирки, поскольку химические элементы препятствуют протеканию нормальной реакции стирального порошка, он может слабо вспениваться или недостаточно хорошо проникать в структуру ткани и избавлять ее от загрязнений.
Окружающая природа, горные породы и залежи различных полезных минералов совершенно разные на каждом участке гидродобычи (это зависит от почвы, близлежащих предприятий, глубины пролегания источника), поэтому в разных водоемах и жесткость различная. Именно по этой причине перед использованием обязательно берут пробы, делают химический анализ образца на наличие вредных веществ. Угадать наверняка без этого очень сложно, но можно указать на такую закономерность – чем глубже пролегают грунтовые воды, тем они более жесткие, на поверхности они мягче, поскольку протекают через меньшее количество различных земельных слоев.

Вторая тенденция характерна для природных, естественных водоемов и связана с таянием снегов и дождями. Максимальный показатель зимой, а минимальный – весной сразу после схода льда.
Дадим еще один простой вариант определения, каких примесей больше – магния или кальция. Магниевые соли хуже растворяются, поэтому дают осадок, также они имеют горький привкус.
А теперь посмотрим на сравнительную таблицу:
| Градусы dH |
| Жесткость в мг. х экв/л | Аналог в ppm | ||
| 13 – 22 | Жесткая | 8 – 12 | 210 – 320 | ||
| 9 – 12 | Средняя | 4 – 8 | 140 – 210 | ||
| 5 – 8 | Мягкая | 1,4 – 4 | 70 – 140 |
Шкала жесткости воды или как определить параметр по таблице
Сперва дадим график, согласно которому любую жидкость можно разделить на классы:

Alkaline – щелочная, она же карбонатная. Степень определяется наличием и концентрацией карбонатов и гидрокарбонатов кальция и магния. Особенность в том, что данные микроэлементы выпадают в осадок сразу после кипячения, поэтому такие водные растворы также называют непостоянными или временными.
Вторая часть шкалы Acidic – то есть, кислотосодержащая или некарбонатная. В ее составе не карбонаты и гидрокарбонаты, а кислотные соли на основе вышеперечисленных химических веществ. И они более устойчивые.
И есть также общая – она включает суммарное количество примесей. Чаще всего в бытовых ситуациях определяется именно последняя, то есть итоговая сумма микроэлементов. Но в ряде ситуаций имеет наибольшее значение именно одно состояние магниевых и кальциевых солей, их соединения. Если в анализе жидкости или в иной ситуации вы видите такую шкалу, то можно ориентироваться по цветам и картинке выше. То есть от 0 до 7 вы имеете дело с кислотными солями, а с 7 до 14 – с гидрокарбонатами.
Единицы измерения
Мы объяснили, какую воду называют жесткой, чем обусловлена общая жесткость и какие виды различают, теперь обсудим, в чем измеряется показатель и что на него влияет.
К сожалению, нет мирового стандарта, поэтому, используя аппаратуру европейского изготовления, будьте готовы к непонятным на первый взгляд обозначениям. Российскими учеными были установлены следующие единицы – моль на кубический метр. А перед этим ставится число, которое соответствует значению перевоплощения в миллиграммы на литр. А что можно встретить еще:
-
d° или dH – придумали в Германии, но применяют на всей территории Запада;
-
f° – пишут во Франции;
-
ppm CaCO3 – используют в США.
Жесткость: виды
По количеству примесей можно разделить воду на:
-
Мягкую. Она соответствует небольшой доли микроэлементов в составе. Получить ее можно после многочисленной обработки – специальной фильтрации, перегонки или многоразового кипячения, когда из-за термального воздействия карбонаты выпадают в осадок. Наибольшая мягкость у дождевой воды. Стоит отметить, что она благотворно воздействует на кожу, волосы, а также на здоровье в целом.
-
Среднюю. Это самый распространенный вариант, который считается приемлемым для бытовых и промышленных нужд. Именно поэтому такого качества жидкость идет по городскому и, вероятнее всего, по частному трубопроводу. Она вполне пригодна для приготовления пищи. В большинстве открытых природных водоемов вода тоже преимущественно средней жесткости.
-
Жесткую. В ней либо искусственным путем растворяют примеси, либо влага проходит через такие слои почвы, что сама быстро приобретает высокую концентрацию веществ. Самым распространенным вариантом можно считать морскую воду.
Как измерить и понять, допустимая или повышенная жесткость – способы

Представляем три варианта:
-
Наиболее точный – заказать лабораторный анализ. Во время пристального изучения будет произведен разбор на химические вещества, поэтому справка не только покажет общий показатель, но и конкретное содержание микроэлементов – какие и в каком объеме присутствуют в образце. Необходимо делать такую экспертизу владельцам частных домов при оборудовании скважины или колодца и заказе фильтрационной системы.
-
Быстрый и доступный каждому. Для этого стоит приобрести тестер в виде бумажной полоски. Его нужно опустить в жидкость, подождать указанный период, а затем определить цвет индикатора. Дело в том, что на активную части нанесен реагент, который вступает в реакцию и показывает количество примесей. Минус в сложности интерпретации и достаточно неточных результатах.

-
Домашний химический опыт. В два одинаковых мерных стакана следует нарезать по одному грамму хозяйственного мыла 72%. Затем залейте их подогретой водой – в одну емкость дистиллированной, во вторую водопроводной. В первом бокале будет уровень 7 см. А во втором – остановитесь вливать жидкость в тот момент, когда появится мыльная пена. Затем измерьте разницу влитой влаги. Каждый 1 см раствора соответствует двум °dH.
Какая должна быть оптимальная жесткость воды – норма
Как и единиц измерения, так и стандартов для всего мира общих нет. Зато в России в 2014 году появились жесткие нормативы, закрепленные ГОСТ 31865-2012. В нормативном документе показатель указывается в градусах и обозначается как °Ж. Он соответствует одному мг-экв/л. Посмотрим на таблицу нормативов, принятых у нас и в Америке:
| Качество жидкости |
| Пределы в США, в мг-экв/л | ||
| Мягкая (Soft) | <2 | <1,2 | ||
| Средняя (Moderate hardness) | От 2 до 10 | От 1,2 до 2,4 | ||
| Жесткая (Hard hardness) | >10 | От 2,4 до 3,6 | ||
| Очень жесткая (Very Hard hardness) | Нет нормы | >3,6 |
Как видим, российские требования гораздо более мягкие. Именно по этой причине бытовая техника, произведенная в Америке, служит гораздо меньше в контакте с нашим трубопроводом, чем у себя на родине.
Сравнивая европейские показатели, на примере Германии, мы сталкиваемся с такой же проблемой – у нас слишком гибкие рамки среднего качества. Таким образом, фактически любая водопроводная вода подходит под норматив.

Но употреблять такую жидкость попросту небезопасно, поэтому не стоит надеяться на государственные нормы, берегите здоровье своих домочадцев самостоятельно. Для этого устанавливайте системы фильтрации – обратитесь в компанию «Вода Отечества» для комплексной услуги установки фильтрационной системы на вашем участке.
Нормы для питьевой воды
Данный показатель регулирует не столько ГОСТ, сколько Всемирная Организация Здравоохранения и СанПиН. По рекомендации ВОЗ в одном литре жидкости для питья не может быть растворено более 30 мг магния и 80 мг кальция. А СанПиН 2.1.4.1074-01 предопределяет до 50 мг на магниевые отложение, кальциевые соли не регламентируются. Зато указана общая жесткость – до 7 градусов.
Влияние жесткой и мягкой воды – как отличить, рекомендации

ВОЗ утверждает, что употреблять необходимо только жидкость низкой или средней жесткости с установленными границами для примесей. Не всегда водопроводный ресурс, к сожалению, соответствует этим нормативам. Негативные последствия использования воды с повышенной жесткостью приводят к:
-
скорым поломкам бытовой техники – часто приходится заменять нагревательный элемент;
-
неисправностям инженерных систем – стенки труб постепенно разрушаются из-за образования отложений, а также засоряются;
-
испорченному здоровью;
-
мелким неприятностям – например, меняется вкус еды или качество постиранных вещей (моющий состав хуже пенится), мягкость вымытых волос.
Рекомендуем не дожидаться негативного воздействия и установить мощную систему фильтрации. Также стоит использовать не водопроводную, а специально подготовленную для питья жидкость, а при стирке или во время запуска посудомоечной машины добавлять специальные средства от накипи.
Вред для человека
Если соли поступают в чрезмерном количестве, они не успевают выводиться естественным образом и скапливаются в мочевых протоках и пузыре, почках – так начинается мочекаменная болезнь.
При умывании кожа становится более сухой, может образоваться раздражение. А на волосах появляется корочка, которая препятствует их естественному увлажнению и питанию подкожным жиром. Они становятся безжизненными.
Мясо, приготовленное в водном растворе с большим содержанием кальция, хуже усваивается организмом.
Как избавиться от жесткости воды и от чего она зависит

Если перед вами стоит вопрос что делать непосредственно с водопроводной жесткой водой, то выходов из ситуации не много:
-
поставить фильтр внутри квартиры, регулярно проверять систему и менять кассеты;
-
кипячение – стоит учесть, что данным способом можно убрать только карбонатный осадок, он останется внизу чайника или на его стенках, но если примесь в виде магниевых и кальциевых солей, способ не подходит;
-
заморозка – емкость следует проморозить так, чтобы на 90% образовался лед, а остальные 10% – слить, ведь именно концентрированный раствор замораживается медленнее всего.
Как повысить и понизить жесткость в аквариуме

Аквариумные рыбки – очень прихотливые создания, даже морские виды. У них всегда есть пределы, родной ареал обитания. Если вы хотите, чтобы они жили и размножались, следует воссоздать все необходимые условия.
Если нужно увеличить показатель солей, на дно можно положить известняк или мрамор, добавить хлористый кальций или магнезию.
В обратном случае придется прибегнуть к одному из вышеперечисленных трех способов. Чем больше объем резервуара, тем выгоднее будет создание фильтрационной системы.
Как избавиться от примесей в скважине
При бурении индивидуальной точки доступа к ресурсу просто необходимо делать предварительный анализ. Очень часто от этого зависит выбор расположения, а также глубина пролегания труб и насоса. Но если на участке испорченные грунтовые воды, поскольку они протекают через многочисленные солесодержащие почвенные слои, то и выбор места особенно не поможет, нужно производить фильтрацию. Обратитесь в компанию «Вода Отечества», чтобы специалисты выбрали для вас индивидуальное комплексное решение.
Методы устранения жесткости
Их несколько, все – эффективные. Выбирать следует, ориентируясь на конкретные показатели и степень эксплуатации – постоянно или сезонно.
Термоумягчение
Иными словами, это обычное кипячение. Следует немного приоткрыть крышку и ждать полного осадка примесей. Но если концентрация превышает 4 мл на литр, то способ не эффективен, поскольку испарение влаги произойдет быстрее, чем полное осаждение частиц.
Реагентное умягчение
В качестве реагентов чаще всего выступает обычная пищевая сода и известь. Они поочередно вводятся в раствор, отдельные химические элементы вступают с ними в реакцию с высвобождением Н2О и выпадают в осадок.
Катионирование
Это обессоливание с использованием катионов натрия или водорода. В первом случае это добавление обычной поваренной соли – что недорого, а также просто в утилизации продуктов регенерации.
Обратный осмос
В качестве фильтра выступает мембрана из ацетилцеллюлозы. С ее помощью достигается практически дистиллированная чистота. Такие установки небольшие, они хорошо берегут энергию. Но есть и минус – из раствора убираются практически все микроэлементы, а они важны для жизнедеятельности.
Электродиализ
Экологичный способ обессоливания. Он основывается на том, что вещества (положительные и отрицательные ионы) притягиваются к электродам под воздействием электрического заряда.
Дистилляция
Это промышленная перегонка жидкости. В ходе нагрева образуется водяной пар. Он впоследствии охлаждается и собирается как конденсат.
Вместо заключения
Мы рассказали, от чего зависит жесткость воды, чем она опасна и как ее устранить. Завершая тему, посмотрим видео:
TDS метр-измеряем жесткость воды из различных источников, в том числе природных.
Здравствуйте, сегодня речь пойдет о жесткости воды измеряемой с помощью TDS метра или солемера. Данный прибор уже неоднократно обозревался на сайте, но так как я проживаю в предгорьях Кавказа, была мысль пойти с этим прибором в поход и померить жесткость воды в горной реке, горном ручье, лесном роднике. Поэтому я иду в реальный поход а вас приглашаю в виртуальный. Ну и померяю дождевую, магазинную минеральную, бутелированную не минеральную и водопроводную воду. Интересно? Тогда читаем далее.Жёсткость воды — совокупность химических и физических свойств воды, связанных с содержанием в ней растворённых солей щёлочноземельных металлов, главным образом, кальция и магния (так называемых «солей жёсткости»).(wikipedia)
Вот поэтому этот прибор так же называют солемером. TDS расшифровывается и переводится как Total Dissolved Solids — общее содержание растворенных твердых веществ.
Жесткость воды это как раз то что отвечает за накипь в чайнике и камни в почках.
Пробежимся немного по самому прибору.
Спереди находятся кнопка включения/выключения, кнопка фиксации показаний и дисплей для вывода показаний.
В низу под колпачком два электрода которые и опускаются в воду
На тыльной стороне находится клипса и калибровочный винт
В колпачке с верху встроен батарейный отсек на две батарейки типа LR44
Замер делается так: Включаем прибор, он показывает 000, опускаем электроды в воду и смотрим значение.
Индикация трехсегментная, если значение больше 999 то внизу появляется знак х10.
Прибор измеряет в американских единицах измерения ppm, у нас в России принята единица миллиграмм-эквивалент на литр, мг-экв/л.
1 мг-экв/л=50,05 ppm
Согласно Санитарным нормам и правилам за номером СанПиН 2.1.4.1074-01
максимально допустимая концентрация равна 7 мг-экв/л. или 350ppm
на это значение и будем опираться, так же приведу еще вот такую таблицу ей тоже можно верить
Данный прибор калибруется, специальной калибровочной жидкостью в которой значение содержания солей известно заранее, этот прибор уже откалиброван продавцом.
Температура воды при измерениях особой роли не играет так как в характеристиках прибора заявлено такое свойство:
Auto temperature compensation
Для начала проведем комнатно стаканные замеры
Питьевая водопроводная вода из крана
она же кипяченная, как видно немного меньше содержание солей, кипячение смягчает воду. 
дождевая вода, просто вышел на балкон и набрал сбегающую с крыши воду во время дождя.
Бутелированная вода из кулера, заявлено что талая, ледниковая, производителя специально не показываю.
газированная минеральная вода из магазина, почему такие показания не знаю эта вода добывается из скважины, она обогащена всякими элементами может быть по этому.
Ну а теперь в поход, первая у нас горная река Малая Лаба
вот так выглядит


вот такие показания
в процессе замеров пару раз закинул удочку, в надежде поймать форель, неповезло.
Зато попалась вот такая плотвичка.

Следующий это родник в лесу. У нас считается что в этом роднике очень чистая вода, много местных набирают эту воду для питья, и готовят только из нее. Даже ходит байка что кто то отвозил воду из него в какой то научно исследовательский институт, там сделали анализ и сказали что вода уникальная, может мертвого поднять, лично я не верю.
Меня отвлекли, поэтому сфотографировать забыл, показания были 60 ppm, в низу в видео этот родник есть.
Что характерно почти такие же как в реке в которой раннее замерил, река от родника протекает примерно в полукилометре, у меня есть подозрения что это одна и та же вода, только за счет фильтрации через почву, в роднике она выглядит кристально чистой.
Следующее на очереди место, это небольшой горный ручей с маленьким 2-х метровым водопадом.
Вот такие виды по пути к водопаду
А вот и сам водопад
Измерения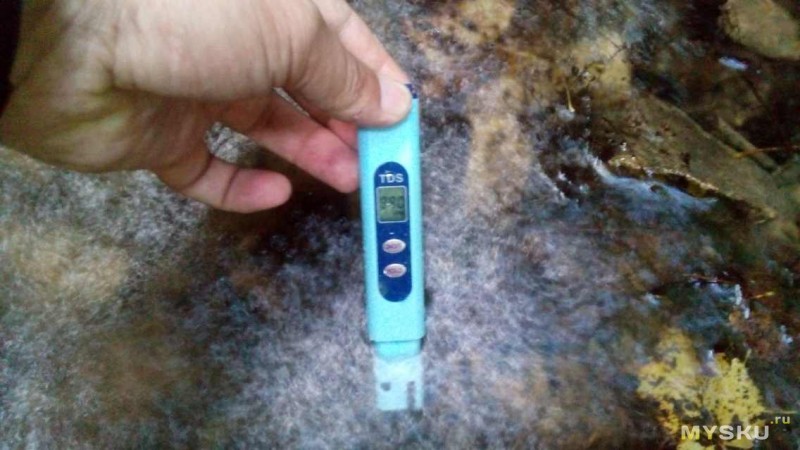
внизу брызги, вода разлетается во все стороны, поэтому замеры было делать не удобно и тем не менее померил и результат сильно удивил, на фото не получилось нормально снять но в итоге результат был за 1000 ppm, внизу с лева мигала надпись x10. Почему такие высокие показания в этом ручье я не знаю, выше он вытекает из пещеры возможно по этому.
В заключение скажу, что прибор в основном в быту необходим владельцам фильтрующих систем, что бы определять когда необходимо менять фильтрующий элемент.
Видео похода по водоемам на моем youtube канале, кому интересно обязательно подписывайтесь.
Так же видео распаковки.
До свидания.
Норма жесткости питьевой воды. Какая нормальная жесткость воды

30 октября 2017 / 13980 просмотров
Один из важных показателей качества воды – это её жёсткость. Жёсткость воды определяется наличием в ней солей кальция и магния. Это так называемые «соли жёсткости». Для нормального функционирования организма необходимо, чтобы их концентрация была в норме. Если же этот показатель превышен, то вода считается жёсткой. Насколько употребление такой воды опасно для здоровья человека? Давайте разберёмся.
Норма жёсткости питьевой воды: что мы пьём
Согласно государственным санитарным нормам, максимально допустимая жёсткость воды – не больше 7 ммоль/дм3. Более жёсткой является вода из подземных источников, особенно, если данная местность богата солями кальция и магния. Жёсткость воды из поверхностных источников относительно невысокая.
Жёсткая вода содержит переизбыток солей кальция и магния. По словам специалистов лаборатории «УкрХимАнализ», по такому показателю как жёсткость бракуется около половины всех исследуемых образцов. Впрочем, заподозрить, что показатель жёсткости воды превышен, можно и без специального анализа. Быстро появляется накипь на чайнике? Чай и кофе кажутся невкусными? Плохо пенятся моющие средства? Барахлит сантехника? Причиной всех этих проблем может быть именно повышенная жёсткость воды. При этом налёт на чайнике вы видите сразу, а вот проблемы с бытовой техникой (например, стиральной и посудомоечной машиной) станут заметны лишь со временем, когда уже будет необходим серьёзный ремонт. Ведь накипь образуется на внутренних поверхностях (деталях барабана, нагревательных элементах и т.п.).
Но проблемы с бытовыми приборами – это ещё пол-беды. Гораздо хуже, что превышение нормы жёсткости воды для питья может привести к серьёзным последствиям для здоровья.
Постоянно употребляя жёсткую воду, вы можете заметить, что существенно ухудшилось состояние кожи и волос. Кожа становится сухой, а волосы ломкими, тусклыми, может появиться перхоть. И это только внешние проявления. Соли откладываются в организме, что приводит к болезням суставов, а также появлению камней в почках и жёлчном пузыре.
Какая норма жёсткости воды: оптимальный показатель
Слишком жёсткая вода, как и чересчур мягкая неполезна для здоровья – утверждают специалисты. Нормальная жёсткость воды – около 3 – 4 ммоль/дм3. По результатам мониторинга, проведённого в 2014 году в разных городах Украины, повышенной жёсткостью характеризуется вода во Львове и Харькове. Дело в том, что источниками водоснабжения здесь являются подземные водоносные горизонты, а также водохранилище, подпитываемые подземными водами. В таких областных центрах как Днипро, Черкассы, Одесса, Николаев, а также Киев – нормальная жёсткость воды, соответствующая среднему показателю. Причина в том, что водоснабжение здесь идёт из поверхностных источников.
Жёсткость воды может измеряется в разных единицах, в разных странах приняты свои стандарты. Например, в Украине жёсткость может измеряться как в ммоль/дм3, так и в мг-экв/л. Так, 1 ммоль/дм3 – это 2 мг-экв/л. Также в Интернете или специальной литературе легко найти таблицу жёсткости воды, позволяющую перевести отечественные показатели жёсткости воды в единицы, принятые за рубежом (в Германии, Франции, США и т.п.).
Жёсткость воды: заботимся о здоровье
Итак, мы разобрались, какая жёсткость воды является оптимальной для организма. Как же узнать, соответствует ли вода в вашем кране этим нормам? Необходимо сделать анализ воды на жёсткость. Лаборатория «УкрХимАнализ» предлагает различные пакеты «Базовый» (20 показателей), «Расширенный» (30 показателей), «Максимальный» (50 показателей). Если результаты анализа показали, что вода слишком жёсткая или находится на пределе нормы, то возможный вариант решения проблемы – установка фильтра-умягчителя воды. Если же, кроме повышенной жёсткости, есть и другие несоответствия, то специалисты лаборатории помогут в выборе подходящего прибора, чтобы исправить ситуацию.
У Вас есть вопросы или Вам нужна консультация?
Заполните форму и получите бесплатную консультацию!
Читайте похожие статьи:
Подробнее про жёсткость воды — Всё самое интересное!
Продолжаем раздел «Вода» и подраздел «Теоретические основы» статьёй Подробнее про жёсткость воды. Подробнее — потому что тема жёсткости воды уже всплывала на нашем интересном и полезном сайте в статье Жёсткая вода. Жёсткость воды вспоминается в первую очередь с накипью и умягчителем воды — прибором, который должен справляться с жёсткой водой и препятствовать образованию накипи.
Подробнее про жёсткость воды мы поговорим про жёсткость воды с точки зрения химии, разновидности жёсткости воды, единицы измерения жёсткости воды (в том числе в разных странах). Рассмотрим, откуда берётся жёсткость воды и как влияет жёсткость на качество воды.
Для начала немного про термины. В статье часто упоминаются слова «катионы» и «анионы». Катионы и анионы — это положительно и отрицательно заряженные ионы. Ион (др.-греч. ἰόν — идущее) — электрически заряженная частица, образующаяся в результате потери или присоединения одного или нескольких электронов. Соответственно, если потеря — то заряд частицы положительный. Если присоединение — то заряд частицы отрицательный (поскольку электрон имеет однозначно отрицательный заряд).

Жёсткость воды с точки зрения химии
Понятие жесткости воды принято связывать с катионами кальция (Са2+) и в меньшей степени магния (Mg2+). В действительности, все двухвалентные катионы в той или иной степени влияют на жесткость. Они взаимодействуют с анионами, образуя соединения (соли жесткости) способные выпадать в осадок. Одновалентные катионы (например, натрий Na+) таким свойством не обладают.
В данной таблице приведены основные катионы металлов, вызывающие жесткость, и главные анионы, с которыми они обЪединяются.
| Катионы | Анионы |
| Кальций (Ca2+) | Гидрокарбонат (HCO3—) |
| Магний (Mg2+) | Сульфат (SO42-) |
| Стронций (Sr2+) | Хлорид (Cl—) |
| Железо (Fe2+) | Нитрат (NO3—) |
| Марганец (Mn2+) | Силикат (SiO32-) |
На практике стронций, железо и марганец оказывают на жесткость столь небольшое влияние, что ими, как правило, пренебрегают. Алюминий (Al3+) и трехвалентное железо (Fe3+) также влияют на жесткость, но при уровнях рН, встречающихся в природных водах, их растворимость и, соответственно, «вклад» в жесткость ничтожно малы. Аналогично, не учитывается и незначительное влияние бария (Ва2+).
Разновидности жесткости воды.
Различают следующие разновидности жёсткости воды:
Общая жесткость. Определяется суммарной концентрацией ионов кальция и магния. Представляет собой сумму карбонатной (временной) и некарбонатной (постоянной) жесткости.
Карбонатная жесткость. Определяется наличием в воде гидрокарбонатов и карбонатов (при рН>8.3) кальция и магния. Данный тип жесткости почти полностью устраняется при кипячении воды и поэтому называется временной жесткостью. При нагреве воды гидрокарбонаты распадаются с образованием угольной кислоты и выпадением в осадок карбоната кальция и гидроксида магния.
Некарбонатная жесткость. Обусловлена присутствием кальциевых и магниевых солей сильных кислот (серной, азотной, соляной) и при кипячении не устраняется (постоянная жесткость).
Единицы измерения жёсткости воды.
В мировой практике используется несколько единиц измерения жесткости, все они определенным образом соотносятся друг с другом. В России Госстандартом в качестве единицы жесткости воды установлен моль на кубический метр (моль/м3). На Украине используется как моль/м3, так и мг-экв/л (миллиграмм эквивалент на литр). Численно эти значения совпадают. Кстати, л и дм3 — это одно и тоже, литр и дециметр кубический.
Кроме этого в различных странах широко используются такие единицы жесткости, как немецкий градус (do, dH), французский градус (fo), американский градус, ppm CaCO3.
Соотношение этих единиц жесткости представлено в следующей таблице:
| Единицы жесткости воды | ||||
| Моль/м3 (мг-экв/л) | Немецкий градус, do | Французский градус, fo | Американский градус | ppm (мг/дм3)СаСО3 |
| 1.000 | 2.804 | 5.005 | 50.050 | 50.050 |
Примечание:
- Один немецкий градус соответствует 10 мг/дм3 СаО или 17.86 мг/дм3 СаСО3 в воде.
- Один французский градус соответствует 10 мг/дм3 СаСО3 в воде.
- Один американский градус соответствует 1 мг/дм3 СаСО3 в воде.
Чтобы не заморачиваться пересчётами вручную, можно создать табличку пересчёта единиц жёсткости. Которую, кстати сказать, вы можете скачать по ссылке Таблица пересчёта единиц измерения жёсткости воды.
Откуда берётся жёсткость воды
Ионы кальция (Ca2+) и магния (Mg2+), а также других щелочноземельных металлов, обуславливающих жесткость, присутствуют во всех минерализованных водах. Их источником являются природные залежи известняков, гипса и доломитов. Ионы кальция и магния поступают в воду в результате взаимодействия растворенного диоксида углерода с минералами и при других процессах растворения и химического выветривания горных пород. Источником этих ионов могут служить также микробиологические процессы, протекающие в почвах на площади водосбора, в донных отложениях, а также сточные воды различных предприятий.
Жесткость воды колеблется в широких пределах и существует множество типов классификаций воды по степени ее жесткости. Ниже в таблице приведены целых четыре примера классификации. Две классификации из российских источников — из справочника «Гидрохимические показатели состояния окружающей среды» и учебника для вузов «Водоподготовка». A две — из иностранных: нормы жесткости немецкого института стандартизации (DIN 19643) и классификация, принятая Агентством по охране окружающей среды США (USEPA) в 1986.
Таблица наглядно иллюстрирует гораздо более «жесткий» подход к проблеме жесткости за границей. И не без причины, о чём — ниже.

Обычно в маломинерализованных водах преобладает (до 70%-80%) жесткость, обусловленная ионами кальция (хотя в отдельных редких случаях магниевая жесткость может достигать 50-60%). С увеличением степени минерализации воды содержание ионов кальция (Са2+) быстро падает и редко превышает 1 г/л. Содержание же ионов магния (Mg2+) в высокоминерализованных водах может достигать нескольких граммов, а в соленых озерах — десятков граммов на один литр воды.
В целом, жесткость поверхностных вод, как правило, меньше жесткости вод подземных. Жесткость поверхностных вод подвержена заметным сезонным колебаниям, достигая обычно наибольшего значения в конце зимы и наименьшего в период половодья, когда обильно разбавляется мягкой дождевой и талой водой. Морская и океанская вода имеют очень высокую жесткость (десятки и сотни мг-экв/дм3).
Как влияет жёсткость на качество воды
С точки зрения применения воды для питьевых нужд, ее приемлемость по степени жесткости может существенно варьироваться в зависимости от местных условий. Порог вкуса для иона кальция лежит (в пересчете на мг-эквивалент) в диапазоне 2-6 мг-экв/л, в зависимости от соответствующего аниона, а порог вкуса для магния и того ниже. В некоторых случаях для потребителей приемлема вода с жесткостью выше 10 мг-экв/л. Высокая жесткость ухудшает органолептические свойства воды, придавая ей горьковатый вкус и оказывая отрицательное действие на органы пищеварения.
Всемирная Организация Здравоохранения не предлагает какой-либо рекомендуемой величины жесткости по показаниям влияния на здоровье. В материалах ВОЗ говорится о том, что хотя ряд исследований и выявил статистически обратную зависимость между жесткостью питьевой воды и сердечно-сосудистыми заболеваниями, имеющиеся данные не достаточны для вывода о причинном характере этой связи. Аналогичным образом, однозначно не доказано, что мягкая вода оказывает отрицательный эффект на баланс минеральных веществ в организме человека.
Вместе с тем, в зависимости от рН и щелочности, вода с жесткостью выше 4 мг-экв/л может вызвать в распределительной системе водопровода отложение шлаков и накипи (карбоната кальция), особенно при нагревании. Именно поэтому нормами Котлонадзора вводятся очень жесткие требования к величине жесткости воды, используемой для питания котлов (0.05-0.1 мг-экв/л).
Кроме того, при взаимодействии солей жесткости с моющими веществами (мыло, стиральные порошки, шампуни) происходит образование «мыльных шлаков» в виде пены. Это приводит не только к значительному перерасходу моющих средств. Такая пена после высыхания остается в виде налета на сантехнике, белье, человеческой коже, на волосах (неприятное чувство «жестких» волос хорошо известное многим). Главным отрицательным воздействием этих шлаков на человека является то, что они разрушают естественную жировую пленку, которой всегда покрыта нормальная кожа и забивают ее поры.
Признаком такого негативного воздействия является характерный «скрип» чисто вымытой кожи или волос. Оказывается, что вызывающее у некоторых раздражение чувство «мылкости» после пользования мягкой водой является признаком того, что защитная жировая пленка на коже цела и невредима. Именно она и скользит. В противном случае, приходится тратиться на лосьоны, умягчающие и увлажняющие кремы и прочие хитрости для восстановление той защиты кожи, которой нас и так снабдила природа.
Вместе с тем, необходимо упомянуть и о другой стороне медали. Мягкая вода с жесткостью менее 2 мг-экв/л имеет низкую буферную емкость (щелочность) и может, в зависимости от уровня рН и ряда других факторов, оказывать повышенное коррозионное воздействие на водопроводные трубы. Поэтому, в ряде применений (особенно в теплотехнике) иногда приходится проводить специальную обработку воды с целью достижения оптимального соотношения между жесткостью воды и ее коррозионной активностью.
Вот мы и узнали подробнее про жёсткость воды. Осталось определиться со способами борьбы 🙂

По материалам http://dino-trade.ru/index.php/2010-01-21-11-16-24/205-2010-10-31-16-41-39
Что такое жесткость воды: уровень и методы определения
Жесткость – параметр качества воды
Жесткость питьевой воды – одна из качественных характеристик воды, которое обуславливается наличием в воде солей двух щелочноземельных металлов — кальция и магния. Жесткость имеет значение для оценки качества любой используемой воды, технической, питьевой и воды, используемой для нужд промышленных предприятий с заданными характеристиками.
Наибольшее влияние на уровень жесткости воды оказывает количество катионов кальция, несколько в меньшей степени – магния. Катионы стронция, железа и марганца также оказывают влияние на жесткость воды, однако их вклад в общую жесткость воды так мало, что на практике обычно пренебрегают их значениями.
Общая жесткость определяется суммой временной и постоянной жесткостью воды.
Постоянная жесткость воды – кальциевые и магниевые соли соляной, серной, азотной кислот, т.е. сильных кислот. Такие соли жесткости в воде при кипячении не выпадают в осадок и не кристаллизуются в виде накипи.
Временная жесткость воды – показатель, наличия в воде карбонатов и гидрокарбонатов кальция и магния, которые при кипячении и показателях рН больше 8,3, практически полностью выпадают в хлопьевидный осадок, кристаллизуются в виде накипи или образуют пленку на поверхности воды.
Как соли кальция и магния попадают в природную воду, ведь вода, выпадающая в виде осадков, как и талая вода, не содержат солей?
Это происходит следующим образом: вода, напитывается солями, содержащимися в известняках, гипсах и доломитах залегающих в толщах земли.
Это основной источник этих солей. Кроме этого, выветривание горных пород, также может оказывать влияние на карбонатную жесткости воды.
Согласно методам определения жесткости воды по гидрохимии считается:
- 0-4 мг-экв./л – мягкая вода
- 4-8 мг-экв./л – средней жесткости
- 8-12 мг-экв./л – жесткая вода
- Больше 12 мг-экв./л – очень жесткая
Это касается оценки общей минерализации воды, но для питьевой воды российский СанПиН определяет предельно допустимые концентрации 0-7 мг-экв/л.
Специалисты в области фильтрации условно делят жесткость питьевой воды так:
- 0-1,5 мг-экв/л – мягкая вода
- 1,5-2 мг-экв/л – оптимальная питьевая вода
- 2-5 мг-экв/л – жесткая вода
- 5-7 мг-экв/л – сверхжесткая вода
- Больше 7 мг-экв./л – не питьевая вода, за пределами рекомендованных значений.
Можно разделить природную воду на поверхностную и подземную.
Поверхностная вода обычно имеет меньшую жесткость, поскольку она разбавляется в значительной степени осадками и талыми водами. Этим объясняется и факт сезонных изменений показателей общей жесткости для поверхностных вод.
Состав подземных вод более постоянен, и обычно имеет большие значения, чем у поверхностной воды, по общей жесткости.
Питьевая вода должна иметь оптимальный состав по количеству солей жесткости.
Слишком много солей – риск возникновения мочекаменной болезни, заболеваний костей, суставов. Слишком мало солей – соли вымываются из организма, кости приобретают большую ломкость, возрастает риск заболеваний суставов, сосудов.
По мнению некоторых исследователей, в регионах с пониженным уровнем жесткости воды, также возрастает риск сердечнососудистых заболеваний. Это подтверждается статистикой по странам Европы и Северной Америке, исследованиям в российских регионах с разными средними показателями по жесткости воды.
Также жесткая вода образует накипь, что приводит к уменьшению сроков службы бытовой технике, преждевременному износу водонагревательного оборудования, портит сантехническое оборудование.
Вода, уровень жесткости которой меньше двух мг-экв/л способна сильнее, чем более жесткая вода оказывать на водопроводные трубы коррозийное воздействие, поскольку имеет более низкую щелочность.
Поэтому, в ряде случаев, особенно в теплоэнергетике, иногда приходится проводить дозирование карбонатной жесткости воды с целью достижения оптимального соотношения между коррозионной активностью воды, ее водородному показателю и содержанию кальция и магния.
В настоящее время ряд специалистов, ссылающиеся на данные ВОЗ, утверждают, что имеющаяся статистика не позволяет однозначно считать мягкую и жесткую воду опасной для здоровья человека. И все же имеющиеся данные подтверждают зависимость водно-солевого баланса в организме человека от этих факторов, а отсутствие нормативной доказательной базы на уровне Всемирной Организации Здравоохранения, не причина закрывать глаза на качество питьевой воды по количественным показателям солей жесткости — солей кальция и магния.
Закажите консультацию специалиста компании Гейзер
Остались вопросы? Мы всегда готовы предоставить консультацию по всем вопросам очистки воды!