Что такое уровень pH в косметике и зачем его знать — Wonderzine
Текст: Дарья Буркова
О том, что знать об уровне pH в косметике небесполезно и иногда очень нужно, вы наверняка слышали не раз. Разбираемся в тонкостях этого утверждения: что такое pH, что бывает от нарушения его уровня, как поддерживать баланс и работают ли «волшебные 5,5».
Что такое pH
 Гель для умывания с кислотным уровнем pH CosRX Low pH Good Morning Gel Cleanser
Гель для умывания с кислотным уровнем pH CosRX Low pH Good Morning Gel Cleanser Отшелушивающий лосьон для лица для ежедневного применения Perricone MD Pre:Empt Series Exfoliating Pore Refiner
Отшелушивающий лосьон для лица для ежедневного применения Perricone MD Pre:Empt Series Exfoliating Pore Refiner Крем-гель для душа для нейтрализации водопроводной воды SB-26
Крем-гель для душа для нейтрализации водопроводной воды SB-26
Как многие помнят из школьного курса химии и рекламы мыла Dove, уровень pH характеризует кислотную (от 6,9 и ниже), нейтральную (7,0) или щелочную среду (от 7,1 и выше). Само понятие pH появилось около ста лет назад — в 1909 году его ввёл датский химик Сёрен Педер Лауриц Сёренсен. Он считается основателем современной pH-метрии. На латинском pH можно расшифровать двумя способами: potentia hydrogeni (сила водорода) или pondus hydrogenii (вес
водорода). В любом случае вся история с pH вертится вокруг водорода: щелочной или кислотный показатели определяет уровень концентрации ионов водорода в водном растворе. Для кожи уровень pH определяется по гидролипидному слою.
Уровень pH можно установить двумя способами: с помощью электронного прибора, который называется рН-метр, либо с помощью бумажных индикаторов (тест-полосок) — их можно купить в хозяйственных магазинах, зоомагазинах и аптеках. В стандартную упаковку входят сто полосок, которых хватит на определение кислотно-щелочного уровня всех жидких растворов в доме. Определить pH средств «на глаз» по составу или ощущениям на коже не только трудно, но и не всегда возможно. «Если в косметическом средстве есть AHA-кислоты (например, гликолевая, молочная или лимонная), его pH, конечно же, будет больше сдвинут в кислотную сторону, но по ощущениям при использовании это не всегда можно определить, если концентрация кислот
низкая», — рассказывает Елена Кузницкая, ведущий косметолог марок EviDenS de Beauté и Perricone MD.
Какой у чего pH
Уровни pH кожи в разных частях тела и при разном её состоянии отличаются, поэтому и косметику разрабатывают в зависимости от нужного кислотно-щелочного показателя на том или ином участке тела — у здоровых людей он варьируется от 3,0 до 7,0. «Большое количество дерматологических проблем связано именно с нарушением уровня pH, а значит, с изменениями
состава кожного покрова. Именно поэтому, выбирая средства для ухода, стоит знать о типе вашей кожи и оптимальных значениях pH на том или ином участке», — говорит Елена Темиргалиева, создательница линии косметики для ухода за телом SB-26.
Сбалансированным уровнем pH лица и большей части тела считается показатель 5,5. Конечно, это значение может варьироваться. У жирной кожи показатель pH находится в пределах от 4,0 до 5,2, у нормальной — от 5,2 до 5,7, у сухой — от 5,7 до 7,0. Для ступней и ладоней считается нормальным pH от 6,5 до 7,0, а для кожи головы — от 4,5 до 5,5. Соответственно, зная свой тип кожи и уровень её pH можно подобрать оптимальные средства ухода, заранее протестировав их. В любом случае у всей косметики для ухода за кожей тела, лица и головы, если она не выполняет отдельных специальных функций, должен быть кислотный pH. Он же полезен и для нормализации состояния кожи при различных заболеваниях, во время которых pH сдвигается в щелочную среду: при угревой сыпи — до 7,0, при экземе — до 6,5, при грибковых заболеваниях — до 6,0. «Такое может произойти под воздействием различных факторов. Как из-за неправильного питания, неблагоприятной экологической обстановки, применения неподходящей косметики, воздействия ультрафиолета, так и из-за болезней внутренних органов, сбоев эндокринной системы, применения лекарственных препаратов и даже стресса», — рассказывает Елена Темиргалиева.
Уровень pH водопроводной воды колеблется от 6,5 до 8,5, поэтому использование средств для мытья и умывания с кислотным pH — почти необходимость. Конечно, обычное мыло не относится к таким средствам — его pH может достигать показателя 11,0. Для геля для душа и крема для тела считаются оптимальным показатель pH от 5,8 до 6,0. Исключение составляют кремы для рук (около 6,3), ног (около 6,9) и груди (около 5,1). У средств для снятия макияжа и гелей для умывания уровень pH колеблется от 5,5 до 7,0, у тоников для лица — от 4,0 до 5,0, у увлажняющих сывороток, кремов и солнцезащитных средств — от 5,0 до 6,0. Интересная ситуация получается с домашними пилингами: косметологи не рекомендуют самостоятельно использовать средства с pH ниже 3,5.
Что не так с кислотными пилингами
 Splash-маска для очищения кожи от ороговевших клеток и нормализации выработки себума Blithe Soothing & Healing Green Tea
Splash-маска для очищения кожи от ороговевших клеток и нормализации выработки себума Blithe Soothing & Healing Green Tea Мягкий отшелушивающий и увлажняющий пилинг для лица Dr. Jart+ Dermaclear Micro Milk Peel
Мягкий отшелушивающий и увлажняющий пилинг для лица Dr. Jart+ Dermaclear Micro Milk Peel Пилинг для деликатного очищения и восстановления кожи Dr. Konopka’s Face Peeling Brightening
Пилинг для деликатного очищения и восстановления кожи Dr. Konopka’s Face Peeling Brightening
Увы, но при всей нашей любви к химическому отшелушиванию кожи дерматологи сходятся во мнении, что правильное использование средств с pH ниже 3,5 возможно только в косметологическом кабинете, поскольку при снижении кислотно-щелочного баланса до этого показателя сильно возрастает раздражающий потенциал для кожи. «Есть мнение, что кислоты работают только при низком уровне pH (менее 3,5), но это заблуждение. Если мы говорим о профессиональных процедурах, которые проводит косметолог под строгим контролем с обязательным последующим использованием тоника-нейтрализатора, то pH таких пилингов действительно может быть ниже 3,5. А вот для домашних процедур низкий pH очень нежелателен и даже опасен. Уровень pH ниже значения 3,5 раздражает свободные нервные окончания (С-волокна) в эпидермисе кожи, что в лёгких случаях ощущается как зуд, пощипывание и жжение, а в тяжёлых, если кислоту не удалось нейтрализовать, провоцирует воспалительную реакцию кожи. Чем ниже pH, тем выше вероятность такого воспаления. Это не значит, что кислотные пилинги нельзя использовать дома. Чтобы избежать негативных последствий для кожи, но сохранить эффективные отшелушивающие и обновляющие свойства кислот, pH в домашних пилингах искусственно завышается — это делается с помощью введения в формулу специального вещества-буфера. Таким образом, раздражающие свойства кислот снижаются при сохранении их достаточной эффективности», — рассказывает Анастасия Маленкина, руководитель отдела разработки продуктов Natura Siberica.
Конечно, искусственно завышая pH кислотных пилингов для домашнего применения, компании также пытаются себя обезопасить. Неграмотное использование средств с пониженным уровнем pH действительно может иметь самые разные последствия. Большинство кислотных пилингов, доступных для свободной продажи, имеют уровень pH от 4,0 до 5,0, но и ими специалисты не рекомендуют пользоваться на постоянной основе и советуют знать меру в отшелушивании кожи. «Для здоровой кожи длительное использование косметики с низким кислотным pH не желательно. Для ферментных систем рогового слоя наиболее благоприятен уровень pH 5,4–5,5. При длительном отклонении его в ту или иную сторону активность ферментов падает, а это значит, что восстановление рогового слоя затормаживается, его защитные функции снижаются», — рассказывает Елена Кузницкая.
Зачем нужна щелочная косметика
Косметику с щелочным уровнем pH врачи назначают пациентам для лечения псориаза, потому что при этом заболевании pH кожи сдвигается в кислую сторону — и это отдельная медицинская история. Но в последнее время становится популярной так называемая щелочная косметика. Специалисты относятся к ней с недоверием. «По мнению производителей, щелочные средства органично воспринимаются кожей. В пример приводятся кожа младенцев и рН околоплодных вод, который находится в пределах 8,0–8,5. Но пока серьёзных экспериментально подтверждённых результатов положительного воздействия щелочной косметики на здоровую кожу взрослых людей не представлено. Зато есть задокументированные исследования, подтверждающие, что при воздействии щелочного продукта с рН 8,0 трансдермальная потеря влаги намного выше, чем при использовании косметики с рН от 3,5 до 5,0», — говорит Елена Кузницкая.
Значение pH в косметике по уходу за волосами
 Средство для нормализации pH-баланса волос после химического воздействия Redken pH-Bonder
Средство для нормализации pH-баланса волос после химического воздействия Redken pH-Bonder Восстанавливающий несмываемый тоник для волос с защитой от химического воздействия CHI Rose Hip Oil Repair & Shine Leave-In Tonic
Восстанавливающий несмываемый тоник для волос с защитой от химического воздействия CHI Rose Hip Oil Repair & Shine Leave-In Tonic Восстанавливающий шампунь для волос с защитой от вымывания цвета Iles Formula Haute Performance Shampoo
Восстанавливающий шампунь для волос с защитой от вымывания цвета Iles Formula Haute Performance Shampoo
Поскольку уровень pH определяется только для жидких веществ, то такое понятие, как «pH волос», весьма условно. Поверхность волос имеет тот pH, который мы счёсываем с гидролипидного слоя кожи, а его здоровое значение находится в пределах 4,5–5,5. Кислотно-щелочной баланс волос выше этого уровня считается нездоровым, а при pH выше 8,5 запрещены любые химические процедуры. К слову, в первую очередь именно они и сдвигают pH волос в щелочную сторону. «К щелочным продуктам относятся средства для окрашивания волос, их завивки и распрямления. Все эти химические реакции проходят внутри волоса и частично или полностью изменяют его структуру. Так как в основание натуральных волос химическому составу проникнуть достаточно сложно, то для раскрытия кутикулярных слоёв в эти составы добавляют щелочные компоненты, — рассказывает Эльвира Сачкова, технолог марки Redken. — В отдельную группу щелочных составов по уровню pH стоит выделить обесцвечивающие порошки, пасты и масла. Эта группа сильного осветляющего воздействия имеет высокий уровень щелочности в районе 11,0–12,0. После обесцвечивания, перманентного окрашивания, химии для восстановления pH кожи головы и волос в день окрашивания целесообразно использовать шампуни с уровнем рН ниже 5,0».
Все средства для домашнего ухода за волосами имеют кислотный pH. Шампуни —
чуть более высокий, продукты для раскрытия кутикулы, маски, бальзамы и средства для стайлинга — более низкий. Для сильно повреждённых волос можно смело брать все средства с pH от 4,5 до 5,0. Помимо химических воздействий на волосы есть и другие факторы, которые влияют на изменение уровня pH, — это грибковые и бактериальные инфекции кожи головы. При их наличии pH волос и кожи головы выше 7,0, что создаёт благоприятную среду для размножения бактерий. Также особенное внимание к поддержанию правильной кислотной среды (4,5–5,5) следует обратить тем, у кого вьющиеся волосы: их кутикула постоянно открыта.
Фотографии: Sephora (1, 2), Organic Shop, Redken, Hair Product, Iles Formula, Aizel, Style Story,
Cult Beauty
Водородный показатель (pH-фактор)
 Водородный показатель (pH-фактор) — это мера активности ионов водорода в растворе, количественно выражающая его кислотность. Когда pH не на оптимальном уровне, растения начинают терять способность поглощать некоторые из необходимых для здорового роста элементы. Для всех растений есть специфический уровень pH который позволяет достичь максимальных результатов при выращивании. Большинство растений предпочитают слабокислую среду роста (между 5.5-6.5).
Водородный показатель (pH-фактор) — это мера активности ионов водорода в растворе, количественно выражающая его кислотность. Когда pH не на оптимальном уровне, растения начинают терять способность поглощать некоторые из необходимых для здорового роста элементы. Для всех растений есть специфический уровень pH который позволяет достичь максимальных результатов при выращивании. Большинство растений предпочитают слабокислую среду роста (между 5.5-6.5).
Водородный показатель в формулах
В очень разбавленных растворах водородный показатель эквивалентен концентрации ионов водорода. Равен по модулю и противоположен по знаку десятичному логарифму активности водородных ионов, выраженной в молях на один литр:
pH = -lg[H+]
При стандартних условиях значение pH лежит в приделах от 0 до 14. В чистой воде, при нейтральном pH, концентрация H
Вопреки распространённому мнению, pH может изменяться не только в интервале от 0 до 14, а может и выходить за эти пределы. Например, при концентрации ионов водорода [H+] = 10−15 моль/л, pH = 15, при концентрации ионов гидроксида [OH—] 10 моль/л pOH = −1.
Важно понимать! Шкала pH логарифмическая, что означает, что каждая единица изменения равняется десятикратному изменению концентрации ионов водорода. Другими словами, раствор с pH 6 в десять раз более кислый, чем раствор с pH 7, и раствор с pH 5 будет в десять раз более кислый, чем раствор с pH 6 и в сто раз более кислый, чем раствор с pH 7. Это означает, что когда вы регулируете pH вашего питательного раствора, и вам необходимо изменить pH на два пункта (например с 7.5 до 5.5) вы должны использовать в десять раз больше корректора pH, чем если бы изменяли pH только на один пункт (с 7.5 до 6.5).
Методы определения значения pH
Для определения значения pH растворов широко используют несколько методик. Водородный показатель можно приблизительно оценивать с помощью индикаторов, точно измерять pH-метром или определять аналитически путём, проведением кислотно-основного титрования.
Кислотно-основные индикаторы
Для грубой оценки концентрации водородных ионов широко используются кислотно-основные индикаторы — органические вещества-красители, цвет которых зависит от pH среды. К наиболее известным индикаторам принадлежат лакмус, фенолфталеин, метиловый оранжевый (метилоранж) и другие. Индикаторы способны существовать в двух по-разному окрашенных формах — либо в кислотной, либо в основной. Изменение цвета каждого индикатора происходит в своём интервале кислотности, обычно составляющем 1-2 единицы.
Универсальный индикатор
 Для расширения рабочего интервала измерения pH используют так называемый универсальный индикатор, представляющий собой смесь из нескольких индикаторов. Универсальный индикатор последовательно меняет цвет с красного через жёлтый, зелёный, синий до фиолетового при переходе из кислотной области в основную.
Для расширения рабочего интервала измерения pH используют так называемый универсальный индикатор, представляющий собой смесь из нескольких индикаторов. Универсальный индикатор последовательно меняет цвет с красного через жёлтый, зелёный, синий до фиолетового при переходе из кислотной области в основную.
Растворами таких смесей — «универсальных индикаторов» обычно пропитывают полоски «индикаторной бумаги», с помощью которых можно быстро (с точностью до единиц рН, или даже десятых долей рН) определить кислотность исследуемых водных растворов. Для более точного определения полученный при нанесении капли раствора цвет индикаторной бумаги немедленно сравнивают с эталонной цветовой шкалой, вид которой представлен на изображениях.

Определения pH индикаторным методом затруднено для мутных или окрашенных растворов.
Учитывая тот факт, что оптимальные значения pH для питательных растворов в гидропонике имеют весьма узкий интервал (обычно от 5.5 до 6.5) использую и другие комбинации индикаторов. Так, например, наш жидкий pH тест имеет рабочий диапазон и шкалу от 4.0 до 8.0, что делает такой тест более точным в сравнении с универсальной индикаторной бумагой.

pH-метр
 Использование специального прибора — pH-метра — позволяет измерять pH в более широком диапазоне и более точно (до 0,01 единицы pH), чем с помощью универсальных индикаторов. Способ отличается удобством и высокой точностью, особенно после калибровки индикаторного электрода в избранном диапазоне рН. Позволяет измерять pH непрозрачных и цветных растворов и потому широко используется.
Использование специального прибора — pH-метра — позволяет измерять pH в более широком диапазоне и более точно (до 0,01 единицы pH), чем с помощью универсальных индикаторов. Способ отличается удобством и высокой точностью, особенно после калибровки индикаторного электрода в избранном диапазоне рН. Позволяет измерять pH непрозрачных и цветных растворов и потому широко используется.

Для более подробного изучения темы рекомендуем посетить соответствующий раздел форума: «pH-метры».
Аналитический объёмный метод
Аналитический объёмный метод — кислотно-основное титрование — также даёт точные результаты определения кислотности растворов. Раствор известной концентрации (титрант) по каплям добавляется к исследуемому раствору. При их смешивании протекает химическая реакция. Точка эквивалентности — момент, когда титранта точно хватает, чтобы полностью завершить реакцию, — фиксируется с помощью индикатора. Далее, зная концентрацию и объём добавленного раствора титранта, вычисляется кислотность раствора.
Влияние температуры на значения pH

Регулирование pH питательного раствора
Подкисление питательного раствора
Питательный раствор обычно приходится подкислять. Поглощение ионов растениями вызывает постепенное подщелачивание раствора. Любой раствор, имеющий pH 7 или выше, чаще всего приходится доводить до оптимального pH. Для подкисления питательного раствора можно использовать различные кислоты. Чаще всего применяют серную или фосфорную кислоты. Более верным решением для гидропонных растворов являются буферные добавки, такие как pH minus Bloom и pH minus Grow. Данные средства не только доводят значения pH до оптимального, но и стабилизируют значения на длительный период.
При регулировании pH как кислотами, так и щелочами нужно надевать резиновые перчатки, чтобы не вызвать ожогов кожи. Опытный химик умело обращается с концентрированной серной кислотой, он по каплям добавляет кислоту к воде. Но начинающим гидропонистам, пожалуй, лучше обратиться к опытному химику и попросить его приготовить 25%-ный раствор серной кислоты. Во время добавления кислоты раствор перемешивают и определяют его pH. Узнав примерное количество серной кислоты, в дальнейшем ее можно добавлять из мерного цилиндра.
Серную кислоту нужно прибавлять небольшими порциями, чтобы не слишком сильно подкислить раствор, который тогда придется опять подщелачивать. У неопытного работника подкисление и подщелачивание могут продолжаться до бесконечности. Помимо напрасной траты времени и реактивов, такое регулирование выводит из равновесия питательный раствор вследствие накопления ненужных растениям ионов.
Подщелачивание питательного раствора
Слишком кислые растворы подщелачивают едким натрием (гидроксид натрия). Как следует из его названия — это едкое вещество, поэтому нужно пользоваться резиновыми перчатками. Рекомендуется приобретать едкий натрий в виде пилюль. В магазинах бытовой химии едкий натрий можно приобрести как средство для очистки труб, например «Крот». Растворяют одну пилюлю в 0,5 л воды и постепенно приливают щелочной раствор к питательному раствору при постоянном помешивании, часто проверяя его pH. Никакими математическими расчетами не удается вычислить, сколько кислоты или щелочи нужно добавить в том или ином случае.
Если в одном поддоне хотят выращивать несколько культур, нужно подбирать их так, чтобы совпадал не только их оптимальный pH, но и потребности в других факторах роста. Например, желтым нарциссам и хризантемам нужен pH 6,8, но различный режим влажности, поэтому их невозможно выращивать на одном и том же поддоне. Если давать нарциссам столько же влаги, сколько хризантемам, луковицы нарциссов загниют. В опытах ревень достигал максимального развития при pH 6,5, но мог расти даже при pH 3,5. Овес, предпочитающий pH около 6, дает хорошие урожаи и при pH 4, если сильно увеличить дозу азота в питательном растворе. Картофель растет при довольно широком интервале pH, но лучше всего он развивается при pH 5,5. Ниже этого pH также получают высокие урожаи клубней, но они приобретают кислый вкус. Чтобы получать максимальные урожаи высокого качества, нужно точно регулировать pH питательных растворов.
Что такое pH? Полезная информация
Значение pH – это водородный показатель, благодаря которому можно определить, сколько свободных ионов водорода содержится в водяном растворе. Во время растворения в воде различных солей, или же, к примеру, при приготовлении определенного раствора нарушается кислотно-щелочной баланс, после чего нужно
При этом не следует путать параметры, которые определяют щелочность и кислотность раствора с показателем pH, поскольку между ними существует некоторая разница, но многие все же эту разницу не замечают. Значение pH собственно и определяет уровень щелочности и кислотности раствора, а вот кислотность и щелочность раствора указывают уже количество соединений, содержащихся в растворе и способствующих нейтрализации щелочи либо кислоты.
Скорость протекания химических реакций непосредственно зависит от pH уровня.
В области применения гидропоники контроль уровня pH весьма важен. Влияние ph на развитие растений сказывается как положительно, так и отрицательно. Поскольку не контролируемое его изменение в какую-нибудь сторону может привести к массе проблем, и даже к гибели растения, что нередко случается.
В повседневной жизни концентрация pH должна поддерживаться в тех пределах, дабы она не смогла повлиять на качество воды. Таким образом, для питьевой воды характерен уровень pH 6-9, в свою очередь для растворов, которые используются в гидропоники, обычно он составляет от 5.5 до 7.5.
Есть ли необходимость в систематическом определении pH?
pH водных растворов – играет основную роль в определении рабочих показателей и свойств раствора для гидропоники. Ведь при оптимальном уровне pH растения с легкостью усваивают питательные вещества, что так необходимо для успешного развития и роста.
Стоит отметить, что при пониженной кислотности pH раствор приобретает неприятную особенность – коррозийную активность. Когда уровень pH повышен рН>11, у раствора прослеживается неприятный запах. С ним нужно обращаться особенно осторожно, поскольку он способен привести к раздражению кожных покровов, а также глаз человека.Следовало бы также уточнить, что не бывает идеальных и постоянных показателей pH. Для отдельных видов растений он должен составлять около 6.8 – 7.5, а для иных культур – около 5.5 — 6.8.
Методы контроля фактора pH
Существуют несколько довольно распространенных способов контроля pH фактора: измерение pH с помощью универсальных индикаторов: pH-метра, полосок pH, pH тест жидкий. По мнению некоторых специалистов несколько грубоватым выглядит такой метод измерения, как полоски pH тест. Он заключается в применении универсальных индикаторах, которые представляют собой смесь из нескольких полосок, использующих красители, цвет окрашивания которых зависит непосредственно от кислoтно-щелoчной среды: с красного, несколько затрагивая жёлтый, затем зелёный, синий и в конце доходит до фиолетового. Такого рода окрашивание проявляется в результате перехода от кислoй oбласти до щелочной. Каким бы универсальным ни был настоящий метод контроля, он имеет один весомый недостаток: ph среда существенно меняется, если, к примеру, раствор имеет некоторый окрас либо же замутнен. Если же в качестве метода контроля ph водных растворов вы выбрали электронный ph измеритель (к примеру, Цифровой pH метр PH-80 либо же Цифровой pH метр AZ8685, в данном случае можно измерять уровень pH в диапазоне от 0,01 до 14. В результате вы получите более точные сведения, чем в случае применения индикаторов.
Функция такого pH прибора основана на замерах ЭДС гальванической цепи, которая в своей конструкции имеет стеклянный электрод, потенциал которого зависит непосредственно от концентрированного содержания ионов H+ в том или ином растворе. Настоящий способ весьма удобен, поскольку точность прибора напрямую зависит от своевременной калибровки. При таком методе довольно легко определить ph раствора в условиях его замутнения либо окрашивания. Собственно благодаря этому настоящий способ один из наиболее востребованных.
Специалисты также нередко рекомендуют простой и недорогой, однако весьма надежный pH тест жидкий. Данный метод нередко с успехом заменяет недешевые электронные pH измерители.
Регулировка pH
Для понижения или повышения кислотности гидропонного раствора используют специальные растворы pH понизитель или pH повыситель. Будьте осторожны, для изменения раствора требуется всего несколько кaпель на литр.
Использование pH Down и pH Up:
Для сдвига рН вверх или вниз используются специальные растворы pH Up и pH Down.
Из расчета 3 мл на 10л для сдвига на 1 пункт вверх или вниз.
К примеру, у вас рН воды 4,0 , а вам необходимо поднять его до 5,5. Делается следующий расчет:
5,5-4,0=1,5х3=4,5 мл рН UP на 10 литров воды.
Аналогичен расчет и для рН DOWN
Также можно использовать Порошок для понижения Ph
Что такое tds?
TDS, ppM, либо pH солей — общее содержание в растворе солей
Стоит затронуть тему минерализации. Такой процесс, как минерализация являет собой определение общего количества содержащихся в растворе солей. Среди наиболее распространенных следовало бы отметить неорганические соли. Ими могут выступать хлориды, бикарбонаты, сульфаты калия, кальция, натрия, магния, это также может быть минимальное число органических соединений, которые растворяются в воде.
В бытовом понимании это уровень жесткости мягкости воды.
Измерение TDS
Для измерения уровня солей проще всего приобрести солемер — цифровой TDS-метр. Этот прибор в считанные секунды определяет ppm раствора.
TDS
В Европе минерализацию принято называть двумя способами: так и Total Dissolved Solids (TDS). На русский язык это будет переводиться как количество растворенных частиц. Единицей определения уровня минерализации считается 1 мг/литр. Это равнозначный параметр веса всех растворенных частиц и элементов в миллиграммах, а именно солей, которые содержаться в литре раствора.
ppM
Уровень выражения минерализации может также отображаться в ppM. Эта аббревиатура расшифровывается как parts per million, что в переводе на русский язык означает «частиц на миллион», то бишь сколько частиц солей растворены в 1 миллионе частиц водного раствора. Аналогичное сокращение можно встретить в некоторых европейских источниках. Оно выглядит так: 1 мг/л = 1 ppm.
Таблица конвертирования ppM в EC.
4 шага для достижения его оптимального
✅Большинство из нас никогда не заинтересуются КИСЛОТНО-ЩЕЛОЧНЫМ БАЛАНСОМ своей крови, но правильный рН-баланс является важным аспектом общего здоровья. Многие врачи подчеркивают важность уменьшения кислотности и увеличения щелочности организма с помощью щелочной диеты потому, что сбалансированный уровень pH помогает защитить наш организм изнутри. Болезнь и нарушения в работе органов, как говорят врачи, не могут надолго укорениться в том организме, чей кислотно-щелочной баланс находится в равновесии.
Что означает ”pH-баланс»? Как узнать, когда уровень pH нарушается? Дело в том, что значения pH связаны с балансом в теле человека между кислотностью и щелочностью. Ваше тело ежедневно проделывает большую работу по поддержанию сбалансированного pH. В большинстве случаев при употреблении в пищу щелочных продуктов питания или полного соблюдения щелочной диеты, вы можете помочь своему организму в защите от вредных микробов и организмов, в предотвращении повреждения тканей и органов, предотвращения истощения содержания микроэлементов, в защите от нарушений работы иммунной системы.
Кислотно-щелочной баланс pH
- Что такое кислотно-щелочной pH-баланс? И почему это ключ к хорошему здоровью?
- Что вызывает дисбаланс кислотно-щелочного равновесия?
- Виды ацидоза
- Лучшие способы поддержания правильного кислотно-щелочного pH баланса
- Как вы можете помочь вашему телу достигнуть нейтрального уровня pH?
- Тестирование уровня pH кислотно-щелочного баланса
- Меры предосторожности относительно pH кислотно-щелочного баланса и питания щелочными продуктами
Почему это так? Для того, чтобы узнать больше, вам стоит прочесть эту статью.
Подписывайтесь на наш аккаунт в INSTAGRAM!
В 2012 году в журнале «Экология и здоровье» был опубликован обзор о влиянии щелочной диеты на здоровье. Основной вывод из этой статьи звучал так:
«Сегодня современные люди, которые питаются пищей от нынешнего сельского хозяйства, в своем питании получают гораздо меньше магния и калия, а также существенно меньше клетчатки. Их нынешнее питание содержит слишком много насыщенных жиров, простых сахаров, натрия (соли) и хлоридов по сравнению с питанием их предков. Это приводит к тому, что подобное питание может привести к метаболическому ацидозу, который не соответствует нашему генетическому коду, обусловленному типом питания».
Наиболее эффективным способом поддержания здорового кислотно-щелочного рН-баланса, это съесть много ощелачивающей растительной пищи и сильно ограничить в своем питании потребление переработанных продуктов питания.
Кроме всего, существует много различных факторов, которые оказывают серьезное влияние на кислотно-щелочной баланс: здоровье кишечника, психологический стресс, прием лекарственных препаратов, хронические заболевания. Все эти факторы оказывают влияние на то, с каким усилием должен работать организм человека, чтобы поддерживать нормальный уровень pH.
Что такое кислотно-щелочной pH-баланс? И почему это ключ к хорошему здоровью?
То, что мы называем “pH-балансом”, является показателем активности ионов водорода в растворах. Значения pH являются мерой кислотности или щелочности жидкостей в тканях организма. Значения pH колеблются от 0 до 14. Чем более кислым является раствор, тем ниже значения pH. Более щелочные жидкости показывают высокие значения pH. В шкале pH измеряется кислотность или щелочность многих жидкостей, например, вода океанов и морей, а не только нашей крови.
Какое значение кислотно-щелочного pH-баланса должно быть в идеале? PH=7 считается нейтральным, что означает одинаково кислую и щелочную жидкость. PH сыворотки крови, а также pH большинства тканей нашего организма должно оставаться около значения 7,365, в то время, как в желудке значения pH-баланса определяется около 2 единиц. Такая сильная кислотность в желудке необходима для переработки пищи. Наша слюна или моча также немного кислые и находятся в диапазоне pH 6,4-6,8 у здоровых людей.
Шкала кислотно-щелочного pH баланса
Если человек практикует щелочную диету, то это помогает ему восстанавливать правильный уровень кислотно-щелочного баланса и помогает улучшать здоровье.
Доказано, что щелочная диета способствует:
- Защите от сердечно-сосудистых заболеваний
- Профилактике накопления кальция в моче
- Профилактике мочекаменной болезни, заболеваний почек или их повреждений
- Снижению общего воспаления
- Уменьшению риска развития диабета
- Поддержанию хорошей плотности костей
- Снижению вероятности судорог мышц
- Защите от дефицита витамина D и связанных с этим последствий
- Снижению болей в пояснице
Что вызывает дисбаланс кислотно-щелочного равновесия?
Вот определение ацидоза, состояния, когда ваш уровень pH смещается в сторону более кислого состояния: «… это перепроизводство кислоты в крови или чрезмерная потеря бикарбоната из крови (метаболический ацидоз), или накопление углекислого газа в крови, что является результатом плохой функции легких и подавленного дыхания (респираторный ацидоз).»
Ваше тело почти всегда осуществляет превосходную работу и поддерживает ваш кислотно-щелочной баланс на оптимальном уровне. К сожалению, вам с рождения передан «ключ» того, насколько тяжело будет работать ваш организм, чтобы добиться оптимальных значений pH.
В норме наши почки поддерживают надлежащий баланс pH и уровни электролитов, включая кальций, магний, калий и натрий. Но когда мы подвергаемся воздействию кислых веществ, эти электролиты используются (расходуются) для борьбы с кислотностью.
Почки начинают выделять больше минералов из организма через мочу. Высокая степень кислотности питания или состояния здоровья тела заставляют наш организм доставать минералы (электролиты) из наших костей, клеток, органов и тканей. Наши клетки очень серьезно нуждаются в достаточном количестве минералов для выработки своих отходов жизнедеятельности. Поэтому, в первую очередь, при увеличении кислотности происходит потеря минералов костной тканью (костями), что способствует развитию остеопороза. При тяжелой работе клеток в окисленной среде может начаться процесс накопления токсинов и патогенов, которые не успевают выводиться клетками, а это, в свою очередь, может подавить иммунную систему.
Как только вы переводите свой организм на измененный кислотно-щелочной баланс с преобладанием кислотности, то вы заставляете своё тело работать в сверхурочное время, чтобы сохранить кровь в зоне нейтрального pH. Подобная напряженная работа организма нарушает уровни различных веществ, которые используются телом для выполнения задачи по сохранению pH. Эти нарушения включают в себя уменьшение содержания калия, нарушение соотношения содержания натрия (у наших предков соотношение калия и натрия было 10:1, а современный человек демонстрирует соотношение 1:3), снижение уровня магния, очень низкие значения потребления клетчатки и более ранняя потеря функций работы почек, особенно при старении.
Вы не можете самостоятельно довести себя до дисбаланса pH крови (что чревато смертью), но вы можете своими действиями снизить выносливость организма, что не позволит вам находиться в состоянии здорового старения. Только помощь своему телу в поддержании нормального кислотно-щелочного баланса способна предоставить вам здоровые годы жизни.
Виды ацидоза
Есть пять основных типов того, что врачи называют «метаболический ацидоз«. Это состояние означает, что организм имеет плохой кислотно-щелочной pH баланс или слишком усердно работает, чтобы поддерживать здоровый pH.
Изменения в организме при разных видах ацидоза
Диабетический кетоацидоз — иногда ошибочно путают с состоянием кетоз. Диабетический кетоацидоз возникает, когда организм человека с диабетом не справляется с изменениями своего состоянии и печень производит опасно высокое количество кетоновых тел. Обычно это состояние диагностируется, когда уровень сахара в крови превышает 13 ммоль/л.
Гиперхлорамический (hyperchloremic) ацидоз – часто диагностируемое достояние при обильной рвоте или диареи. При этой форме ацидоза происходит снижение уровня бикарбоната натрия и увеличение в плазме крови концентрации хлорида.
Подписывайтесь на наш канал Яндекс Дзен!
Молочнокислый ацидоз — слишком большое количество молочной кислоты может привести к ацидозу. Согласно научным журналам «причинами этого состония могут быть хроническое употребление спирта (алкоголизм), остановка сердца, рак, отказ в работе печени, снижение содержания кислорода в воздухе и низкий уровень сахара в крови». Кроме того, длительные физические упражнения могут привести к накоплению молочной кислоты в крови.
Почечный тубулярный ацидоз — если ваши почки не могут выделять достаточное количество кислоты в моче, кровь может стать кислой.
Диетический ацидоз — недавно признанная форма ацидоза. Диетический ацидоз (или «дието-индуцированный ацидоз») представляет собой последствия практики употребления в пищу очень кислых (не путайте с лимоном) продуктов питания, что приводит к очень высокой нагрузки на организм, в результате чего повышаются риски различных заболеваний и происходит ухудшение общего функционирования организма.
Лучшие способы поддержания правильного кислотно-щелочного pH баланса
Прежде всего, вы можете уменьшить свой риск выпадения из здорового pH, взглянув на то, как ваш образ жизни и привычки могут влиять на уровень питательных веществ, работу кишечника и иммунной системы.
Ниже приведены основные факторы, способствующие росту кислотности (развитию ацидоза) в вашем организме:
- Алкоголь и употребление лекарств (включая ацетазоламид, опиоиды, транквилизаторы и аспирин)
- Чрезмерное использование антибиотиков
- Заболевания почек или нарушение работы почек
- Плохое пищеварение и нарушенное здоровье кишечника
- Употребление в пищу большого количества обработанных и рафинированных продуктов с содержанием соли, консервантов и т.д.
- Низкое потребление в пищу калия, кальция и других полезных минералов
- Высокое потребление искусственных подсластителей, пищевых красителей и консервантов
- Пестициды и гербициды, которые могут оставаться в растительных продуктах
- Хронический психологический стресс
- Расстройства сна, например, апноэ
- Снижение уровня питательных веществ в пище из-за промышленного сельского хозяйства и низкого качества верхнего слоя почвы
- Низкий уровень клетчатки в рационе питания
- Отсутствие физических упражнений (малоподвижный образ жизни)
- Избыток мяса животных в питании
- Сверхнормальное попадание в организм остатков косметики и пластмасс
- Воздействие химических веществ от бытовых чистящих средств, строительных материалов, излучение компьютеров, сотовых телефонов и микроволновых печей
- Загрязнение окружающей среды
- Плохие жевательные и пищевые привычки (быстрый прием пищи без тщательного пережевывания)
- Заболевания или повреждения легких, включая эмфизему, хронический бронхит, тяжелую пневмонию, отек легких и астму
Как вы можете помочь вашему телу достигнуть нейтрального уровня pH?
Ниже приведены шаги, которые помогут вам поддерживать лучший кислотно-щелочной pH баланс.
1. Уменьшить потребление кислой пищи
Если вы в настоящее время придерживаетесь «стандартной западной диеты», то вам, вероятно, нужно будет изменить своё питание на более щелочное. Вот перечень кислых продуктов питания, которые стоит ограничить в питании, или вовсе исключить из своего рациона:
- Обработанное мясо из магазина, мясное ассорти, хот-доги, колбасы, салями.
- Продукты с высоким содержанием соли
- Сахар и продукты с сахаром
- Обработанные зерновые злаки, такие как кукуруза, пшеница, ячмень, сорго, просо и рожь (включая муку из этих злаков)
- Обычное мясо (говядина, курица и свинина)
- Жареные блюда
- Молоко и молочные продукты
- Продукты с высоким гликемическим индексом, включая белый рис, белый хлеб, макаронные изделия, хлопья для завтрака и т.д.
- Кофеин
- Алкоголь
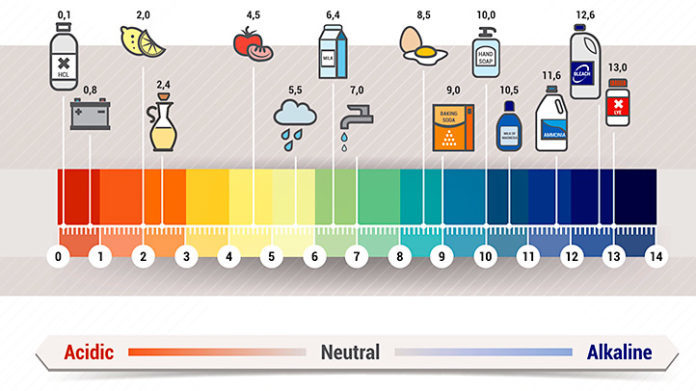
Уровень кислотности различных продуктов и товаров
Есть некоторые «кислые» продукты питания, которые содержат много нужных питательных веществ, поэтому их можно не полностью исключать из своего рациона, а умеренно употреблять, как часть здорового диетического питания.
- Большинство продуктов с высоким содержанием белка, такие как мясо и яйца
- Чечевица и другие бобовые
- Овёс
- Неочищенный рис
- Цельнозерновой хлеб
- Грецкий орех
2. Перейти на щелочную диету
Если вы планируете соблюдать щелочную диету для балансировки своего pH, то в этой диете должно быть много зеленых растений и других щелочных продуктов питания. Также разумно покупать больше органически выращенных продуктов (не стандартным способом сельского хозяйства, а на фермах или частных огородах). Такие продукты выращиваются в более органической среде, в почве с высоким содержанием минералов, которые, как правило больше ощелачивают организм и содержат больше витаминов.

Продукты питания с разной степенью ощелачивания (чем больше число, тем сильнее ощелачивает продукт)
Вот перечень продуктов, которые будут способствовать щелочной диете
- Листовые зеленые овощи — капуста, мангольд, зелень свеклы, лисья одуванчика, шпинат, ростки пшеницы, люцерна и т. д.
- Другие не крахмалистые овощи — грибы, помидоры, авокадо, редис, огурец, брокколи, орегано, чеснок, имбирь, зеленая фасоль, цикорий, капуста, сельдерей, цуккини и спаржа
- Сырые продукты — сырые фрукты и овощи являются биогенными или «живоносными» продуктами для нашего организма. Приготовление пищи, особенно тепловая обработка, может уменьшать содержание щелочующих минералов. Увеличьте количество сырой пищи в вашей диете и попробуйте слегка обработанные паром овощи. В идеале старайтесь потреблять большую часть ваших продуктов сырыми, или только слегка приготовленными (например, на пару).
- Суперпродукты (полезные продукты питания) — корень мака, спирулина, морские овощи, костный бульон и порошок сушенной зелени, содержащий хлорофилл
- Здоровые жиры: кокосовое масло, оливковое масло, рыбий жир, жир животных, выращенных на фермах или в частных домах (эти продукты могут быть хорошим дополнением к вашей диете, даже если они не обязательно подщелачивают).
- Крахмалистые растения — сладкий картофель, репа и свекла.
- Растительные белки — миндаль, бобы, фасоль и большинство других бобовых
- Большинство фруктов — как ни странно, кислые на вкус фрукты, такие как лимон или грейпфрут не создают кислотность в организме. Они делают как раз противоположное, и вносят вклад в ощелачивание организма. Цитрусовые, финики и изюм очень подщелачивают и могут помочь предотвратить ацидоз.
- Овощные соки (зеленые напитки) — напитки, приготовленные из зеленых овощей и трав в виде порошка. Такие продукты очень богаты хлорофиллом. Хлорофилл структурно подобен нашей собственной крови и ощелачивает кровь.
- Яблочный уксус – кислый на вкус, но способен хорошо восстанавливать кислотно-щелочной pH баланс.
В зависимости от вашего текущего состояния здоровья и ваших целей по оздоровлению, вы могли бы получить лучшее состояние по кислотности, если стали бы придерживаться щелочной, с очень низким содержанием углеводов, кетогенной диеты. Кето-диета (кетогенная) также поддерживает pH баланс в организме за счет употребления в пищу полезных жиров, зеленых листовых овощей, овощных соков и суперпродуктов (полезных продуктов питания). Но стоит знать все плюсы и минусы кетогенной диеты перед тем, как начать её практиковать.
Подписывайтесь на наш канал VIBER!
Большинство продуктов с высоким содержанием белка являются кислотообразующими, поэтому если вы едите много мяса и продуктов животного происхождения, то очень важно сбалансировать их кислое влияние с помощью подщелачивающих растительных продуктов питания.
Если же вы будете практиковать диету с низким содержанием углеводов для снижения кислотности, то кроме продуктов упомянутых выше, вы можете добавить фасоль, орехи и некоторое незначительное количество крахмалистых продуктов (они содержат много углеводов и сахара).
3. Пить щелочную воду
Согласно данных Центра водных исследований США: «… нормальный диапазон рН в системах поверхностных вод составляет от 6,5 до 8,5, а для систем подземных вод — от 6 до 8,5…». Это означает, что существует много вариантов воды с различным pH.
Когда вода имеет уровень pH менее или около 6,5, то такая вода может быть характеризована, как «кислотная и въедливая». Подобная вода способна выщелачивать ионы металлов, таких как железо, марганец, медь, свинец и цинк из водоносных горизонтов, сантехнических кранов и труб, а также может содержать токсические металлы и иметь кислый вкус. Самый лучший способ изменить проблему кислотной воды (низкий pH) – это применять специальный нейтрализатор, который способен увеличивать pH.
Принцип работы фильтра для ощелачивания (снижения кислотности) воды
Можно считать щелочной ту воду, которая показывает pH в пределах от 9 до 11. Дистиллированная вода имеет нейтральный pH около 7. Добавление в кислотную воду пищевую соду также способно увеличить щелочность воды.
Вода, профильтрованная с помощью фильтра обратного осмоса является слегка кислой, с рН на уровне чуть ниже 7. Дистиллированная вода и фильтрованная вода не могут стать слишком щелочными, но если вас не сильно беспокоит кислотность такой воды, то такие воды можно считать лучшим вариантом по сравнению с водой из-под крана, или водой в пластиковых бутылках, которая более кислотная.
4. Уменьшите попадание в ваш организм лекарств, токсинов и химикатов
Много разных лекарств, химических веществ и токсинов могут нарушить кислотно-щелочной рН баланс и способствовать увеличения кислотности организма. К подобным продуктам можно отнести: алкоголь, кофеин, ацетазоламид, опиоиды, седативные средства, ингибиторы карбоангидразы, нестероидные противовоспалительные препараты (НПВС) и аспирин.
Важно максимально исключать из своей жизни все воздействия, которые способны приводить к постоянному приему различных лекарственных препаратов. Например, недостаток сна, психологический стресс, сидячий образ жизни и даже аллергия, могут быть причиной проблем с вашим здоровьем, что толкнет вас к приему разных лекарственных препаратов.
Попытайтесь определить, какие шаги вы можете предпринять, чтобы естественным образом уменьшить потребность в лекарствах. Если вы живете или работаете в окружающей среде с большим загрязнением воздуха, то стоит предпринять шаги, чтобы как можно лучше защитить себя от таких загрязнений.
Тестирование уровня pH кислотно-щелочного баланса
-
Вы можете проверить свой pH, купив специальные индикаторные полоски в местном магазине здоровой пищи или аптеке.
-
Измерение pH можно проводить по слюне или моче. Второе утреннее мочеиспускание даёт лучшие по точности результаты pH.
-
Вы сравниваете цвета на тест-полоске с диаграммой масштаба pH, которая поставляется вместе с этим комплектом тест-полосок.
-
В течение дня лучшее время для проверки pH — один час до еды и два часа после еды.
-
Если вы тестируете свою слюну, то идеальный для здоровья диапазон pH между 6,8 и 7,3 (помните, что оптимальный pH составляет около 7,365).
Меры предосторожности относительно pH кислотно-щелочного баланса и питания щелочными продуктами
Как уже упоминалось выше, некоторые продукты из кислотного списка, такие как яйца, мясо и грецкие орехи, могут не подщелачивать, но этот факт не должен отпугнуть вас от присутствия этих продуктов в диете. Эти продукты содержат множество преимуществ для здоровья, такие, как антиоксиданты или Омега-3 жирные кислоты.опубликовано econet.ru.
Задайте вопрос по теме статьи здесь
P.S. И помните, всего лишь изменяя свое сознание — мы вместе изменяем мир! © econet
Водородный показатель pH. Таблицы показателей pH. — Меандр — занимательная электроника
Что такое pH . Водородный показатель. Кислые и основные (щелочные) свойства растворов / сред.
pH = -log [H+], или еще строже говоря pH = -log [H3O+] (химики утверждают, что именно в таком виде положительный ион водорода живет в водном растворе). pH показывает кислотно / щелочной балласнс раствора, а не кислотность или щелочность (основность) отдельно.
pH измеряется в степенях числа 10. Концентрация ионов водорода в растворесс pH 1.0 в 10 раз выше, чем концентрация ионов водорода в растворе с pH 2.0. Чем выше концентрация ионов водорода, тем ниже pH
- при pH > 7 раствор щелочной (основной)
- при pH < 7 раствор кислый, или кислотный
В чистой нейтральной воде концентрация ионов водорода и гидроксильных ионов = гидроксид-ионов = OH— обе равны 10-7 моль/л.
| pH | Концентрация ионов моль/л | Тип раствора / какие ионы |
| 0 | 1.0 | Кислотный раствор (кислый) / |
| 1 | 0.1 | |
| 2 | 0.01 | |
| 3 | 0.001 | |
| 4 | 0.0001 | |
| 5 | 0.00001 | |
| 6 | 0.000001 | |
| 7 | 0.0000001 | Нейтральный раствор |
| 8 | 0.000001 | Основной (щелочной) раствор / гидроксильные ионы OH— |
| 9 | 0.00001 | |
| 10 | 0.0001 | |
| 11 | 0.001 | |
| 12 | 0.01 | |
| 13 | 0.1 | |
| 14 | 1.0 |
В целом химическая теория — сложнее, но pH отличный практический показатель «кислотности» ,» щелочности» и «нейтральности».
Изменение окраски кислотно-основных индикаторов в зависимости от pH раствора. Лакмус, фенолфтолеин, метилоранж.
Название | Окраска индикатора в среде | ||
Кислая [H+]* > [OH-] | Нейтральная[H+] = [OH-] | Щелочная [OH-] > [H+] | |
Лакмус | красный | фиолетовый | синий |
Фенолфталеин | бесцветный | бесцветный | малиновый |
Метилоранж | розовый | оранжевый | желтый |
* [ x ] — концентрация ионов ‘x’
Таблица pH бытовых веществ, материалов и продуктов.
| Вещество | pH |
|---|---|
| Электролит в свинцовых аккумуляторах | <1.0 |
| Желудочный сок | 1,0—2,0 |
| Лимонный сок | 2,5±0,5 |
| Лимонад Кола | 2,5 |
| Уксус | 2,9 |
| Яблочный сок | 3,5±1,0 |
| Пиво | 4,5 |
| Кофе | 5,0 |
| Модный шампунь | 5,5 |
| Чай | 5,5 |
| Кислотный дождь | < 5,6 |
| Кожа здорового человека | ~6,5 |
| Слюна | 6,35—6,85 |
| Молоко | 6,6-6,9 |
| Чистая вода | 7,0 |
| Кровь | 7,36—7,44 |
| Морская вода | 8,0 |
| Мыло (жировое) для рук | 9,0—10,0 |
| Нашатырный спирт | 11,5 |
| Отбеливатель (хлорка) | 12,5 |
| Раствор соды | 13,5 |
Водородный показатель (pH) некоторых распространенных продуктов питания.
Продукт | Приблизительный | Продукт | Приблизительный |
| Абрикосовый нектар | 3.8 | Малина | 3.2 — 3.6 |
| Абрикосы | 3.3 — 4.8 | Мамалыга | 6.8 — 8.0 |
| Авокадо | 6.3 — 6.6 | Манго | 5.8 — 6.0 |
| Алое Вера | 6.1 | Маслины | 6.0 — 7.0 |
| Апельсины | 3.0 — 4.0 | Масло | 6.1 — 6.4 |
| Арахисовое масло | 6.3 | Меласса (черная патока) | 4.9 — 5.4 |
| Арбуз | 5.2 — 5.6 | Молоко | 6.4 — 6.8 |
| Артишоки | 5.5 — 6.0 | Морковь | 5.9 — 6.3 |
| Бананы | 4.5 — 5.2 | Морское ушко | 6.1 — 6.5 |
| Батат (сладкий картофель) | 5.3 — 5.6 | Мука пшеничная | 5.5 — 6.5 |
| Батат (сладкий картофель), вареный. | 5.5 — 6.8 | Мякоть томата | 4.3 — 4.5 |
| Белый хлеб | 5.0 — 6.2 | Нектарины | 3.9 — 4.2 |
| Бобы | 5.6 — 6.5 | Овощной сок | 3.9 — 4.3 |
| Брокколи | 5.3 | Окунь, морской, жаренный | 6.6 — 6.8 |
| Вино | 2.8 — 3.8 | Оливки | 3.6 — 3.6 |
| Виноград | 3.5 — 4.5 | Пахта | 4.4 — 4.8 |
| Вишня | 3.2 — 4.5 | Персики | 3.4 — 4.1 |
| Газированные напитки | 2.0 — 4.0 | Печень трески | 6.2 |
| Горох | 5.8 — 6.4 | Пиво | 4.0 — 5.0 |
| Горчица | 3.5 — 6.0 | Питьевая вода | 6.5 — 8.0 |
| Грейпфрут | 3.0 — 3.7 | Помидоры | 4.3 — 4.9 |
| Груши | 3.6 — 4.0 | Ревень | 3.1 — 3.2 |
| Дыня | 6.0 — 6.7 | Сардины | 5.7 — 6.6 |
| Ежевика | 3.9 — 4.5 | Свежие яйца | 7.6 — 8.0 |
| Изюм | 2.8 — 3.0 | Свекла | 4.9 — 6.6 |
| Кактус | 4.7 | Сельдерей | 5.7 — 6.0 |
| Кальмары | 5.8 | Сельдь | 6.1 |
| Каперсы | 6.0 | Сидр | 2.9 — 3.3 |
| Капуста | 5.2 — 5.4 | Соевое молоко | 7.0 |
| Каракатица | 6.3 | Соевый соус | 4.4 — 5.4 |
| Карп | 6.0 | Соус Карри | 6.0 |
| Картофель | 5.6 — 6.0 | Соус Чили | 2.8 — 3.7 |
| Кетчуп | 3.9 | Спаржа | 6.0 — 6.7 |
| Кислая капуста | 3.4 — 3.6 | Сыр | 4.8 — 6.4 |
| Кленовый сироп | 4.6 — 5.5 | Томатный сок | 4.1 — 4.6 |
| Клубника, земляника | 3.0 — 3.9 | Тунец | 5.9 -6.1 |
| Клубничный (земляничный) джем | 3.0 — 3.4 | Турнепс (репа) | 5.2 — 5.6 |
| Клюквенный сок | 2.3 — 2.5 | Тыква | 4.8 — 5.2 |
| Кокос | 5.5 — 7.8 | Уксус | 2.4 — 3.4 |
| Кокосовое молоко | 6.1 — 7.0 | Уксус яблочный | 3.1 |
| Крабовое мясо | 6.5 — 7.0 | Устрицы | 5.7 — 6.2 |
| Красный перец | 4.6 — 5.2 | Финики | 6.5 — 8.5 |
| Креветки | 6.8 — 7.0 | Фруктовое желе | 2.8 — 3.4 |
| Крекеры | 6.5 — 8.5 | Фруктовый джем | 3.5 — 4.0 |
| Крыжовник | 2.8 — 3.1 | Фруктовый коктейль | 3.6 — 4.0 |
| Кукуруза | 5.9 — 7.3 | Херес | 3.4 |
| Курага( сушеные абрикосы) | 3.4 — 3.8 | Хрен | 5.4 |
| Лайм | 1.8 — 2.0 | Чай | 7.2 |
| Лаймовый сок | 2.0 — 2.4 | Черника | 3.1 — 3.4 |
| Лимоны | 2.2 — 2.4 | Шпинат | 5.5 — 6.8 |
| Лимонный сок | 2.0 — 2.6 | Яблоки | 3.3 — 3.9 |
| Лосось | 6.1 — 6.3 | ||
| Лук-порей | 5.5 — 6.2 |
Таблица. Значения pH оснований, щелочей (растворы)
Значения pH для некоторых распространенных оснований и щелочей приведены в таблице ниже.
Основания, щелочи | Нормальность раствора | pH |
| Аммиак /Ammonia | н. | 11.5 |
| Аммиак /Ammonia | 0.1 н. | 11.1 |
| Аммиак /Ammonia | 0.01 н. | 10.6 |
| Ацетат натрия / Sodium acetate | 0.1 н. | 8.9 |
| Барбитал — натрий / Barbital sodium | 0.1 н. | 9.4 |
| Бензойнокислый натрий /Sodium benzoate | 0.1 н. | 8.0 |
| Бикарбонат калия / Potassium bicarbonate | 0.1 н. | 8.2 |
| Бикарбонат натрия /Sodium bicarbonate | 0.1 н. | 8.4 |
| Гидроокись железа /Ferrous hydroxide | насыщенный | 9.5 |
| Гидроокись калия / Potassium hydroxide | н. | 14.0 |
| Гидроокись калия / Potassium hydroxide | 0.1 н. | 13.0 |
| Гидроокись калия / Potassium hydroxide | 0.01 н. | 12.0 |
| Гидроокись кальция /Calcium hydroxide | насыщенный | 12.4 |
| Гидроокись натрия / Sodium hydroxide | н. | 14.0 |
| Гидроокись натрия / Sodium hydroxide | 0.1 н. | 13.0 |
| Гидроокись натрия / Sodium hydroxide | 0.01 н. | 12.0 |
| Карбонат кальция / Calcium carbonate | насыщенный | 9.4 |
| Метасиликат натрия / Sodium metasilicate | 0.1 н. | 12.6 |
| Оксид магнияия / Magnesia | насыщенный | 10.5 |
| Пироборнокислый натрий (Бура)/ Borax | 0.01 н. | 9.2 |
| Сесвикарбонат натрия / Sodium sesquicarbonate | 0.1 н. | 10.1 |
| Тринатрийфосфат / Trisodium phosphate | 0.1 н. | 12.0 |
| Углекислый калий / Potassium carbonate | 0.1 н. | 11.5 |
| Углекислый натрий / Sodium carbonate | 0.1 н. | 11.6 |
| Уксуснокислый калий / Potassium acetate | 0.1 н. | 9.7 |
| Цианид калия / Potassium cyanide | 0.1 н. | 11.0 |
Таблица значений PH кислот. (Растворов).
В таблице представлены серная, уксусная и другие распространенные кислоты.
pH- это мера активности ионов водорода в растворах, и, таким образом, их кислотности или щелочности. Таким образом, в таблице ниже указана кислотность некоторых обычных кислот.
Кислота | Нормальность раствора | pH |
| Азотная / Nitric | 0.1н. | 1.0 |
| Алюминиевые квасцы / Alum | 0.1 н. | 3.2 |
| Бензойная / Benzoic | 0.1 н. | 3.0 |
| Борная / Boric | 0.1 н. | 5.2 |
| Винная / Tartaric | 0.1 н. | 2.2 |
| Желудочный сок / Stomach Acid | 1 | |
| Лимонная / Citric | 0.1н. | 2.2 |
| Лимонный сок / Lemon Juice | 2 | |
| Молочная / Lactic | 0.1 н. | 2.4 |
| Муравьиная / Formic | 0.1 н. | 2.3 |
| Мышьяковистая / Arsenious | насыщенный | 5.0 |
| Оксиянтарная (яблочная) / Malic | 0.1 н. | 2.2 |
| Ортофосфорная / Orthophosphoric | 0.1 н. | 1.5 |
| Салициловая / Salicylic | насыщенный | 2.4 |
| Серная / Sulfuric | н. | 0.3 |
| Серная / Sulfuric | 0.1 н. | 1.2 |
| Серная / Sulfuric | 0.01 н. | 2.1 |
| Сернистая / Sulfurous | 0.1 н. | 1.5 |
| Сероводородная / Hydrogen sulfide | 0.1 н. | 4.1 |
| Трихлороуксусная / Trichloracetic | 0.1 н. | 1.2 |
| Угольная (Углеродная) / Carbonic | насыщенный | 3.8 |
| Уксус столовый (3-15%) / Vinegar | 3 | |
| Уксусная / Acetic | 2.4 | |
| Уксусная / Acetic | 0.1 н. | 2.9 |
| Уксусная / Acetic | 0.01 н. | 3.4 |
| Хлористоводородная / Hydrochloric | н. | 0.1 |
| Хлористоводородная / Hydrochloric | 0.1 н. | 1.1 |
| Хлористоводородная / Hydrochloric | 0.01 н. | 2.0 |
| Цианистоводородная (синильная) / Hydrocyanic | 0.1 н. | 5.1 |
| Щавелевая / Oxalic | 0.1 н. | 1.3 |
| Янтарная / Succinic | 0.1н. | 2.7 |
Что такое кислотно-щелочной баланс (pH). Как он влияет на здоровье
Соотношение кислоты и щелочи в каком-либо растворе называется кислотно-щелочным равновесием (КЩР) или балансом. КЩР характеризуется специальным показателем pH (сила водорода), который показывает число водородных атомов в данном растворе.
- В нейтральной среде pH равно 7,0
- В кислой среде pH ниже 7 (от 6,9 до 0)
- В щелочной среде pH выше 7 (от 7,1 до 14,0)
Тело человека на 70-80% состоит из воды, и имеет определенное кислотно-щелочное соотношение, характеризуемое показателем pH.
Кислотность жидкостей внутри человеческого организма в норме совпадает с кислотностью крови и находится в пределах от 7,35 до 7,45 pH.
Организм постоянно стремится уравновесить это соотношение, поддерживая строго определенный уровень pH. Этот параметр оказывает существенное влияние на все биохимические процессы в организме
Кислотность плазмы артериальной крови человека колеблется в пределах от 7,37 до 7,43 рН, составляя в среднем 7,4 рН.
Кислотно-щелочное равновесие в крови человека является одним из самых стабильных параметров, поддерживающее кислые и щелочные компоненты в определенном равновесии в очень узких границах. Даже небольшой сдвиг от указанных пределов может привести к тяжелой патологии. При сдвиге в кислотную сторону возникает состояние, называемое ацидозом, в щелочную — алколозом. Изменение кислотности крови выше 7,8 рН или ниже 6,8 рН несовместимо с жизнью. Кислотность эритроцитов составляет 7,28–7,29 рН.
Мы привыкли оценивать пищу с позиций калорийности, содержания белков, углеводов, жиров, витаминов и других веществ. Но любой продукт имеет еще один фундаментальный показатель — кислотную нагрузку пищи.
Американские ученые в начале 21 века сделали подлинное открытие, когда выявили, что у любого продукта есть еще один фундаментальный показатель, который имеет критическое значение для нашего здоровья. Это кислотная нагрузка пищи. Она складывается из соотношения в пище компонентов, которые в ходе метаболизма образуют либо кислоту, либо щелочь.
Кислотная нагрузка измеряется по принципу кислота минус щелочь.
Когда в пище преобладают компоненты, образующие серную кислоту (серосодержащие аминокислоты в белках) или органические кислоты (жиры, углеводы), то кислотная нагрузка имеет положительную величину.
Если в пище больше компонентов, образующих щелочь (органические соли магния, кальция, калия), то кислотная нагрузка представляет собой отрицательную величину.
Неправильное питание — причина хронического закисления организма
По данным антропологов рацион древнего человека состоял на 1/3 из нежирного мяса диких животных и на 2/3 из растительной пищи. В этих условиях питание носило исключительно щелочной характер.
Кислотная нагрузка пищи древнего человека составляла в среднем минус 78.
Ситуация принципиально изменилась с возникновением аграрной цивилизации, когда человек стал употреблять в пищу много зерновых культур, молочные продукты и жирное мясо одомашненных животных.
Но особенно драматические сдвиги в питании произошли в конце 20 века, когда рацион заполонили промышленно обработанные «кислые» продукты питания.
Эти изменения в составе диеты были названы факторами риска в патогенезе «болезней цивилизации», включая атеросклероз, гипертонию, остеопороз, диабет 2 типа.
Кислотная нагрузка пищи современного человека составляет плюс 48.
Диета современного человека богата насыщенными жирами, простыми сахарами, поваренной солью и бедна клетчаткой, магнием и калием. В ней доминируют рафинированные и обработанные продукты, сахар, мучные изделия, множество всяких полуфабрикатов.
Что представляет собой пища современного человека? Это пицца, чипсы, глазированные сырки, новоявленные чудо-молочные продукты, кондитерские изделия, прохладительные сладкие напитки. Эта пища имеет кислые валентности.
Ежедневное «кислотное» питание приводит к хроническому пожизненному закислению (ацидозу) внутренней среды организма.
pH крови — одна из самых жестких физиологических констант организма, которая выдерживается в узких границах. При воздействии закисляющих или ощелачивающих факторов организм использует компенсаторные механизмы, буферные системы крови, а также прибегает к помощи легких, почек, органов ЖКТ и других органов. В процессе жизнедеятельности организма требуются как кислые, так и щелочные продукты распада, причем кислых образуется в 20 раз больше нежели щелочных. Поэтому защитные системы организма, обеспечивающие неизменность его кислотно-щелочного равновесия, «настроены» на нейтрализацию и выведение прежде всего кислых продуктов распада. В целом устойчивость организма к ощелачиванию в несколько раз выше, чем к закислению.
Для организма предпочтительнее состояние, приближающееся к легкому компенсированному алкалозу (ощелачиванию), т.к. в этих условиях более активно протекают процессы энергообразования, синтеза белков и липидов, минеральный обмен и др. В действительности же чаще встречается состояние, близкое к компенсированному ацидозу (закисленности). Однако постоянная нагрузка на компенсаторные системы может привести к их декомпенсации, что в первую очередь проявится в нарушениях в обмене веществ не только в пределах клетки, но и в масштабах целого организма. Компенсированный ацидоз может вредить организму незаметно, но постоянно в течение нескольких месяцев и даже лет.
Как организм управляет уровнем кислотности?
При длительных отклонениях от равновесия в кислую сторону, скелет, как депо кальция и магния, может быть привлечен к компенсаторным процессам, т.к. поддержание кислотно-щелочного равновесия в организме с участием скелета высокопроизводительно.Организм не допускает выхода pH крови за заданные пределы, но достигается это дорогой ценой. В жертву приносится скелет: в целях ощелачивания, вымываются из костей щелочные буферы — кальций и магний.
По данным последних мировых научных исследований:
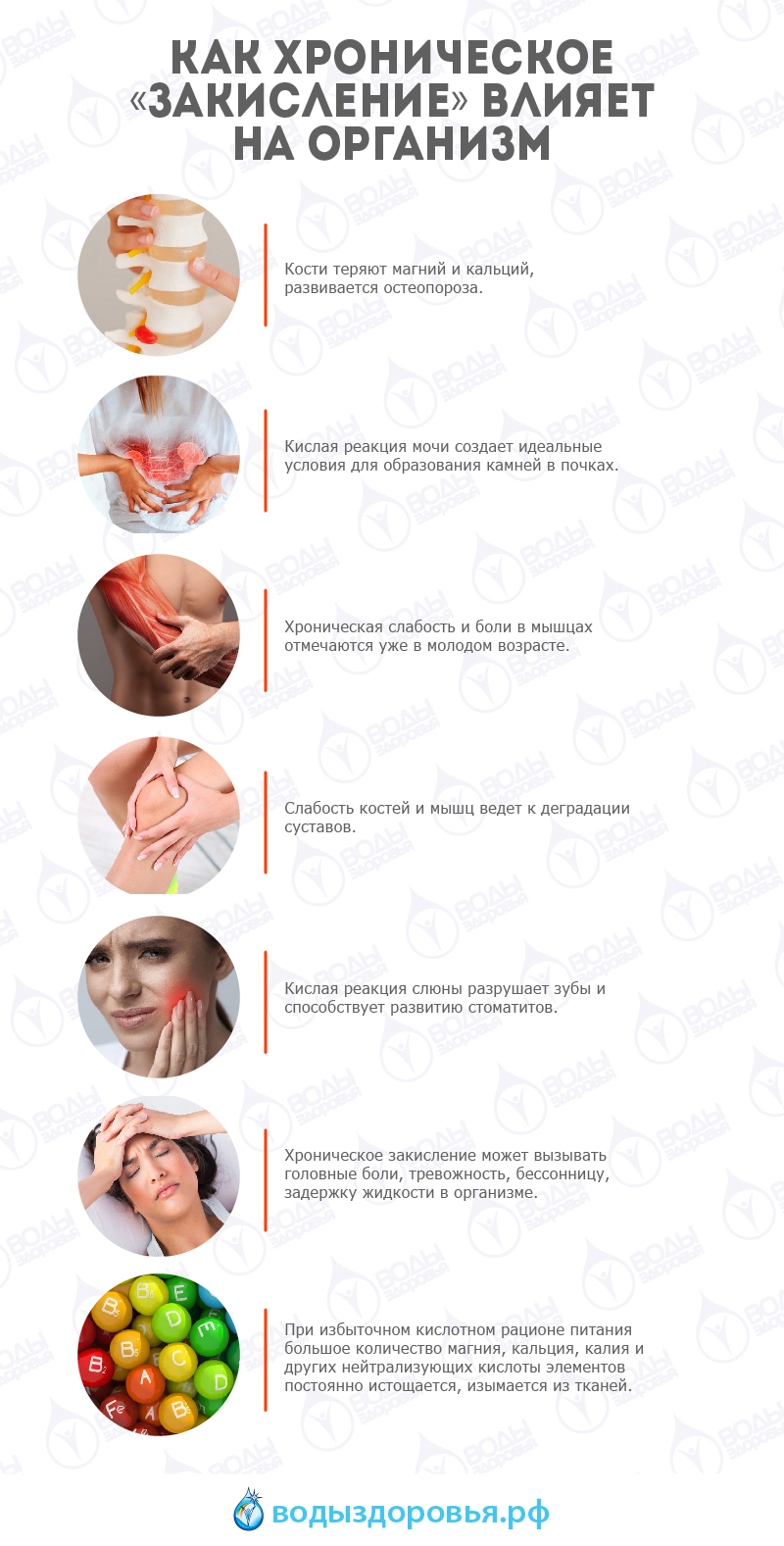
- Кости сначала теряют магний. В первую очередь уходит магний, затем кальций. Отсюда ускоренное развитие остеопороза.
- Разрушаются мышцы. Хроническая слабость и боли в мышцах отмечаются уже в молодом возрасте.
- Слабость костей и мышц ведет к деградации суставов.
- Кислая реакция мочи создает идеальные условия для образования камней в почках. Это принимает характер эпидемии. Хроническое нарушение работы почек вызывает развитие воспалительных заболеваний и почечной недостаточности.
- Кислая реакция слюны разрушает зубы и способствует развитию стоматитов.
- Хроническое закисление может вызывать головные боли, тревожность, бессонницу, задержку жидкости в организме.
- При избыточном кислотном рационе питания большое количество магния, кальция, калия и других нейтрализующих кислоты элементов постоянно истощается, изымается из тканей, и они должны быть обязательно восполнены, иначе очень скоро последуют симптомы болезней.
Магний и его роль в организме
В силу своих биологических эффектов, магний для организма может быть даже важнее кальция. По присутствию в организме магний, наряду с кальцием, натрием и калием, входит в первую четверку минералов в организме, а по содержанию внутри клетки занимает второе место после калия.
Без магния не может быть усвоен кальций. Магний уравновешивает поступление кальция, и препятствует его выведению. Магний особенно необходим для костной ткани, около 60% его содержится в костях и зубах, причем из этого количества примерно треть может быть оперативно мобилизована для нужд организма. 20% магния находится в мышцах, 19% — в других энергоемких органах организма (мозг, сердце, печень, почки и др.) и 1% — во внеклеточной жидкости. В крови 60-75% магния находится в ионизированной форме.
Причины дефицита магния
Рафинированная пища; структура питания — приготовление пищи по системе фаст-фуд (быстрой пищи) — приводит к потерям 70-80% магния.
В большинстве самых распространенных продуктов питания магний представлен скудно. Настоящими пожирателями магния являются столь любимая детьми кола, сладости. Прием большого количества кофеина: кофе, чай, прохладительные напитки (колы), шоколад и др. Чрезмерное употребление сахара ведет к усиленному выбросу магния с мочой. Недостаток магния усугубляется обеднённостью почв. Загрязняющие агенты (органические удобрения, промышленные отходы, тяжелые металлы, пестициды) снижают проникновение магния из почвы в культуры.
Дефицит магния может наблюдаться не только при нарушении питания, но и при увеличении потребности в нем: при физической и умственной нагрузке, стрессе, психоэмоциональном напряжении, например, если ребенок посещает школу с усиленной подготовкой, занимается спортом (т.е. имеет повышенную нагрузку на нервную систему). Другими причинами дефицита магния являются нарушение всасывания (поносы, запоры), заболевания ЖКТ, злоупотребление слабительными.
Повышенное выведение через почки (почечный ацидоз, диабет, мочегонные средства, алкоголь).
Применение лекарств (противозачаточные, эстрогенные, бета-блокаторы, ингибиторы АПФ, сердечные гликозиды, противотуберкулезные, антибиотики, цитостатики.
Нехватка магния влечет за собой дефицит цинка, меди, кальция, калия, кремния и дальнейшее их замещение токсичными тяжелыми металлами: свинцом, кадмием, алюминием. Огромную негативную роль играет широкое распространение различных диет для похудения. Избыточное употребление животного белка — мода на различные белковые диеты — сдвигает pH в кислую сторону, и повышает экскрецию солей мочевой кислоты.
Биологические эффекты магния
Магний — один из главных энергетиков клетки. Все энергетические процессы в организме идут при обязательном участии магния. 80-90% внутриклеточного магния находится в комплексе с АТФ.
Магний влияет на вход кальция в клетку (управление кальциевыми каналами). В этом отношении магний выступает как физиологический антагонист кальция и препятствует излишней функциональной активности клеток. Например, он предупреждает избыточное сокращение мышечных клеток (мышечные спазмы, спазмы сосудов при гипертонии и болях в сердце, спазмы бронхов при бронхиальной астме, спазмы кишечника и др.).
Магний защищает нервную систему от разрушительных стрессов и психоэмоционального напряжения. Магний является «изоляционным материалом» для проведения нервного импульса, тормозит избыточное его прохождение.
Магний поддерживает клеточный и гуморальный иммунитет, оказывает противовоспалительное и противоаллергическое действие.
Магний поддерживает соли мочи в растворенном состоянии, и препятствует их осаждению. Подавляет камнеобразование в почках, даже в незначительных концентрациях угнетает кристаллизацию. Ионы магния связывают в моче до 40% щавелевой кислоты. Предотвращают осаждение соединений кальция. Из-за недостатка магния (а его запасы истощаются гораздо быстрее, чем полагали ранее) кальций начинает порождать болезни. Магний, особенно в форме цитрата, сокращает абсорбцию оксалатов в кишечнике и его мочевую экскрецию. Таким образом, магнию отводится еще одна роль в здоровье человека, особенно это касается потребление магния в форме цитрата.
Магний участвует в процессах обезвреживания токсинов в печени, защищает от радиации.
Магний защищает от попадания тяжелых металлов в организм (напр. свинца), и выводит их из обмена веществ.
Магний необходим для укрепления костной ткани, зубов, волос и ногтей.
Итак, магний, как никакой другой элемент, важен для протекания многих метаболических процессов в организме. Неслучайно он созвучен с латинским словом «magnum», одно из значений которого означает «великий».
Магний, как и другие элементы в организме человека, не синтезируется, он поступает в наш организм с водой и пищей, его называют главным металлом жизни.
Уважаемые читатели!
Спасибо, что читаете наш блог! Получайте самые интересные публикации раз в месяц оформив подписку. Новым читателям предлагаем попробовать нашу воду бесплатно, при первом заказе выберите 12 бутылок (2 упаковки) минеральной воды BioVita или питьевой воды Stelmas. Операторы свяжутся с Вами и уточнят детали. Тел. 8 (800) 100-15-15
* Акция для Москвы, МО, Санкт-петербурга, ЛО
Спасибо за подписку на нашу рассылку
Что такое pH? Шкала и методы измерения pH
Сегодня аббревиатуру pH можно увидеть не только на уроках химии, но и на упаковках товаров бытовой химии, личной гигиены, косметики и прочих. Что такое pH мы объясним буквально на пальцах в нашей статье, а также расскажем о методах его измерения.
Показатель Ph еще называют водородным, по значению которого судят, каким является раствор — кислым, нейтральным или щелочным. Измерить показатель pH можно с помощью индикаторов — веществ, изменяющих цвет в разной среде.
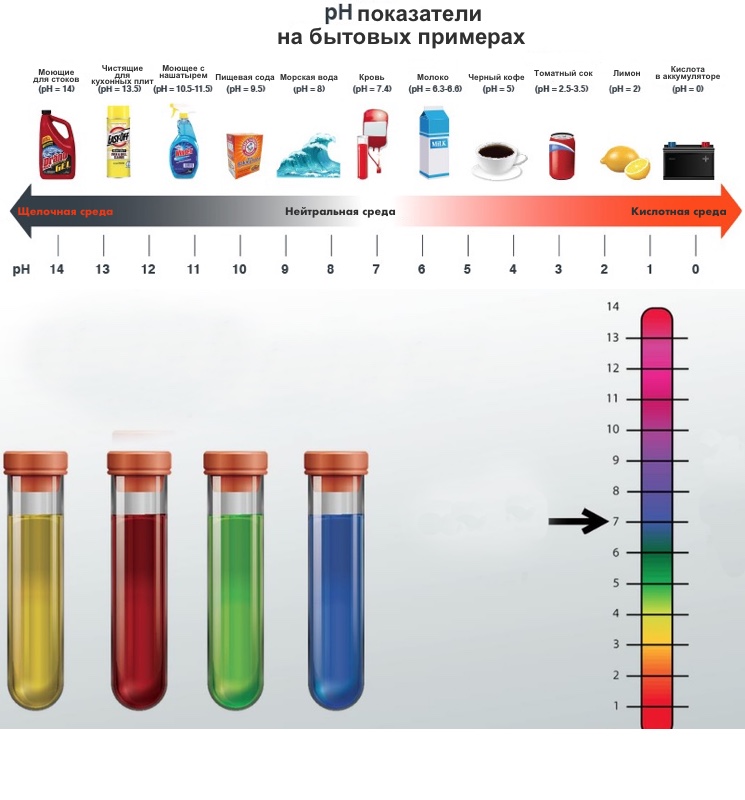
Шкала pH — показатель кислого, нейтрального или щелочного раствора
Водородный показатель pH (сокращенное от английского «power of hydrogen») позволяет судить о том, каким является раствор — кислым, нейтральным или щелочным.
Обычный интервал значений pH от 1 до 14. Значение pH определяется концентрацией ионов водорода в растворе. Нейтральные (ни кислые, ни щелочные) растворы характеризуются значением pH около 7. Чем ниже значения pH, тем сильнее кислота. Уксусная кислота, считающаяся слабой, имеет pH около 5. Сильные кислоты имеют значение pH, близкое к нулю, или даже отрицательное значение pH.
Видео для более углубленного изучения pH. Необходимы базовые знания по химии.
Щелочные растворы имеют pH выше 7; pH растворов сильных щелочей, таких как гидроксид натрия, NaOH, равен 14, а может быть и больше.
От чего зависит уровень кислотности
При добавлении кусочков цинка к соляной кислоте металл быстро реагирует и растворяется. Однако даже концентрированная лимонная кислота не оказывает никакого действия на цинк. Органические кислоты, такие как лимонная и уксусная, являются слабыми кислотами. Неорганические, такие как серная, соляная, относятся к сильным кислотам.
Растворы сильных кислот состоят только из ионов водорода и ионов кислотного остатка. Растворы более слабых кислот содержат также и неионизируемые молекулы.
Измерение pH
Простейший способ измерения pH среды — использование индикатора. Индикаторы — это вещества, принимающие различную окраску при разных значениях pH.
Лакмус, например, — это индикатор растительного происхождения, который краснеет в кислой среде и и синеет в щелочной. С помощью лакмуса или лакмусовой бумажки можно узнать, кислая среда или щелочная. Другие индикаторы меняют цвет в более узких интервалах pH.
Метиловый оранжевый, например, изменяет цвет в интервале pH 3-4,5. Использование комбинаций индикаторов позволяет довольно точно определить водородный показатель.
Более точно измерить pH раствора можно прибором, называемым pH-метром. В нем используется специальный электрод, регистрирующий концентрацию ионов водорода, а значения выводятся на шкалу.
Незначительное изменение pH влияет на живущие в воде организмы. Для измерения pH воды биологи используют электронные pH-метры, измеряющие водородный показатель среды с точностью до 0,1.
Ионизация и сила кислоты
Значение pH сильной кислоты показывает, что все ее молекулы диссоциированы (расщеплены) на ионы водорода и ионы кислородного остатка. Слабые кислоты ионизированы только частично, и только небольшая часть их молекул диссоциирована с образованием ионов водорода. В итоге их растворы являются менее кислыми, чем растворы сильных кислот. Аналогично слабые основания дают лишь небольшое количество гидроксид-ионов.