Анализ воды, определение pH
 Концентрацию ионов водорода выражают величиной рН. В сточных водах рН определяют электрометрическим способом, пользуясь стеклянным электродом. Метод основан на том, что при изменении рН на единицу потенциал стеклянного электрода изменяется при 25 °С на 59,1 мВ, при 20 °С на 58,1 мВ.
Концентрацию ионов водорода выражают величиной рН. В сточных водах рН определяют электрометрическим способом, пользуясь стеклянным электродом. Метод основан на том, что при изменении рН на единицу потенциал стеклянного электрода изменяется при 25 °С на 59,1 мВ, при 20 °С на 58,1 мВ.
Для измерения рН выпускаются специальные приборы — рН- метры, к которым прилагаются инструкции по их применению.
Стеклянные электроды этих приборов должны быть прокалиброваны по буферным растворам, имеющим определенные значения рН. Поскольку зависимость между потенциалом электрод- значением рН раствора, в который он погружен, линейна, для калибрования достаточно было бы двух буферных растворов. Все же отклонения от линейной зависимости иногда наблюдаются, поэтому желательно проведение сравнения с буферным раствором, рН которого возможно более близок к рН анализируемой cточной воды. Ниже приводятся способы приготовления нескольких буферных растворов, имеющих различные значения рН.
Буферный раствор, рН = 1,68 при 20 °С. Растворяют 12,710 г гидрооксалата калия КНз(С204)2-2Н20 чда в свежепрокнляченной и охлажденной дистиллированной воде и доводят при 20 °С объем до 1 л.
Буферный раствор, рН = 4,00 при 20 °С (4,01 при 25 °С). Растворяют 10,211 г высушенного при 110 °С гидрофталата калия КНС8Н4О4 чда в дистиллированной воде и доводят объем при 20 °С до 1 л.
Буферный раствор, рН = 6,88 при 20 °С (6,86 при 25 °С). Растворяют 3,40 г водного дигидрофосфата калия КН
Буферный раствор, рН = 9,23 при 20 °С (9,18 при 25 °С). Растворяют ,814 г 1Ма2В407-ЮН20 чда, сохранявшегося продолжительное время над рас- ( аывающимися кристаллами бромида натрия, в свежепрокипяченной и охлажденной дистиллированной воде и доводят объем при 20 °С до 1 л.
Буферный раствор, рН = 11,0 при 20 °С. Приготовляют два раствора: 11 растворяют 12,367 г борной кислоты Н
Буферные растворы хранят в склянках из полиэтилена или стекла.

При использовании рН-метров для определения рН сточных вод необходимо уделять особое внимание чистоте обоих электродов, поскольку сточные воды часто содержат жиры, масла, нефтепродукты и другие вещества, покрывающие электроды пленками. Электрод следует обтирать тонкой, мягкой тканью, смоченной эфиром, или раствором синтетического моющего вещества, затем промывать несколько раз дистиллированной водой, вытирая после каждого промывания таким же куском ткани для удаления моющего вещества. При необходимости электрод регенерируют, погружая его на 2 ч в 2%-ный раствор соляной кислоты, и тщательно промывают дистиллированной водой. В нерабочее время электрод следует хранить в дистиллированной воде.
ПНД Ф 14.1:2:3:4.121-97 МЕТОДИКА ВЫПОЛНЕНИЯ ИЗМЕРЕНИЙ рН В ВОДАХ ПОТЕНЦИОМЕТРИЧЕСКИМ МЕТОДОМ
Лаборатория «Экологический мониторинг» занимается определением pH в питьевой,водопроводной воде. Заказать определение pH , анализ воды можно оставив заявку на [email protected], или воспользовавшись формой обратной связи.
В нашей лаборатории вы можете провести полный химический анализ:
Анализ воды из скважины
Анализ воды из колодца
Анализ воды из родника
Анализ воды из бассейна
Для организаций и производственных предприятий мы предлагаем услуги по
Анализу сточных вод
Анализу ливневых сточных вод
 Ключевые слова:как определить уровень ph,показатели качества воды значение ph, определение водородного показатели ph, водородный показательph рекомендуемое значение,способы определения ph.
Ключевые слова:как определить уровень ph,показатели качества воды значение ph, определение водородного показатели ph, водородный показательph рекомендуемое значение,способы определения ph.
Материал сайта www.chemanalytica.ru
Водородный показатель | Лаборатория МГУ. Сделать анализ воды. Методы исследования и показатели качества. Исследование качества воды и почвы в Москве
Химическое обозначение: pH («пэ-аш»)
Синонимы: кислотность, активность ионов водорода, реакция среды, кислотно-щелочной баланс.
Описание: один из ключевых интегральных показателей состояния водного раствора, которым является питьевая и природная вода. Отражает активность ионов водорода в воде и рассчитывается как отрицательный десятичный логарифм этой активности (проще, концентрации).
Методы определения:
Методики, используемые в Испытательном центре МГУ для определения водородного показателя в природных средах
| Нормативный документ на методику | Метод определения | Оборудование |
|---|---|---|
| Вода | ||
|
РД 52.24.495-2005 |
потенциометрия |
Hanna Instruments pH-213 |
|
ФР.1.31.2015.20455 |
потенциометрия |
Hanna Instruments pH-213 |
| Почва | ||
| ГОСТ 26423-85 | потенциометрия | Hanna Instruments pH-213 |
| ГОСТ 27753.3-88 | потенциометрия | Hanna Instruments pH-213 |
Контроль измерений проводят с помощью измерения контрольных стандартных образцов.
Распространённость: водородный показатель характерен для всех растворов на основе воды, можно сказать, что это их неотъемлемое свойство. Вопреки распространённому мнению pH может быть меньше 0 и больше 14, хотя для природных, естественных объектов, к которым относится и питьевая вода, характерен более узкий диапазон: от 1–2 единиц pH для желудочного сока до 8–9 единиц pH для морской воды.
Нормирование
Водородный показатель нормируется для всех типов вод. Это связано с тем, что выход значения этого показателя за приделы нормы говорит о наличии серьёзных загрязнений, представляющих опасность для здоровья человека или окружающей среды. Обратите внимание: pH нормируется в воде плавательных бассейнов и воде объектов рекреационного назначения: это связано с тем, что вода с неблагоприятным pH может навредить коже.
Предельно допустимые значения водородного показателя в различных водных объектах
| Нормирование | ПДК, мг/л |
|---|---|
|
Бутилированная вода первой категории |
6,5–8,5 |
|
Бутилированная вода высшей категории СанПиН 2.1.4.1116-02 |
6,5–8,5 |
|
Вода систем централизованного водоснабжения |
6,0–9,0 |
|
Водные объекты рыбохозяйственного значения |
– |
|
Объекты рекреационного водопользования |
6,5–8,5 |
|
Вода плавательных бассейнов |
6,0–9,0 |
|
Хозяйственно-бытовые стоки |
6,0–9,0 |
|
Ливневые стоки |
6,0–9,0 |
Польза и вред
Употребление воды с выходящим за пределы нормы значением водородного показателя приводит к смещению pH жидкостей организма, несмотря на их высокую буферную способность (способность сопротивляться изменениям).
Выражение «закисление организма» является просторечным вариантом термина «окислительный стресс», который не имеет отношения к водородному показателю. Пожалуйста, не обращайте внимания на рекламные объявления, в которых говорится, что употребление воды с pH = 8,2 поможет «снять закисление организма».
По назначению врача допускается систематическое употребление воды со смещённым водородным показателем в кислую или щелочную область. Как правило, такие назначения связаны с нарушением метаболизма анионов и катионов, например оксалатов, фосфатов, кальция, магния и т.д. Без назначения врача не нужно систематически пить воду с повышенным или пониженным pH.
Обнаружение в питьевой воде pH, выходящего за пределы нормы, говорит о наличии серьёзного загрязнения или дисбаланса катионов и анионов. Если вы проводили определение только этого показателя или анализ по минимальному набору, потребуется более развёрнутое исследование для выявления причин отклонения водородного показателя от нормы.
Не рекомендуется употреблять в пищу воду со значением pH, выходящим за пределы нормы, даже если отклонения, на ваш взгляд, незначительны.
Методы очистки воды
Методы очистки воды как при пониженном, так и при повышенном pH будут полностью зависеть от причин возникновения дисбаланса.
В случае, если причиной смещения равновесия кислотно-щелочного баланса служит загрязнение, например ПАВ (моющими средствами), щёлочью или кислотой, основной способ устранение проблемы – это устранение причины загрязнения.
Если вода в естественном виде характеризуется значением водородного показателя, отличающимся от нормы, методы устранения проблемы подбираются индивидуально для вашего случая. Пожалуйста, обратитесь к нам, если вам требуется помощь.
pH – ключевой показатель, характеризующий состояние воды. Этот параметр есть во всех наших наборах показателей, т.к. подлежит обязательному контролю в питьевой воде и других типах вод. Отклонение водородного показателя от нормы – повод для углубленного изучения воды и отказа от её употребления до решения проблемы.
Как определить уровень рН
Индикаторная лакмусовая бумага обеспечивает быстрый и экономичный способ измерения рН (водородный показатель) любой необходимой жидкости и смесей жидкостей (моча, слюна, кал, сперма, кислотность влагалища, грудное молоко, растворы, вода, напитки и т.п.).
Лакмусовая бумага — необходима как в семье, так и у специалиста, проводящего исследование пациента, применима в химических лабораториях, используется для исследовательской деятельности.
В химии есть вещества, обладающие способностью менять свою окраску в присутствии кислот и щелочей. Эти вещества называются индикаторами и применяются для определения реакционной среды. Среда может быть кислой, щелочной и нейтральной. Этими веществами пропитывают фильтровальную бумагу.
Лакмус — это красящее вещество, добываемое из некоторых видов лишайника. Состав его сложен. Лакмус — слабая кислота, которой пропитывают бумагу.
Как пользоваться индикаторной бумагой:
Необходимо окунуть узкую полоску бумаги в необходимый раствор на две-три секунды. Сравнить с прилагаемой цветовой шкалой и вычислить значения.
В нейтральном растворе при 25°С рН = 7. В кислых растворах рН 7, чем больше щёлочность раствора, тем его значение больше. Вывод: чем меньше рН, тем больше концентрация ионов Н+, т. е. выше кислотность среды, и наоборот, чем больше рН, тем меньше концентрация ионов Н+, т. е. выше щёлочность среды.
Параметры индикаторной бумаги: измерение pH от 1 до 14. Индикаторная бумага может иметь вид полосок, рулонов, в коробках, в тубусах, пеналах, отрывная. Универсальной индикаторной бумагой пользуются только для приближённого определения значений рН в широких пределах с точностью около одной единицы рН или десятой доли.

ПШ — МЕТР — НУЖЕН ЛИ ОН?
Чтобы точно идентифицировать значение этого показателя в рутинных методах пользуются рН-метром. Использование индикаторов для определения точного значения не практикуется из-за субъективного определения цвета или невысокой точности самого индикатора. Однако, преимуществом индикаторов является их дешевизна, наглядность анализа, быстрота.
Пш метры имеют различные характеристики, исходя из которых формируется его стоимость, а именно диапазон измерения PH: 0.00 — 14.00, рабочая температура, цена деления: 0,1 pH, точность: 0,1 pH . Стоимость колеблется от 15 до 100 дол.
Для мыловарения и кремоварения, в принципе подойдет самый дешевый. Он имеет следующие характеристики: диапазон измерения PH: 0.00 — 14.00, рабочая температура: 0 — 50°С, цена деления: 0,1 pH, точность: 0,1 pH . ПШ метр должен быть обязательно откалиброван.
Если ПШ метр неоткалиброван, показывает неверные значения, то нужно его откалибровать.
Пример калибровки ph метра 009. Впрочем и другие модели калибруются по этому же принципу !
Что нужно для калибровки? Собственно пш метр, отвертка шлицевая (идет в комплекте), калибровочный раствор и конечно же, прямые руки, куда же без них — без них необходится ни одно дело. Я считаю что бюджетный ph метр 009 достаточно калибровать по одной точке, имея раствор ph 4.00, либо ph 6.8. Раствор должен иметь комнатную температуру! Если он хранится в холодильнике, заранее достаньте его, хорошенько взболтайте его непосредственно перед самой калибровкой.
Включенный пш метр поместите в калибровочный раствор. Выждете минуту. На обратной стороне пш метра есть винт, его надо крутить по часовой стрелке или против, в зависимости от показателя на дисплее. Вы должны сопоставить значения на дисплее с ph вашего раствора! Вот собственно и весь технологический процесс!
КАК ПОЛЬЗОВАТЬСЯ ПШ МЕТРОМ
Обычно к прибору прилагается инструкция.
Ниже приведен пример инструкции Миниатюрного рН-метра-тестер pH-PAL
- снять защитный колпачок в нижней части корпуса;
- включить прибор, сдвинув верхний переключатель вправо;
- погрузить прибор в исследуемый раствор до рифленой метки;
- помешать энергично в течение 5-6 секунд. Произвести считывание показаний после их стабилизации;
- если электрод был сухим, выждать несколько дольше, что позволит прибору осуществить термокомпенсацию;
- после каждого измерения тщательно промывать электрод дистиллированной водой;
- после окончания измерений выключить прибор и надеть защитный колпачок.
НОРМЫ PH
Растворы и жидкости в отношении их кислотности считаются:
- нейтральными при рН = 7
- кислыми при pH 7
Кислотность мочи
Если уровень рН мочи колеблется в пределах 6,0 — 6,4 по утрам и 6,4 — 7,0 по вечерам, то организм функционирует нормально. Наиболее оптимальный уровень — слегка кислый, в пределах 6,4 — 6,5. Значение рН мочи ниже 5,0 говорит о ее резкой закисленности, выше 7,5 — о ее резко щелочной реакции.
Реакция мочи определяет возможность образования камней: уратных — в кислой, оксалатных — в нейтрально-кислой, фосфатных — в более щелочной среде. Так, например камни мочевой кислоты фактически никогда не встречаются при рН мочи более 5,5, а фосфатные камни никогда не образуются, если моча не щелочная. Лучшее время для определения уровня рН — за 1 час до или спустя 2 часа после еды.
Проверяйте уровень рН два раза в неделю 2-3 раза в день.
С помощью Индикаторной лакмусовой бумаги рН-теста можно легко, быстро и точно проследить за ответной реакцией мочи на изменение типа питания, применение лекарственных средств или БАД. Положительная динамика рН может служить критерием правильности выбранной диеты или лечения.
Кислотность мочи сильно изменяется в зависимости от принимаемой пищи, например, приём растительной пищи повышает щелочную реакцию мочи. Кислотность мочи повышается, если в рационе человека преобладает мясная пища, богатая белками.
Увеличивает кислотность мочи тяжелая физическая работа.
Повышение кислотности мочи отмечается при повышенной кислотности желудка. Пониженная кислотность желудочного сока не влияет на кислотность мочи.
Кислотность мочи изменяется при многих заболевания или состояниях организма, поэтому определение ее кислотности является важным диагностическим фактором.
Кислотность слюны:
Кислотность слюны зависит от скорости слюноотделения. Обычно кислотность смешанной слюны человека равна 6,8–7,4 pH, но при большой скорости слюноотделения достигает 7,8 pH. Кислотность слюны околоушных желёз равна 5,81 pH, подчелюстных — 6,39 pH. У детей в среднем кислотность смешанной слюны равна 7,32 pH.
Оптимальное измерение с 10 до 12 часов. Измерять ее лучше натощак, за два часа до или два часа после приема пищи. Слюноотделение снижается в вечерние часы и ночью.
Для увеличения слюноотделения, с целью повышения pH показателя слюны, хорошо если на тарелке будет лежать кусочек лимона, он даже при зрительном восприятии повышает слюноотделение. Пища должна выглядеть аппетитно, подаваться на красивой посуде, аппетитно оформленной зеленью и/или/ овощами, должна, что называется радовать глаз! Текут не только слюнки, но и соки в организме, готовящиеся к процессу переваривания пищи. Это психическая фаза пищеварительной секреции.
Кислые гастроэзофагеальные и фаринголарингеальные рефлюксы, достигающие полости рта, играют ведущую роль в возникновении патологии полости рта. В результате попадания соляной кислоты происходит снижение кислотности смешанной слюны ниже 7,0 рН. Слюна, в норме обладающая щелочными свойствами, при низком рН, особенно при значениях 6,2–6,0, приводит к очаговой деминерализации эмали зубов с появлением эрозий твердых тканей зубов и образованием в них полостей — кариеса. Увеличивается количество слизи на слизистой оболочке, десны становятся отечными и воспаленными.
При понижении кислотности в ротовой полости, снижается кислотность зубного налета, что вызывает развитие кариеса.
Находящиеся во рту бактерии «расцветают» при отсутствии воздуха. Слюна же, богатая кислородом, активно препятствует их размножению. Неприятный запах изо рта появляется, когда приток слюны замедляется, к примеру, во сне. Волнение, голод, произнесение длинного монолога, дыхание через рот (к примеру, при насморке), стресс – сушат ротовую полость, приводя к понижению pH слюны. Уменьшение притока слюны неизбежно происходит с возрастом.
Можно подключить слабощелочное полоскание рта водой с добавлением соды и так же приема ее внутрь между едой, предложенный профессором Огуловым А.Т. – слабощелочного pH 7,4-8. Полоскание рта содовой водой имеет место при различных воспалительных заболеваниях десен и зубов и при общем закислении организма.
Установить нужный pH воды для полоскания или приема внутрь можно при помощи лакмусовой индикаторной бумаги. Рецептов с нужными пропорциями быть не может, т.к. вода в каждом регионе своя, имеющая свой pH. Потому необходимо иметь под рукой индикаторную бумагу.
Кислотность влагалища
Нормальная кислотность влагалища женщины колеблется от 3,8 до 4,4 pH и в среднем составляет 4,0–4,2 pH.
Кислотность влагалища при различных заболеваниях:
- цитолитический вагиноз: кислотность меньше 4,0 рН
- нормальная микрофлора: кислотность от 4,0 до 4,5 pН
- кандидозный вагинит: кислотность от 4,0 до 4,5 pН
- трихомонадный кольпит: кислотность от 5,0 до 6,0 pH
- бактериальный вагиноз: кислотность больше 4,5 pH
- атрофический вагинит: кислотность больше 6,0 pH
- аэробный вагинит: кислотность больше 6,5 pH
За поддержание кислотной среды и подавление роста условно-патогенных микроорганизмов во влагалище отвечают лактобактерии (лактобациллы) и, в меньшей степени, другие представители нормальной микрофлоры. При терапии многих гинекологических заболеваний на первый план выходит восстановление популяции лактобацилл и нормальной кислотности.
Кислотность спермы
Нормальный уровень кислотности спермы находится в пределах от 7,2 до 8,0 рН. Отклонения от этих значений, само по себе, не рассматривается как патология. В то же время в совокупности с другими отклонениями может свидетельствовать о наличии заболевания.
Увеличение уровня рН спермы происходит при инфекционном процессе. Резко щелочная реакция спермы (кислотность примерно 9,0–10,0 рН) свидетельствует о патологии предстательной железы.
При закупорке выводных протоков обоих семенных пузырьков отмечается кислая реакция спермы (кислотность 6,0–6,8 рН). Оплодотворяющая способность такой спермы снижена. В кислой среде сперматозоиды теряют подвижность и погибают. Если кислотность семенной жидкости становится меньше 6,0 рН, сперматозоиды полностью теряют подвижность и погибают.
Кислотность слез в норме — от 7,3 до 7,5 pH.
Кислотность в желудке.
- Минимальная теоретически возможная кислотность в желудке 0,86 рН.
- Максимальная теоретически возможная кислотность в желудке 8,3 рН.
- Нормальная кислотность в просвете тела желудка натощак 1,5–2,0 рН.
- Кислотность на поверхности эпителиального слоя, обращённого в просвет желудка 1,5–2,0 рН.
- Кислотность в глубине эпителиального слоя желудка около 7,0 рН. Нормальная кислотность в антруме желудка 1,3–7,4 рН.
Причиной многих болезней органов пищеварительного тракта является дисбаланс процессов кислотопродукции и кислотонейтрализации. Длительная гиперсекреции соляной кислоты или недостаточность кислотонейтрализации, и, как следствие, повышенная кислотность в желудке и/или двенадцатиперстной кишке, вызывает так называемые кислотозависимые заболевания. В настоящее время к ним относят: пептическую язву желудка и двенадцатиперстной кишки,гастроэзофагеальную рефлюксную болезнь (ГЭРБ), эрозивно-язвенные поражения желудка и двенадцатиперстной кишки на фоне приема аспирина или нестероидных противовоспалительных препаратов (НПВП), синдром Золлингера-Эллисона, гастриты и гастродуодениты с повышенной кислотностью и другие.
Пониженная кислотность наблюдается при анацидном или гипоацидном гастрите или гастродуодените, а также при раке желудка. Гастрит (гастродуоденит) называется анацидным или гастритом (гастродуоденитом) с пониженной кислотностью, если кислотность в теле желудка составляет примерно 5 или больше единиц pH. Причиной пониженной кислотности часто бывает атрофия париетальных клеток в слизистой оболочке или нарушения в их функциях.
Кислотность в кишечнике:
- Нормальная кислотность в луковице двенадцатиперстной кишки 5,6–7,9 рН.
- Кислотность в тощей и подвздошной кишках нейтральная или слабощелочная и находится в пределах от 7 до 8 рН.
- Кислотность сока тонкой кишки 7,2–7,5 рН. При усилении секреции достигает 8,6 рН.
- Кислотность секрета дуоденальных желез — от рН от 7 до 8 рН.
- Кислотность панкреатического сока — от 7,5 до 9 рН.
- Кислотность сока толстой кишки 8,5–9,0 рН.
В нижних отделах толстой кишки значения pH кислотности постепенно возрастают, достигая максимального значения рН в области ректосигмоидального перехода.
- Кислотность кала в норме от 6,0 до 8,0 рН.
- Кислотность мекония (первородного кала новорожденных) — около 6 рН.
- Кислотность грудного женского молока — 6,9-7,5 pH
Кислотность крови:
Кислотность плазмы артериальной крови человека колеблется в пределах от 7,37 до 7,43 рН, составляя в среднем 7,4 рН. Кислотно-щелочное равновесие в крови человека является одним из самых стабильных параметров, поддерживающее кислые и щелочные компоненты в определенном равновесии в очень узких границах. Даже небольшой сдвиг от указанных пределов может привести к тяжелой патологии. При сдвиге в кислотную сторону, возникает состояние называемое — ацидозом, в щелочную — алколозом. Изменение кислотности крови выше 7,8 рН или ниже 6,8 рН несовместимо с жизнью.
Кислотность эритроцитов составляет 7,28–7,29 рН.
Нормальная кровь оживляет лимфатические клетки, способные уничтожить опухолевые клетки. В организме человека имеется множество лимфатических клеток (например, клетки NK, клетки LAK). Их уникальность состоит в том, что они способны отличать нормальные клетки от больных и пораженных, и уничтожать последние. В этом и заключается функция иммунитета человеческого организма. Самая большая активность лимфатических клеток по уничтожению больных клеток проявляется при РН 7,4. Однако обычно вокруг пораженных клеток, существует более кислая среда, которая препятствует активности лимфоцитов, работающих лучше при слабо щелочном pH.
Употребляя продукты питания, обладающие защелачивающим действием, можно корректировать баланс РН в пределах 0,5 единиц, создавая благоприятную среду для воздействия лимфоцитов и уничтожения пораженных или аномально построенных клеток.
Раковая ткань имеет повышенную кислотность в отличие от нормальной ткани и организм защищает её фиброзной оболочкой у которой pH щелочной. Если продолжать применять кислую диету, оболочка растворяется, и раковые клетки выпускаются наружу.

КАК ПРОВЕРИТЬ СРЕДУ СВОЕГО ОРГАНИЗМА САМОСТОЯТЕЛЬНО
1. Проверить водородный показатель (рН) — реакцию слюны и мочи по шкале цветной индикаторной (лакмусовой) бумажки. Если слюна и моча находятся в пределах рН 5,0-5,7, существует предрасположенность к онкологическим заболеваниям, но это не значит, что человек заболеет. Если слюна и моча в пределах рН 7,0-7,4 вы защищены от онкологических заболеваний.
2. Можно сделать биоимпедансный анализ (диагностика состава тела). По количеству воды, находящейся в связанном состоянии, вы определите, существует ли у вас смещение кислотно-щелочного баланса. Если переизбыток такой воды – однозначно кислая среда, недостаток — щелочная.
ЕСЛИ ОРГАНИЗМ ЗАКИСЛЕН:
В наше время это наблюдается очень часто в связи с неверным питанием и отношением к своему организму.
К закислению организма в первую очередь приводит:
- преобладание в питании таких продуктов, как сахар, мясо, курица, рыба, сладости, пастеризованные молочные продукты, мучные изделия и крупы;
- второй фактор — потребление несовместимых пищевых продуктов, например, белков с углеводами;
- окислителями также являются многие консерванты и пищевые добавки, которыми так богаты современные продукты, особенно с большим сроком хранения;
- алкогольные напитки;
- кофе, чай, шоколад, табак.
Для защелачивания крови организм расходует минеральные вещества — кальций, натрий, калий, железо, магний. А это ведет к физической слабости, быстрой утомляемости, снижению умственной деятельности и бессоннице, раздражительности и депрессивным состояниям. Вымывание кальция из костной ткани служит причиной тяжелой болезни — остеопороза.
Что делать, если организм закислен:
Ежедневный рацион здорового человека должен включать не менее 75-85 % ощелачивающих пищевых продуктов, а в питании человека, страдающего каким-либо заболеванием, их доля должна быть увеличена до 90 %. К ощелачивающим продуктам относятся овощи и фрукты. И именно в такой последовательности, а не наоборот, поскольку существует негласное правило: чем ближе овощ или фрукт к поверхности почвы, тем выше в нем содержание подщелачивающих макроэлементов (например, калия). Калий, содержащийся в картофеле с кожурой, базилике, кураге, многих других овощах и фруктах, помогает бороться с закислением (латентным ацидозом) и создавать благоприятные условия для усвоения питательных веществ и лекарственных препаратов. Наиболее полезны в этом смысле свежие помидоры, свекла, курага, дыни. Более эффективно ощелачивают кровь свежеприготовленные овощные или фруктовые соки. Самые полезные — морковный, сельдереевый и арбузный.
В овощах и фруктах доминируют щелочные валентности, поэтому их употребление устраняет ацидоз.

В ваше меню обязательно должны входить тертые сырая свекла и морковь, мелко нарезанная капуста, укроп, сельдерей, лук и чеснок. Очень полезно употреблять в пищу молодые зеленые побеги растений, мед, травяные чаи, соевый соус, морские водоросли, проростки пшеницы.
Один раз в неделю желательно устраивать себе разгрузочные дни, употребляя в пищу только сырые овощи и фрукты или даже в один из таких дней пить только соки и пюре.
Большая часть бобовых и круп, за исключением гречки и проса, при обычном приготовлении повышает кислотность крови. Однако после замачивания или проращивания они приобретают ощелачивающее действие. Сырые орехи и семена нужно замачивать за полчаса до еды, крупы — за 0,5-2 часа перед варкой, бобовые — на ночь.
При смещении кислотно-щелочного равновесия в щелочную сторону (как правило, это можно наблюдать у вегетарианцев) в тканях создается нехватка воды, кожа становится сухой и обезвоженной. Всему должна быть мера.

Физическая работа и спорт немного смещает реакцию организма в щелочную сторону.
Немаловажное значение имеет настроение человека. Хорошее веселое настроение нормализует кислотно-щелочное равновесие.
Один раз в неделю, при закислении организма, желательно устраивать себе лечебные дни, употребляя в пищу только овощи (1,5 кг овощей, разделяя на весь день), в летний период вареные и иногда сырые, в осеннее-зимний только термически обработанные) и обязательно чистую горячую воду.
Если вы заболели, необходимо отказаться от любой мясной пищи и от бульонов.
Если вам предстоит операция, ее нужно делать в щелочном режиме организма, после операции соблюдать растительную диету.
Обратите внимание — защелачивающие продукты (к примеру, фрукты), употребляемые с сахаром (сильным закислителем) —закисляют организм (кровь).
ПРОДУКТЫ ЗАКИСЛЯЮЩИЕ И ЗАЩЕЛАЧИВАЮЩИЕ:
Степень их действия отметим количеством плюсов:
Некоторые продукты, закисляющие организм: сахар! (+++), дичь (++++), устрицы (++++), раки (++++), телятина (+++), яйца (+++), цыплята (+++), рыба (++), мидии (+++), кофе (+++), варенье (+++), бобы запеченные (+++), печень говяжья (+++), свинина нежирная (++), бекон тощий (++), ветчина (++), сливы маринованные (++), бананы зеленые (++), горох сушеный (++), мука белая (++), ячневая крупа (++), мамалыга и кукурузные хлопья (++), крахмал (++), арахис (++), сыр твердый (++), хлеб белый (++), баранина вареная (++), баранина тушеная (+), хлеб черный (+), бобы сушеные (+), сыр мягкий (+), сливки (+), говядина (+), бекон жирный (+).
Некоторые продукты, защелачиваюшие организм: инжир (++++), свекла свежая (++++), сельдерей (++++), ягоды (++++), грейпфрут (++++), лук латук (++++), шампиньоны (++++), помидоры свежие (++++), абрикосы сушеные (++++), абрикосы свежие (+++), груши (+++), облепиха (+++), лимон (если он употребляется без сахара) (+++), апельсин (+++),арбуз (+++), дыня (+++), чернослив (+++), перец (+++), бобы свежие (+++), смо¬родина (+++), капуста (все виды) (+++), фисташки (+++),огур¬цы (+++), одуванчик (листья) (+++), пастернак (+++), сливы (+++), персики (+++), молоко цельное (+++), кумыс (+++), сыворотка молочная (+++), бананы спелые (++), яблоки (++), виноград (.++), вишня (++), изюм (++), финики (++), лук (++), зеленый горошек (++), редис (++), миндаль (++), морковь (++), картофель с кожурой (++), клюква (+), спаржа (+), сало свиное (+). опубликовано econet.ru
Живая вода и ее показатели. рН, ОВП, TDS
То, что мы едим и пьем, из этого и строится наш организм. Вода является основной составляющей нашего организма. И от качества и количества выпиваемой воды на прямую зависти наше здоровье.
Давайте подробнее разберемся с основными характеристиками воды, которые мы можем измерить недорогими приборами.
1.Чистота воды
Чистота воды — Самое главное — вода должна быть чистая без патогенной микрофлоры и различных вредных примесей, тяжелых металлов, пестициодов, ржавчины, хлора и т.д.
2.Общая минерализация воды

Минерализация воды — это показатель количества растворенных частиц в воде таких как кальций, натрий, магний и различных соединений. Измеряется этот показатель прибором — TDS метром, единица измерения — миллиграмм на литр (мг/л). Употребляя ежедневно жесткую воду с большим колличеством минералов, эти минералы могут откладываться в организме в виде камней в почках. Если пить дистиллированную воду это тоже может привести к различным заболеваниям, хотя по этому поводу мнения разделяются. Одни считают, что мы достаточно минералов получаем с пищей. Допустим съев кусочек сыра 1см2, мы получаем дневной состав минералов содержащихся в дневной норме выпиваемой воды (30 гр на 1кг веса человека). Другие считают, что употребляя воду после фильтра обратного осмоса вымываются соли из организма, возникают различные заболевания, в том числе хрупкость костей. Я же склоняюсь к слабо минерализованной воде 50-120(мг/л), так как живут же люди на крайнем севере и пьют растопленный снег, а возьмите горцев, которые пьют талую деминерализованную воду с горных рек и живут дольше 100 лет. Так же считаю, что употребляя чистую воду с отрицательным ОВП и нейтральным рН организму легче усваивать ее в организм.
Важно!!! вода в кране или роднике может иметь показания ТДС 50-100. На первый взгляд по этому параметру идеальные показания но что содержиться в этих 50-100 неизвестно может содержатся вредные примиси или потагенная микрофлора, поэтому смотрим пункт №1- Чистота воды.
3. ОВП воды
ОВП воды – это окислительно восстановительный потенциал, измеряется прибором — ОВП метром, единица измерения милливольты (mV). Этот показатель, на мой взгляд, не менее важный. Околоплодные воды имеют ОВП около -200 мВ, грудное молоко матери -70 мВ, кровь в организме здорового человека -70 мВ, эти цифры заставляют задуматься. В простонародье воду с отрицательным ОВП называют живой, с положительным ОВП мертвой. Второе название ОВП от английского редокс-потенциал — Reduction/Oxidation.

ОВП жидкости означает возможность отдавать или принимать электроны из вне. Окислительный (+) – это способность принимать электроны, а Восстановительный (-) потенциал – способность отдавать электроны. Активность электронов — важнейшая характеристика среды организма и напрямую связана с процессами жизнедеятельности. Множественные опыты доказывают пользу употребления воды с отрицательным ОВП. Соответственно необходимо постоянно пить воду близкую к значению ОВП организма человека, чтобы вода усваивалась лучше.
ОВП воды после обратного осмоса положительное, оно не меняестя какое входит такое и выходит а вот рН воды падает на еденицу от входной воды.
Важно ! ! ! Почитайте эту статью — выбор фильтра для питьевой воды с нужными параметрами ОВП, рН и TDS.

4. рН воды
рН воды – это водородный показатель и характеризует активность иона водорода в среде. Он варьируется от 0 до 14. Считается, что вода с показателем рН равным 7 имеет 10 — 7 моль на литр ионов водорода и является нейтральной. рН меньше 7 — среда кислая, больше 7 — среда щелочная. По нормам Российским СанПиН 2.1.4.559-96 рН питьевой воды колеблется в пределах 6,0…9,0. Импортные нормы немного жестче и имеют показатели пределах от 6,5 до 8,5. Желательно употреблять воду с показателями рН 7 — 8. Употребление воды с такими показателями увеличивает общую продолжительность жизни и позволяет поддерживать кислотно-щелочное равновесие организма, так как внутренняя среда имеет слабощелочной показатель. Для организма так же необходимо буферное содержание щелочных микроэлементов в воде и питании, с помощью которых организм поддерживает щелочной показатель крови в пределах 7.45.
Важно ! ! ! не путайте этот показатель с щелочностью. Щелочность это буферное содержание щелочных микроэлементов в среде, этот показатель тесно связан с рН но невсегда. (например лимон — он имеет кислую среду и рН в районе 3 но на организм оказывает ощелачивающий эффект из за содержания щелочных микроэлементов)
Важно ! ! ! Чистая вода в природе(без каких либо примисей Дисцилят, снег и тд) имеет показатель около рН 6.
Вы спросите где взять такую воду в условиях мегополюса???
1. чистую (от всевозмжной грязи) ;
2. с регулируемой минерализацией ионами Са, Mg, К, и т.д;
3. с отрицательным ОВП;
4. с щелочным рН;
Ответ — начните пользоваться установкой ИКАР(мод.01os)
Если вы хотите ежедневно употеблять чистую воду с отрицательным ОВП, с нейтральным рН и нужным минеральным составом, тогда вам просто необходимо утановить установку ИКАР (мод. 01os) у себя дома под мойку и наслаждаться ежедневно питьевой водой высшего качества.
Лучший фильтр для воды ИКАР – установка не имеющая аналогов, позволяет получать в домашних условиях чистую, полезную и вкусную воду. Купить фильтр для воды и более подробней ознакомиться можно здесь: купить фильтр для воды.

— Автоматическая работа системы и большой ресурс
— Эффективная очистка воды и обеззораживание
— Регулируемая минерализация
— Изменение ОВП в отрицательную сторону
— Возможность подключения рН реактора.
Это лучший фильтр обратного осмоса с минерализатором в рейтинге фильтров для очистки воды.
Пейте полезную воду и будьте здоровы!
pH питьевой воды: допустимые уровни и многое другое
Если вы купите что-то по ссылке на этой странице, мы можем заработать небольшую комиссию. Как это работает.
Возможно, вы слышали слово «pH», используемое для описания качества питьевой воды, но знаете ли вы, что оно означает?
pH — это измерение электрически заряженных частиц в веществе. Он указывает, насколько это вещество является кислотным или щелочным (основным). Шкала pH варьируется от 0 до 14:
- Кислая вода имеет pH ниже 7.Наиболее кислые вещества имеют pH 0. К этой категории относится аккумуляторная кислота.
- Щелочная вода имеет pH 8 или выше. Наиболее щелочные вещества, такие как щелочь, имеют pH 14.
- Чистая вода имеет pH 7 и считается «нейтральной», поскольку она не обладает ни кислотными, ни основными свойствами.
Агентство по охране окружающей среды США (EPA) отвечает за мониторинг качества питьевой воды в населенных пунктах США.
КачествоpH не подпадает под регулирование EPA, потому что оно считается эстетическим качеством воды.Однако агентство рекомендует муниципальным поставщикам питьевой воды поддерживать уровень pH в водоснабжении от 6,5 до 8,5.
Уровень pH пресной воды варьируется в зависимости от погодных условий, деятельности человека и природных процессов.
Вода с очень низким или высоким pH может быть признаком химического загрязнения или загрязнения тяжелыми металлами.
Вода, pH которой не соответствует «безопасному» диапазону от 6,5 до 8,5, особенно щелочная, не обязательно небезопасна. Однако очень щелочная вода может иметь неприятный запах или вкус, а также может повредить трубы и водопроводные приборы.
Кислая вода с pH менее 6,5 с большей вероятностью будет загрязнена загрязнителями, что делает ее небезопасной для питья. Он также может разъедать (растворять) металлические трубы.
Многие муниципальные поставщики воды добровольно проверяют pH своей воды, чтобы контролировать загрязняющие вещества, на что может указывать изменение pH. Когда присутствуют загрязнители, компании водоснабжения обрабатывают воду, чтобы снова сделать ее безопасной для питья.
Щелочная вода стала популярным выбором для питьевой воды за последние несколько лет.Некоторые люди говорят, что употребление слабощелочной воды с pH от 8 до 9 может улучшить ваше здоровье. Они говорят, что это может замедлить старение, поддерживать здоровый уровень pH в организме и блокировать хронические заболевания, такие как рак.
Несмотря на многочисленные заявления о пользе для здоровья от потребителей и продавцов щелочной воды, научных доказательств того, что щелочная вода полезнее других видов питьевой воды, практически нет.
Но есть несколько исследований, показывающих, что щелочная вода может принести пользу здоровью людей с определенными заболеваниями, например:
Электролизованная вода с высоким содержанием щелочи также может быть полезна после обезвоживания, вызванного физическими упражнениями.
Необходимы дополнительные исследования, чтобы полностью подтвердить результаты этих небольших исследований.
Муниципальные поставщики воды обычно стараются поддерживать в своей воде нормальный pH около 7, поэтому обычно нет необходимости проводить домашнее тестирование.
Но если вы заметили, что ваши краны и трубы приобрели ржаво-красный, белый или синий цвет, вы можете принять меры самостоятельно. Это изменение цвета, а также любое изменение цвета вашей питьевой воды является признаком коррозии, вызванной кислой водой.Ржавые трубы должны быть осмотрены профессиональным сантехником и при необходимости заменены.
Проверить pH питьевой воды дома довольно просто и недорого. Все, что вам нужно, это домашний тестовый набор. Они бывают разных форм по разной цене.
Одними из самых популярных продуктов для тестирования pH являются «ручки» для проверки качества воды. Просто окуните ручку в образец питьевой воды, и через несколько секунд получите точное значение pH. Две популярные модели — это цифровые счетчики воды 7Pros и Jellas.
Если ваша вода попадает в рекомендованный EPA диапазон от 6,5 до 8,5, нет необходимости предпринимать какие-либо действия.
Если pH вашей питьевой воды выходит за пределы безопасного диапазона, пора действовать. Позвоните в местную компанию по производству питьевой воды, чтобы сообщить им о результатах анализа.
Они могут посетить ваш дом, чтобы профессионально проверить вашу воду. Им следует справиться с ситуацией, если результаты их теста также не верны. Поскольку pH часто является признаком загрязнения, компания по водоснабжению может провести несколько тестов для выявления различных загрязняющих веществ.
Тем временем, если вы подозреваете проблемы с питьевой водой — будь то pH, странная текстура, неприятный вкус или неприятный запах — вы можете приобрести кувшин, подобный тому, что сделан Brita, или установить систему фильтрации в своем доме. кухонная мойка. PUR имеет популярную систему фильтрации.
Обязательно поддерживайте связь с вашим местным поставщиком воды. Попросите годовой отчет, чтобы следить за качеством питьевой воды.
.Что нужно знать о pH воды
Если вы купите что-то по ссылке на этой странице, мы можем заработать небольшую комиссию. Как это работает.
В чистом виде вода имеет pH 7, что соответствует точному центру шкалы pH. Частицы в воде могут изменить pH воды, и большая часть используемой воды имеет pH где-то между 6,5 и 8,5.
Есть несколько важных вещей, которые нужно понять о шкале pH и о том, как она соотносится с водой. Например, возможно, что употребление щелочных напитков принесет пользу для здоровья.
Продолжайте читать, чтобы узнать больше о pH воды.
В химии pH — это измерение концентрации ионов водорода в растворе на водной основе. Более низкий pH означает, что в жидкости больше ионов водорода, тогда как более высокий pH указывает на меньшее количество ионов водорода в жидкости.
Проще говоря, pH — это шкала от 1 до 14, которая измеряет кислотность или щелочность жидкости. В середине шкалы находится чистая дистиллированная вода с нейтральным pH 7. Все, что имеет pH ниже 7, является кислотой, а все, что pH выше 7, является щелочью или основанием.
Если использовать повседневные примеры, уксус очень кислый, с pH около 2. Отбеливатель, наоборот, очень щелочной, с pH около 13,5.
Важно отметить, что эта шкала применима только к жидкостям на водной основе.
pH играет важную роль в свойствах жидкости, содержащей воду.
Например, pH воды может сделать определенные элементы в ней, такие как минералы и металлы, более или менее доступными для организма. Тяжелые металлы в воде с более низким pH, как правило, более токсичны, поскольку они более доступны для организма.Высокий pH сделает тяжелые металлы менее доступными и, следовательно, менее токсичными.
Уровень pH также может быть признаком наличия в жидкости других загрязняющих веществ или бактерий. В общем, очень высокий или очень низкий pH может сделать воду непригодной для определенных применений.
Например, жесткая вода — это общий термин для воды, содержащей много минералов. Эти минералы делают воду очень щелочной. Когда вода проходит через трубы и устройства, использующие воду, такие как посудомоечные машины или душевые, эти минералы прилипают как к трубам, так и друг к другу, что приводит к накоплению минералов.
Накопление минералов может вызвать различные проблемы с водой в доме, например, снизить эффективность моющих средств и мыла. Это также может привести к снижению давления воды или даже засорению.
С другой стороны, вода с низким pH может вызывать коррозию металлических труб и извлекать ионы металлов в воду, что делает ее вредной для питья или использования в домашних условиях.
В большинстве случаев вода, которую поставщики намереваются использовать или пить, будет ближе к нейтральной точке 7, хотя она все еще может немного отличаться.Агентство по охране окружающей среды (EPA) рекомендует поддерживать pH в пределах от 6,5 до 8,5 в питьевой воде, и многие штаты в США предпочитают устанавливать эти уровни.
Питьевая вода и другие напитки на водной основе с различным уровнем pH могут влиять на несколько различных факторов здоровья.
Щелочная вода и другие щелочные продукты приобрели популярность в последние годы, став новой тенденцией в области здравоохранения. По словам сторонников щелочных напитков, кислая среда в организме вызывает несколько хронических заболеваний, которые, по их утверждениям, не могут сохраняться в щелочной среде.
Идея заключается в том, что употребление щелочной воды помогает организму стать более щелочным, что излечивает ряд заболеваний, включая рак.
Однако существует мало доказательств, подтверждающих эти утверждения. Хотя употребление щелочной воды может временно повлиять на pH рта или мочи, нет никаких научных доказательств того, что это изменит общий pH тела.
Организм строго регулирует уровень pH. Изменения внутреннего pH организма, например pH крови, могут означать серьезные проблемы в органах и тканях.Итак, если бы можно было изменить pH тела с помощью еды и питья, это было бы опасно.
Однако щелочная вода может быть полезна некоторым людям. В общем, щелочная вода имеет тенденцию быть более щелочной, потому что в ней есть минералы и электролиты. По этой причине употребление этой воды после тренировки или во время болезни может помочь сохранить баланс минералов и электролитов и предотвратить обезвоживание.
Кроме того, результаты небольшого исследования показывают, что людям с кислотным рефлюксом может быть полезно пить щелочную воду с pH 8.8. Исследователи обнаружили, что щелочная вода, по-видимому, навсегда деактивирует фермент, который играет роль в изжоге, что может уменьшить симптомы.
Исследователи также обнаружили, что питьевая вода с pH 8,5–10 может быть полезной для людей с синдромом раздраженного кишечника (СРК), основным симптомом которого является диарея. Люди, которые пили воду с pH 8,5–10, имели более высокие оценки качества жизни по самооценке через 8 недель, чем те, кто этого не делал.
Однако это небольшие исследования, и необходимы дополнительные исследования на людях, чтобы подтвердить эти первоначальные результаты.
Узнайте больше о потенциальной пользе щелочной воды для здоровья здесь.
В лабораториях обычно используются электронные pH-метры для точного измерения pH. Однако можно получить приблизительную оценку pH с помощью лакмусовой бумаги. Лакмусовая бумага широко доступна в Интернете и в некоторых магазинах, таких как магазины здорового питания и зоомагазины.
Лакмусовая бумага — это чувствительная полоска бумаги, меняющая цвет при контакте с жидкостями на водной основе. Изменение цвета может дать приблизительную оценку pH жидкости.Однако следует иметь в виду, что это приблизительные оценки и что фактический pH жидкости все еще может отличаться от того, что указано на лакмусовой бумажке.
Здесь можно купить лакмусовую бумажку.
pH жидкости будет меняться в зависимости от ингредиентов внутри. В результате возможны колебания даже в двух очень похожих продуктах, например, в двух типах воды.
Вот несколько общих диапазонов pH для различных напитков:
pH воды для питья или домашнего использования очень важен.Слишком щелочная или слишком кислая вода может повредить трубы и приборы, и, как правило, пить ее вредно.
Вода обычно колеблется от 6,5 до 8,5 по шкале pH, и это нормально. Вода, выходящая за пределы этого диапазона, может быть небезопасной для питья.
Некоторым людям может быть полезно пить щелочную воду с pH выше 8,5. К таким людям относятся люди с нарушениями пищеварения, такими как СРК. Тем не менее, прежде чем эксперты смогут сделать какие-либо общие выводы о возможных преимуществах щелочной воды, потребуются более масштабные и качественные исследования, подтверждающие эти утверждения.
.pH и вода
• Школа наук о воде HOME • Темы о свойствах воды • Темы о качестве воды •
pH и вода
Нет, вы не часто слышите, как местный новостной телеканал говорит: «Ребята, сегодняшнее значение pH Dryville Creek составляет 6,3!» Но pH — довольно важный показатель воды. Может быть, для научного проекта в школе вы взяли pH воды в образцах на уроке химии … а здесь, в Геологической службе США, мы измеряем pH всякий раз, когда изучается вода.Мало того, что pH ручья влияет на организмы, живущие в воде, изменение pH в ручье может быть индикатором увеличения загрязнения или какого-либо другого фактора окружающей среды.
pH: единицы определения и измерения
Кстати ….. для того, чтобы раствор имел pH, он должен быть водным (содержать воду). Таким образом, у вас не может быть pH растительного масла или алкоголя.
pH — это показатель кислотности / щелочности воды. Диапазон составляет от 0 до 14, где 7 нейтрально.pH менее 7 указывает на кислотность, тогда как pH более 7 указывает на основание. pH на самом деле является мерой относительного количества свободных ионов водорода и гидроксила в воде. Вода с большим количеством свободных ионов водорода является кислой, тогда как вода с большим количеством свободных гидроксильных ионов является основной. Поскольку на pH могут влиять химические вещества в воде, pH является важным показателем химического изменения воды. pH указывается в «логарифмических единицах». Каждое число означает 10-кратное изменение кислотности / щелочности воды.Вода с рН пять в десять раз более кислая, чем вода с рН шесть.
Важность pH
pH воды определяет растворимость (количество, которое может быть растворено в воде) и биологическую доступность (количество, которое может быть использовано водными организмами) химических компонентов, таких как питательные вещества (фосфор, азот и углерод) и тяжелые металлы (свинец , медь, кадмий и др.). Например, помимо влияния на то, сколько и какая форма фосфора наиболее распространена в воде, pH также определяет, могут ли водные организмы использовать его.В случае тяжелых металлов степень их растворимости определяет их токсичность. Металлы имеют тенденцию быть более токсичными при более низком pH, потому что они более растворимы. (Источник: Путеводитель для гражданина по пониманию и мониторингу озер и ручьев)
Диаграмма pH
Как показано на этой диаграмме, pH находится в диапазоне от 0 до 14, где 7 является нейтральным. pH меньше 7 является кислым, а pH больше 7 — щелочным (основным). Нормальные дожди имеют pH около 5,6 — слабокислые из-за углекислого газа из атмосферы .Вы можете видеть, что кислотный дождь может быть очень кислым и может негативно повлиять на окружающую среду.

Шкала pH варьируется от 0 до 14, где 7 — нейтральный. pH меньше 7 является кислым, а pH больше 7 — щелочным (основным).
Кредит: robin_ph / stock.adobe.com
Измерение pH
Геологическая служба США ежегодно анализирует сотни тысяч проб воды. Многие измерения проводятся прямо в полевых условиях, и еще больше — на пробах воды в лаборатории.pH — важное измерение воды, которое часто измеряется как на месте отбора проб, так и в лаборатории. Есть большие и маленькие модели pH-метров. Доступны портативные модели, которые можно взять с собой в поле, а более крупные модели, такие как эта, используются в лаборатории.
Для использования pH-метра на фотографии ниже образец воды помещается в чашку, а стеклянный зонд на конце выдвижного рычага помещается в воду. Внутри тонкой стеклянной колбы на конце зонда есть два электрода, измеряющих напряжение.Один электрод содержится в жидкости с фиксированной кислотностью или pH. Другой электрод реагирует на кислотность пробы воды. Вольтметр в зонде измеряет разницу между напряжениями двух электродов. Затем измеритель переводит разницу напряжений в pH и отображает ее на маленьком экране основного блока.

Портативный электронный pH-метр.
Перед измерением pH измеритель должен быть «откалиброван». Зонд погружают в раствор с известным pH, например чистую воду с нейтральным pH 7.0. Ручки на коробке используются для регулировки отображаемого значения pH до известного значения pH раствора, таким образом калибруя прибор.
Измерение pH дома или в школе
Один из самых популярных школьных научных проектов — это измерение pH воды из разных источников. Скорее всего, в вашей школе (и, конечно, не у вас) нет электронного pH-метра, но вы все равно можете получить оценку pH с помощью лакмусовой бумаги. Лакмусовая бумага, которую можно найти в магазинах зоотоваров (для проверки pH в аквариумах), представляет собой просто полоску бумаги, которая при падении на нее пробы воды приобретает определенный цвет, что дает приблизительную оценку pH.
pH и качество воды
Чрезмерно высокие и низкие значения pH могут отрицательно сказаться на использовании воды. Высокий pH вызывает горький вкус, водопроводные трубы и водопроводные приборы покрываются отложениями , что снижает эффективность дезинфекции хлора, вызывая потребность в дополнительном хлоре при высоком pH. Вода с низким pH разъедает или растворяет металлы и другие вещества.
Загрязнение может изменить pH воды, что, в свою очередь, может нанести вред животным и растениям, живущим в воде.Например, вода , выходящая из заброшенной угольной шахты , может иметь pH 2, который очень кислый и определенно повлияет на любую рыбу, достаточно сумасшедшую, чтобы попытаться жить в ней! Если использовать логарифм, то эта шахтная дренажная вода будет в 100 000 раз более кислой, чем нейтральная вода, поэтому держитесь подальше от заброшенных шахт .
Изменение pH в США
Уровень pH осадков и водоемов сильно различается по территории Соединенных Штатов.Естественные и человеческие процессы определяют pH воды. Национальная программа атмосферных отложений разработала карты, показывающие модели pH, такие как приведенная ниже, показывающая пространственную картину pH осадков на полевых участках за 2002 год. Вы должны знать, что эта контурная карта была разработана с использованием измерений pH при конкретном отборе проб. местах; таким образом, изолинии и изолинии были созданы с использованием интерполяции между точками данных. Вам не обязательно использовать карту для документирования pH в других конкретных точках карты, а, скорее, использовать карту как общий индикатор pH по всей стране.

Примечание. На этой карте показан один момент времени, и с 2002 года наблюдается общее сокращение количества факторов, вызывающих кислотные дожди. Более новая карта может сильно отличаться от этой. Тем не менее, более низкие значения pH осадков по-прежнему будут наблюдаться на северо-востоке США
..Что измеряет pH? | Измерение pH
Измерение pH является важным параметром почти во всех областях, связанных с качеством воды. При очистке сточных вод pH регулируется как часть разрешения сброса, и многие процессы очистки зависят от pH. При отборе проб и мониторинге окружающей среды высокие или низкие значения pH могут указывать на загрязнение.
Уровень pH важен в пищевой промышленности, так как он играет роль во вкусе (кислый = свежий, нейтральный = мягкий, щелочной = несъедобный) и сохранности продуктов.В биотехнологии необходимо тщательно контролировать pH во время производства растворов для иммуноанализа. Это лишь некоторые из множества приложений, в которых pH является важным измерением.
Образование иона водорода
pH описывает кислотность или щелочность раствора. Реагирует ли водный раствор как кислота или основание, зависит от содержания в нем ионов водорода (H + ). Фактически, термин «pH» происходит от латинского и является аббревиатурой от «Potentia Hydrogenii» — мощности водорода.
Даже химически чистая нейтральная вода содержит ионы водорода из-за самодиссоциации воды [1]. В этом процессе молекулы воды распадаются на более простые составляющие (то есть ионы).
[1] H 2 O ⇔ H + + OH —
В этой реакции H 2 O депротонируется (т.е. теряет протон). Это приводит к образованию положительно заряженного иона водорода (H + ) и отрицательно заряженного гидроксид-иона (OH — ).Ион водорода обычно используется для обозначения протона.
Ион водорода недолго остается свободным протоном, так как он быстро гидратируется окружающей неионизированной молекулой воды. Образование образующегося иона, иона гидроксония, представлено в уравнении [2]:
[2] H 2 O + H + ⇔ H 3 O +
Диссоциация воды и образование иона гидроксония.
В условиях равновесия (750 мм рт. Ст. И 25 ° C) 1 л чистой нейтральной воды содержит 10 -7 моль H + и 10 -7 моль OH — ионов.
Определение кислоты и основания
Кислоты — это вещества, выделяющие ионы водорода (т.е. протоны), поэтому раствор считается кислым, если он содержит больше ионов водорода, чем нейтральная вода.
Основания — это вещества, которые принимают ионы водорода. Когда основания растворяются в воде, они связываются с некоторыми ионами водорода, образующимися при диссоциации воды. Основные растворы содержат меньше ионов водорода, чем нейтральная вода.
Водные растворы считаются кислыми, если они содержат более 10 -7 моль / л ионов водорода, и основными, если они содержат менее 10 -7 моль / л ионов водорода при 25 ° C.
Кислоты и основания нейтрализуют друг друга, в результате чего образуется вода и соль. Примером может служить реакция гидроксида натрия (NaOH) и соляной кислоты (HCl) в уравнении [3] ниже:
[3] NaOH + HCl ⇔ NaCl + H 2 O
Реакция между кислотой и основанием включает перенос протонов. В указанной выше кислотно-основной реакции протон от HCl (кислота) передается в NaOH (основание) с образованием хлорида натрия (NaCl) и воды.
Натрия хлорид в виде морской соли.
Является ли pH измерением концентрации иона водорода или активности ионов водорода?
Ионы несут либо положительный (например, H + ), либо отрицательный (например, OH — ) заряд. В качестве носителей заряда все растворенные ионы оказывают электрические силы на свое окружение. В то время как раствор может быть электрически нейтральным в макроскопическом масштабе, влияние ионов может быть значительным в микроскопическом масштабе.
Растворы с относительно высокой концентрацией ионов могут давать необычно низкую концентрацию ионов.Таким образом, растворы начинают вести себя так, как будто некоторых ионов больше нет. Эта кажущаяся потеря ионов вызвана взаимодействием ионов в растворе, что в конечном итоге приводит к значительным отклонениям от идеального поведения. Чтобы учесть это взаимодействие, необходимо учитывать активность ионов, также известную как эффективная концентрация ионов, а не концентрация ионов. Таким образом, pH является мерой активности ионов водорода.
[Прочтите сообщение в блоге: pH — это измерение концентрации или ионной активности водорода?]
Почему шкала pH логарифмическая?
Шкала pH обычно используется для представления активности ионов водорода.На шкале pH значения pH ниже 7 представляют собой кислые растворы (активность ионов водорода выше активности гидроксид-иона), а значения выше 7 представляют собой щелочные растворы. При pH = 7 активность иона водорода и гидроксид-иона равны.
Как видно из таблицы 1, возможный диапазон активности ионов водорода (H + ) и гидроксида (OH — ) может охватывать многие порядки величины. Для того, чтобы легко управлять и отображать широкий диапазон активности ионов, используется логарифмическая шкала pH.
Активность иона водорода и гидроксид-иона по шкале pH.
Изменение шкалы pH на 1,0 единицы pH указывает на то, что активность ионов водорода отличается на порядок величины (то есть в 10 раз). Например, активность водородных ионов при pH 4 в 10 раз больше, чем при pH 5.
Из-за логарифмической природы шкалы pH некорректно просто усреднять значения pH и сообщать их. Вместо этого более уместно указать среднее значение pH или диапазон наблюдаемых значений pH.
Уравнение [4] представляет собой определение pH по отрицательному логарифмическому основанию 10 активности ионов водорода.
[4] pH = -lg a H +
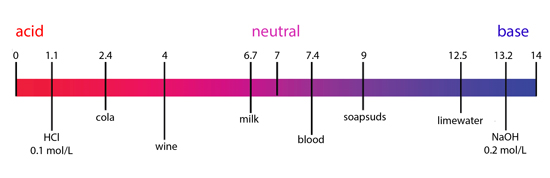 Значения pH предметов повседневного обихода.
Значения pH предметов повседневного обихода.[Прочтите сообщение в блоге: Почему логарифмическая шкала pH?]
Методы измерения pH — pH-метр и pH-полоски
Для измерения активности ионов водорода в растворе можно использовать визуальные, фотометрические и потенциометрические методы. Визуальные и фотометрические методы основываются на изменении цвета определенных органических пигментов для определения pH.Визуальные методы дополняются визуальными индикаторами, такими как тест-полоски pH, в то время как фотометрическое определение включает в себя пропускание света через образец и измерение оптической плотности.
Применение визуального или фотометрического определения pH ограничено. Измерения будут ненадежными, если измеряемый раствор мутный или имеет естественный цвет. Некоторые измерительные растворы также содержат химические связи, которые разрушают цветные индикаторы в результате окисления или восстановления и приводят к неверным результатам.
 Хотя тест-полоски pH могут быть полезны, они не так надежны, как pH-электрод.
Хотя тест-полоски pH могут быть полезны, они не так надежны, как pH-электрод.Потенциометрические методы определяют pH с помощью электрического потенциала pH-чувствительных электродов в качестве сигнала измерения, который затем отображается на pH-метре. Недостатки визуальных и фотометрических методов отсутствуют у потенциометрических методов, поскольку потенциометрические датчики очень чувствительны, селективны и могут использоваться практически в любом приложении.
Как работает pH-электрод?
Различают водород, металл (напр.грамм. сурьма) и стеклянные потенциометрические электроды, причем стеклянный pH-электрод является наиболее часто используемым датчиком pH. Более подробную информацию о водородных и металлических электродах можно найти в справочнике YSI pH!

Стеклянный датчик pH является примером i на s факультативном лектроде e (ISE). Эта система состоит из ИСЭ, реагирующего на особый тип иона, в данном случае на ион водорода, и электрода сравнения, которые вместе погружаются в образец, подлежащий измерению.
pH-электрод технически представляет собой селективный электрод для ионов водорода (ISE). Единственное существенное различие между pH-электродом и нитратным ISE — это используемая мембрана.
ИСЭ водорода обеспечивает электрохимический потенциал (например, сигнал), на который влияет активность ионов водорода в растворе. Однако электрод сравнения поддерживает электрохимический потенциал, который не зависит от состава образца. Разница между этими потенциалами, напряжение (мВ), отображаемое на pH-метре, определяет значение pH на основе уравнения Нернста.
Важность уравнения Нернста
Уравнение Нернста устанавливает зависимость между измеренным напряжением и ионной активностью раствора. Наклон электрода при изменении одной единицы pH может быть описан частью уравнения Нернста, называемым наклоном Нернста (S).
[5] S = -2,303 RT / нФ
Переменные R и F являются константами и поэтому не представляют дальнейшего интереса. Поскольку наклон электрода (т.е. отклик электрода) зависит от температуры (T) раствора, очень важно, чтобы измерения pH завершались точным измерением температуры.Теоретический наклон Нернста при температуре 25 o C составляет -59,16 мВ. Переменная n означает заряд иона, который равен +1 для иона водорода (H + ).

Конструкция pH-электрода
Основными компонентами стеклянного pH-электрода являются корпус электрода, pH-чувствительная стеклянная мембрана, электрод сравнения (то есть система сравнения), электролит сравнения и спай сравнения.
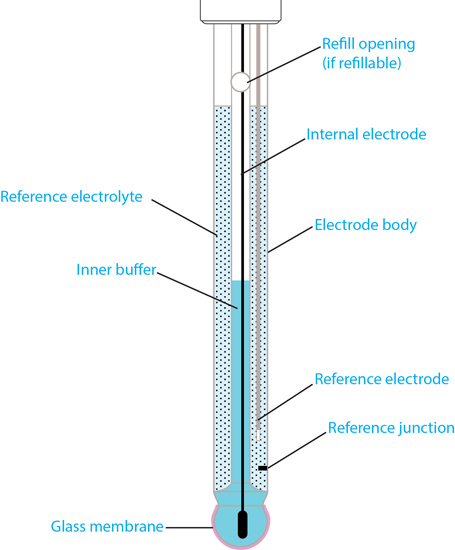 Структура типичного комбинированного pH-электрода со стеклянным корпусом.
Структура типичного комбинированного pH-электрода со стеклянным корпусом.Корпус pH-электрода
Термин «стеклянный электрод» не указывает на материал, из которого изготовлен корпус электрода, поскольку электроды могут иметь корпус из пластика или стекла. Скорее, «стеклянный электрод» используется для описания материала мембраны (то есть стеклянной мембраны).
Электроды с пластмассовым корпусом более прочны и менее подвержены растрескиванию, чем стеклянные, в то время как стеклянные электроды обычно имеют больший диапазон рабочих температур. Стеклянные электроды также часто пополняются.
 Ручной прибор YSI ProDSS оснащен сменными пластиковыми модулями измерения pH и pH / ОВП, но остальная часть корпуса датчика сделана из титана для обеспечения дополнительной защиты в полевых условиях.
Ручной прибор YSI ProDSS оснащен сменными пластиковыми модулями измерения pH и pH / ОВП, но остальная часть корпуса датчика сделана из титана для обеспечения дополнительной защиты в полевых условиях.Стеклянная мембрана pH
Стеклянный pH-электрод представляет собой стеклянную мембрану, которая используется как датчик pH. Эта мембрана заполнена буферным раствором с известным pH (обычно pH = 7). Такая конструкция электрода создает среду с постоянным связыванием ионов H + на внутренней стороне стеклянной мембраны, в то время как внешняя часть стеклянной мембраны подвергается воздействию образца, где существует различное количество ионов H + .Разница в ионах H + создает потенциал, который считывается по сравнению со стабильным потенциалом электрода сравнения.
Для обеспечения оптимального увлажнения стеклянной мембраны форма мембраны может варьироваться. Мембраны сферической и конической формы могут использоваться для большинства применений, но для уникальных применений может потребоваться специализированная мембрана, такая как мембрана с наконечником для проникновения в полутвердые среды и плоская мембрана для измерения поверхности.
YSI TruLine 21 (мембрана с наконечником наконечника) и YSI TruLine 27 (плоская мембрана).
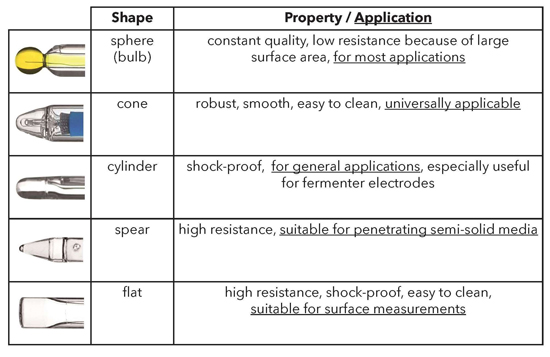 Формы и свойства стеклянных pH-мембран.
Формы и свойства стеклянных pH-мембран.Типы электродов сравнения
Электрод / система сравнения и водородный ИСЭ (т.е. электрод со стеклянной мембраной) могут быть отдельными электродами или для удобства их можно объединить в один электрод. Комбинированный электрод очень распространен.
Независимо от конструкции электрода или типа используемой системы сравнения электрод сравнения погружается в электролит сравнения (обычно KCl).
В настоящее время наиболее распространенным типом электрода сравнения является система серебро / хлорид серебра (Ag / AgCl). Поскольку серебро не токсично для человека, электроды Ag / AgCl также могут использоваться в медицине и пищевой промышленности, где использование ядовитых систем ртути и таллия запрещено. Утилизация также менее важна для Ag / AgCl, чем для таллия и ртути. Ag / AgCl имеет широкий диапазон применения в зависимости от температуры (до 140 ° C) и поэтому также подходит для стерилизуемых электродов.Большинство электродов оснащены системой сравнения Ag / AgCl.
Система йод / йодид, относительно новая эталонная система с быстрым временем отклика, была разработана недавно. По сравнению с обычными электродами с системами сравнения Ag / AgCl, электроды с системами сравнения с йодом / йодидом обладают преимуществом гораздо более низкой температурной чувствительности, поскольку температурный коэффициент этой системы сравнения практически равен нулю.
Система йод / йодид также не содержит ионов металлов, что особенно полезно при измерениях в трис-буфере и растворах белка.Системы сравнения с ионами металлов (например, Ag / AgCl) будут взаимодействовать с этими растворами, что в конечном итоге приведет к засорению контрольного спая.
[Прочитать сообщение в блоге: Анатомия pH-электродов]
 PH-электрод YSI IoLine оснащен системой сравнения йода / йодида.
PH-электрод YSI IoLine оснащен системой сравнения йода / йодида.Функция и качество эталонного электролита
Электролит сравнения связан с образцом через переход, поскольку он служит для замыкания электрической цепи в электроде.
Хороший электролит сравнения должен обладать определенными качествами. Эталонный электролит должен иметь хорошую электропроводность и быть химически нейтральным. Поскольку некоторое количество электролита обычно просачивается в образец во время измерения, также важно, чтобы электролит не вступал в реакцию с измерительным раствором.
Ионы раствора электролита также должны быть одинаково подвижными. Если ионы в растворе электролита диффундируют с разной скоростью, может образоваться электрический потенциал (, диффузионный потенциал ) из-за разделения между положительным и отрицательным зарядом.Этот нежелательный потенциал может быть проблематичным при измерении pH. Для некоторых ионов (например, K + и Cl —) различия в скорости диффузии невелики, что приводит к гораздо меньшему диффузионному потенциалу.
Хлорид калия (KCl) обладает всеми этими качествами. В результате KCl является наиболее часто используемым раствором электролита.
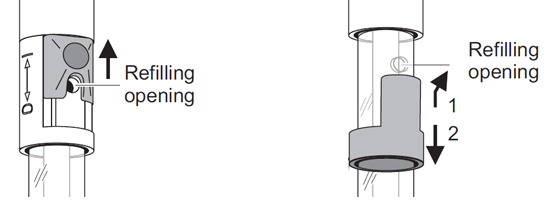
Электролит жидкий, гелевый и полимерный
Электроды могут иметь гелевый, полимерный или жидкий электролит. pH-электроды с жидким электролитом обычно можно пополнять, что продлевает срок службы электрода.В отличие от электрода с гелевым электролитом, жидкий электролит можно легко слить и заменить в случае загрязнения.
При использовании перезаправляемого электрода (например, TruLine pH 15) важно помнить: Заливное отверстие всегда должно быть открыто во время калибровки и измерения! Также убедитесь, что уровень заполнения электролита выше уровня калибровочного и / или измерительного раствора как минимум на 2 см.
 Отверстие для заправки на многоразовых лабораторных электродах должно быть всегда открыто при измерении или калибровке.
Отверстие для заправки на многоразовых лабораторных электродах должно быть всегда открыто при измерении или калибровке.Время отклика обычно меньше с перезаправляемыми электродами. Кроме того, электроды с жидким электролитом имеют меньше ограничений в области применения, поскольку гелевые и полимерные электролиты имеют меньшую устойчивость к температуре и температурным изменениям. В отличие от электродов с жидким электролитом, невероятно малая скорость истечения геля и полимерного электролита в сильно кислых, основных растворах и растворах с низкой ионной силой может привести к ошибкам измерения из-за образования диффузионных потенциалов.
Иногда можно использовать другой электролит, который отвечает требованиям при отборе проб.Например, если требуется электролит, который полностью не содержит хлоридов (то есть не KCl), с YSI IoLine можно использовать другой мостиковый электролит, например 0,6 М сульфат калия (K 2 SO 4 ).
Гелевый электролит по-прежнему состоит из KCl, но добавляется гелеобразующий агент, чтобы предотвратить легкую утечку электролита в образец через контрольный спай во время измерения. Поскольку потери электролита практически отсутствуют, эти электроды проще обслуживать, поскольку нет необходимости повторно заполнять их электролитом.Поскольку их нельзя повторно заправлять, электроды с гелевым электролитом имеют меньший срок службы, чем электроды с жидким электролитом.
 Электрод YSI TruLine pH 25 имеет гелевый электролит и пластиковый корпус.
Электрод YSI TruLine pH 25 имеет гелевый электролит и пластиковый корпус.Полимерный электролит твердый и может напрямую контактировать с образцом во время измерения. Из-за отсутствия оттока электролита подвижность всех ионов сильно ограничена. Это приводит к отсутствию осаждения серебра на стыке и делает диффузию посторонних ионов в электрод практически невозможной.
pH контрольный спай
Эталонный спай, также известный как диафрагма, создает электрический контакт между эталонной системой и раствором. Как и эталонный электролит, эталонный спай должен обладать определенными качествами.
Диффузионные напряжения на переходе — обычная ошибка измерения, поэтому переход играет важную роль в точности измерений. Чтобы эти разрушающие потенциалы были небольшими, переход должен гарантировать относительно большой и постоянный отток эталонного электролита.Однако соединение должно быть только слегка проницаемым, чтобы предотвратить слишком быстрое вытекание электролита, что особенно важно для электродов, в которых используется жидкий электролит. Разные типы переходов имеют разную скорость истечения электролита.
Помимо проницаемости перехода, его электрическое сопротивление должно быть как можно более низким, и он должен быть химически инертным.
Типы ссылочных соединений
Существует несколько типов соединений, каждый из которых обладает уникальными характеристиками.
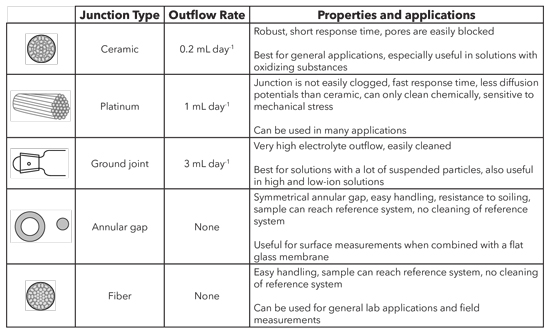 Типы узловых точек.
Типы узловых точек.керамика
Керамический спай использует пористость неглазурованной керамики. Керамические переходы имеют скорость истечения KCl ~ 0,2 мл / день и относительно высокое электрическое сопротивление (1 кОм). Потенциалы диффузии легко создаются в измерительных растворах с большей ионной силой, так как градиент концентрации на стыке очень велик. В растворах с более низкой ионной силой сопротивление исследуемого материала может быть слишком высоким для точных измерений.Оба эффекта усиливаются из-за низкой скорости истечения, поэтому керамические переходы в таких случаях не подходят. Из-за высокого риска закупорки пор он также не подходит для растворов, содержащих взвешенные частицы.
Платина
Платиновый переход состоит из тонких скрученных платиновых нитей, между которыми течет электролит по точно определенным каналам. Платиновый переход имеет очень постоянный отток, и его нелегко заблокировать.При скорости истечения ~ 1 мл / сутки и электрическом сопротивлении ~ 0,5 кОм он имеет преимущества перед керамическими переходами. Платиновый переход более чувствителен к механическому воздействию, а также не является оптимальным для сильно окисляющих или восстанавливающих растворов из-за возникновения разрушающих потенциалов. Однако платиновый переход можно использовать практически повсеместно.
 Электрод YSI TruLine pH 17 имеет платиновый переход.
Электрод YSI TruLine pH 17 имеет платиновый переход.Заземление
Соединение заземления работает с тонким зазором матового стекла без смазки как выходное отверстие для электролита.Скорость оттока ~ 3 мл / сут и больше. Он имеет очень низкое электрическое сопротивление (0,1 кОм). Разъем заземления подходит для измерений в загрязненных растворах, так как его легко чистить. Благодаря высокой скорости истечения он подходит как для растворов с высоким, так и с низким содержанием ионов. Science pHT-G — это то, что мы обычно рекомендуем, когда в пробе много взвешенных частиц.
 Электрод YSI Science pHT-G имеет функцию заземления с быстрым оттоком электролита.Такая скорость истечения сохраняет соединение в чистоте и обеспечивает быстрые результаты измерения.
Электрод YSI Science pHT-G имеет функцию заземления с быстрым оттоком электролита.Такая скорость истечения сохраняет соединение в чистоте и обеспечивает быстрые результаты измерения.Дополнительные ссылочные соединения
Дополнительные переходы могут использоваться для предотвращения загрязнения системы сравнения. В этой конструкции электрод сравнения погружен в раствор электролита в дополнительной камере. Эта дополнительная камера действует как дополнительный барьер против загрязнения, в то время как дополнительные переходы используются для обеспечения контакта системы сравнения с измерительным раствором.Контрольная система все еще может быть загрязнена измерительным раствором, но раствор должен сначала диффундировать через дополнительный (е) переход (и).
[Прочтите сообщение в блоге: Анатомия pH-электродов, чтобы узнать больше о ссылочных соединениях]
Выбор правого электрода
В настоящее время не существует pH-электрода, который можно было бы использовать для всех возможных применений, поскольку для разных приложений существуют разные требования.
Есть много разных приложений, особенно в лаборатории! Для уникальных приложений может потребоваться особый материал вала, система сравнения, тип перехода, количество соединений, электролит сравнения и / или форма мембраны.В связи с широким ассортиментом лабораторных pH-электродов мы рекомендуем вам ознакомиться с Руководством по выбору pH-электродов YSI и Руководством по применению pH-электродов YSI при поиске следующего лабораторного электрода!Задать вопрос
Важность температуры
Переменной в уравнении Нернста является температура, поэтому отклик (т. Е. Крутизна) pH-электрода зависит от температуры. Следовательно, измерения pH должны дополняться точным измерением температуры.
Значения pH буферных растворов зависят от температуры, и реакция может варьироваться от производителя к производителю.Как правило, основные буферные растворы проявляют более сильное температурное воздействие, чем кислотные. Современные pH-метры автоматически подстраиваются под соответствующий температурный профиль после того, как используемый буферный набор установлен правильно.
 YSI всегда рекомендует иметь точное измерение температуры при измерении pH. Некоторые pH-электроды имеют встроенный датчик температуры, но также доступны внешние датчики температуры (например, ScienceLine Temp 135 и ScienceLine Temp 136), если pH-электрод не имеет встроенного датчика температуры.
YSI всегда рекомендует иметь точное измерение температуры при измерении pH. Некоторые pH-электроды имеют встроенный датчик температуры, но также доступны внешние датчики температуры (например, ScienceLine Temp 135 и ScienceLine Temp 136), если pH-электрод не имеет встроенного датчика температуры.Буферные растворы pH
Буферы — это водные растворы, pH которых практически не изменяется при добавлении небольших количеств кислот или оснований. Буферные растворы способны связывать ионы водорода при добавлении кислот и выделять ионы водорода при добавлении оснований.
Буферные растворы часто окрашивают, чтобы четко отличать их друг от друга во время калибровки.
Состав буферных растворов варьируется в зависимости от производителя.При выборе набора буферов необходимо убедиться, что они изготовлены в соответствии с формулой, установленной Национальным институтом стандартов и технологий (NIST). Эти буферы имеют значения pH 4,01, 6,86 и 9,18. В качестве альтернативы, прослеживаемые буферы NIST также достаточны для использования при калибровке. Буферы YSI отслеживаются NIST и предлагаются со значениями pH 4, 7 и 10.
Ознакомьтесь с практическими советами по калибровке в Руководстве по калибровке pH-электрода YSI!
Что делает калибровка?
Калибровка pHвыполняет две задачи: 1.) установить новый наклон электрода на основе ранее обсужденного уравнения Нернста и 2.) установить нулевую точку. Поскольку оба эти параметра могут изменяться со временем, необходима частая калибровка.
Нулевая точка, также известная как потенциал / точка асимметрии, обычно представляет собой значение в мВ, когда электрод помещен в буфер с pH 7. Неудивительно, что теоретическая нулевая точка составляет 0 мВ. Это верно, потому что электрод сравнения обычно находится в растворе электролита с pH 7. Если электрод сравнения и чувствительный электрод находятся в растворе с одинаковым pH, теоретически не должно быть разницы в их потенциалах, в результате на pH-метре отображается 0 мВ.Новый электрод будет иметь потенциал асимметрии, который обычно составляет всего несколько мВ, если он был тщательно подготовлен.
Нулевая точка полезна при определении рабочего состояния электрода. Если точка асимметрии начинает отклоняться слишком далеко от нуля, возможно, электрод необходимо очистить, отремонтировать или заменить. Точка асимметрии будет меняться с возрастом электрода, поэтому рекомендуется регулярная калибровка, которая будет требоваться все чаще по мере старения электрода, чтобы компенсировать эти изменения.
Как часто следует калибровать?
Пожалуй, самый частый вопрос относительно калибровки — как часто ее следует выполнять. Частота последующих калибровок зависит от области применения. Некоторые приложения требуют ежедневной калибровки, в то время как другие могут требовать только еженедельной или ежемесячной калибровки. Если возможно, лучше всего проводить калибровку в начале каждого дня.
[Прочтите сообщение в блоге: Проблемы с калибровкой измерения pH? Ознакомьтесь с этими 12 советами]
При измерениях в сильно загрязненных или с низким содержанием ионов пробах необходима более частая калибровка.pH-электроды, используемые в сильно кислой и высокотемпературной среде, также необходимо калибровать чаще, поскольку эти электроды будут стареть намного быстрее, что приведет к более медленному отклику, изменению наклона электрода и дрейфу нулевой точки.
Сколько точек калибровки мне следует использовать?
Количество точек калибровки — общая тема для обсуждения. Большинство лабораторных и полевых приборов допускают калибровку до 3 буферов.
Калибровка может быть завершена после одного буфера, что приведет к завершению одноточечной калибровки.Нулевая точка определяется во время одноточечной калибровки, в то время как используемый наклон электрода представляет собой теоретический наклон по Нернсту (-59,16 мВ / pH при 25 ° C). Следует отметить, что одноточечная калибровка должна выполняться с использованием буфера pH 7.
Диапазон использования одноточечной калибровки ограничен, так как электрод, калиброванный по одной точке (т.е. pH 7), следует использовать только для измерения в диапазоне от 6,5 до 7,5 pH. Полученное значение pH можно использовать для сравнения с ранее полученными результатами измерений, но это не абсолютное значение.
Лучше всего выполнить по крайней мере двухточечную калибровку, используя буфер pH 7 в качестве одной из этих точек (6,86 для набора буферов NIST). Хотя это не требуется для многих инструментов, лучше всего начать с буфера с pH 7. Для двухточечной калибровки используемые буферы pH должны отличаться как минимум на две единицы pH и должны соответствовать ожидаемым условиям pH in situ. Если не ожидается, что образец будет иметь pH выше 7, основные буферы не следует использовать, поскольку их значение pH изменяется из-за поглощения CO 2 .
Трехточечная калибровка обычно завершается, когда условия pH образца не совсем понятны. Асимметрия и наклон определяются как для двух, так и для трехточечной калибровки.
Что такое КПД электрода?
После калибровки pH-метры обычно отображают крутизну электрода в мВ / pH (т. Е. Крутизну Нернста), в процентах или в обоих значениях. Нас часто спрашивают, что на самом деле означает этот процент, называемый КПД электрода.
Эффективность электрода — это просто процент от теоретической крутизны Нернста (-59.16 мВ / pH).
[6] Эффективность электрода = (наблюдаемый наклон / теоретический наклон) * 100
В качестве примера, если во время калибровки наклон был определен как -57,10 мВ / pH, эффективность будет 96,52%.
Хотите узнать больше о pH? Ознакомьтесь со следующими ресурсами!

Полезные ссылки — справочники и руководства
Справочник по pH YSI
Руководство по выбору лабораторных pH-электродов
Руководство по применению лабораторного pH-электрода
Руководство по калибровке лабораторных и полевых pH-электродов
