Морская вода — Википедия
 Стандартная морская вода
Стандартная морская водаМорска́я вода́ — вода морей и океанов. Солёность Мирового океана составляет в среднем 3,47 % (34,7 ‰), с колебаниями от 3,4 до 3,6 % (34-36 ‰). Это значит, что в каждом литре морской воды растворено 35 граммов солей (в основном хлорида натрия). Это 0,6 моль/литр (в предположении, что вся соль представляет собой NaCl, что на самом деле не так)[1].
Солёность[править | править код]
Химический состав морской водыВ океанах солёность воды почти повсеместно близка к 3,5 %, однако в морях вода имеет неравномерно распределённую солёность. Наименее солёной является вода Финского залива и северной части Ботнического залива, входящих в акваторию Балтийского моря. Наиболее солёной является вода Красного моря и восточная часть Средиземного моря. Солёные озёра, такие как Мёртвое море, могут иметь значительно больший уровень содержания солей.
Морская вода слабощелочная, pH варьируется в пределах от 7,5 до 8,4. Относительно высокая стабильность pH связана с наличием карбонатной буферной системы[2][3][4]. Несколько меньшее значение для поддержания pH имеет боратная система[5]. Наиболее высоко значение pH у поверхности моря, с глубиной оно несколько снижается. В опреснённых участках величина pH может снижаться до нейтральной и даже слабокислой[6].
| ||||||||||||||||||||||||||||
|
Биогенные вещества[править | править код]
Биогенные элементы необходимы для живых организмов. К ним относят фосфор, азот (в неорганических соединениях) и (для некоторых организмов) кремний. Важную роль играют металлы, встречающиеся в следовых количествах[8].
Содержание биогенных веществ в морской воде непостоянно, и различается в зависимости от места, глубины и времени взятия пробы. Обычно их содержание минимально у поверхности, возрастает до максимума до глубины 1000—1500 метров, и затем снова плавно снижается. Содержание фосфатов может резко повышаться у дна океана[9].
При апвеллинге вода поднимается к поверхности и приносит туда содержащиеся в ней биогены.
Растворённые газы[править | править код]
Контактируя с атмосферой, морская вода обменивается с воздухом содержащимися в нём газами: кислородом, азотом и углекислым газом. Эти же газы попадают в морскую воду в результате химических и биологических процессов, протекающих в океане. Некоторое количество газов вносится в океан с речной водой.
Количество газов, растворенных в морской воде, зависит от их растворимости и от парциального давления в воздухе. С повышением температуры растворимость газов и, соответственно, содержание их в морской воде уменьшается.
Соотношение растворенного кислорода и азота в морской воде отличается от их соотношения в атмосфере. Из-за лучшей растворимости кислорода концентрация его в воде относительно выше, его соотношение с азотом 1:2
В анаэробных условиях в воде может накапливаться сероводород — например, в Черном море на глубине более 200 метров.
Физические свойства[править | править код]
Плотность морской воды колеблется в пределах от 1020 до 1030 кг/м³ и зависит от температуры и солености. При солености, превышающей 24 ‰, температура максимальной плотности становится ниже температуры замерзания[11] — при охлаждении морская вода всегда сжимается, и плотность её растет[12].
Скорость звука в морской воде — около 1500 м/с.
| Морская вода | Чистая вода | |
| Плотность при 25 °C, г/см3: | 1,02412 | 0,9971 |
| Вязкость при 25 °C, миллипуаз: | 9,02 | 8,90 |
| Давление пара при 20 °C, мм. рт. ст.: | 17,35 | 17,54 |
| Температура максимальной плотности, °C: | -3,52 (переохлаждённая жидкость) | +3,98[1] |
| Точка замерзания, °C: | -1,91 | 0,00 |
| Поверхностное натяжение при 25 °C, дин/см: | 72,74 | 71,97 |
| Скорость звука при 0 °C, м/с: | 1450 | 1407 |
| Удельная теплоёмкость при 7,5 °C, Дж/(г·°C): | 3,898 | 4,182 |
Научное объяснение появлению солёной воды в море было положено работами Эдмунда Галлея в 1715 году. Он предположил, что соль и другие минералы вымывались из почвы и доставлялись в море реками. Достигнув океана, соли оставались и постепенно концентрировались. Галлей заметил, что большинство озёр, не имеющих водной связи с океанами, имеют солёную воду.
Теория Галлея отчасти верна. Вдобавок к ней следует упомянуть, что соединения натрия вымывались из дна океанов на ранних этапах их формирования. Присутствие другого элемента соли, хлора, объясняется его высвобождением (в виде хлороводорода) из недр Земли при извержениях вулканов. Атомы натрия и хлора постепенно стали основными составляющими солевого состава морской воды.
Морская вода непригодна для питья из-за высокого содержания солей и минеральных веществ, для выведения которых из организма требуется воды больше, чем её выпитое количество. Однако после опреснения такую воду можно пить.
В 1950-х годах французский врач и путешественник Ален Бомбар экспериментально доказал, что морскую воду можно без вреда для здоровья пить в небольших (порядка 700 мл/сутки) количествах в течение 5—7 дней[13]. См.также Физиологическая адаптация. Распреснённая морская вода соленостью в 3-4 раза ниже океанической (не более 8—11 промилле) в некоторых заливах, лагунах, эстуариях, куда впадают крупные реки, таких морях, как Азовское, Балтийское, Каспийское, намного менее вредна, чем океаническая, и может понемногу применяться для питья и выживания в чрезвычайных ситуациях. Аналогичное достигается, если разбавить океанскую воду пресной как минимум в соотношении 2:3.
В Гонконге морская вода широко используется в сливных системах туалетов. Более чем 90 % из них используют для смыва именно морскую воду в целях экономии воды пресной. Начало этой практике было положено в 1960-х и 1970-х годах, когда добыча пресной воды стала затруднительна для жителей бывшей британской колонии.
- ↑ 1 2 3 Хорн, 1972, с. 51.
- ↑ Хорн, 1972, с. 160.
- ↑ Zeebe et al, 2001, с. 3.
- ↑ Схема карбонатной системы океана (по R. Zeebe 2001):
CO2atm.⇕CO2+h3O=HCO3−+H+=CO32−+2H+{\displaystyle {\begin{matrix}CO_{2}{\mbox{atm.}}\\\Updownarrow \\CO_{2}+H_{2}O=HCO_{3}^{-}+H^{+}=CO_{3}^{2-}+2H^{+}\end{matrix}}}Б.
Находящаяся в равновесии с атмосферой океанская вода при солёности 35 ‰ и температуре 25 °C имеет pH 8,1. Соотношение форм неорганического растворённого углерода при этом:
CO2:HCO3−:CO32−≈0,5%:86,5%:13%{\displaystyle CO_{2}:HCO_{3}^{-}:CO_{3}^{2-}\approx 0,5\%:86,5\%:13\%} - ↑ Zeebe et al, 2001, с. 8.
- ↑ Хорн, 1972, с. 139.
- ↑ Chapter 5 — Physical and thermodynamic data
- ↑ Grasshoff et al, 1999, с. 159.
- ↑ Grasshoff et al, 1999, с. 160.
- ↑ Смирнов и др., 1988, с. 37.
- ↑ Вейль, 1977, с. 89—90.
- ↑ в отличие от пресной воды, имеющей максимальную плотность при 4 °C.
- ↑ Ален Бомбар. За бортом по своей воле. — М.: Альпина Паблишер, 2014. — 234 с. — ISBN 978-5-9614-4794-1.
- Хорн Р. Морская химия (структура воды и химия гидросферы) = Marine Chemistry (The structure of Water and the Chemistry of Hydrosphere). — Москва: Мир, 1972. — (Науки о земле).
- Руководство по химическому анализу морских вод (РД52.10.243-293) / С. Г. Орадовский. — С.-Пб: «Гидрометеоиздат», 1993. — (Руководящий документ).
- Zeebe R. E., Wolf-Gladrow D. CO2 in Seawater: equilibrum, kinetics, isotopes. — Elsevier Science B.V, 2001. — P. 346. — (Elsevier Oceanography Series). — ISBN 0 444 50579 2.
- Grasshoff K., Kremling K., Ehrhardt M. Methods of seawater analysis. — Third, Completely Revised and Extended Edition. — WILEY-VCH, 1999. — ISBN 3-527-29589-5.
- Смирнов Г.Н., Курлович Е.В., Витрешко И.А., Мальгина И.А. Гидрология и гидротехнические сооружения: Учеб. для вузов по спец. «Водоснабжение и канализация» / под ред. Г.Н. Смирнова. — Высш. шк.. — М., 1988. — 472 с. — 10 000 экз.
- Вейль П. Популярная океанография = Oceanography. An Introduction to the Marine Environment by Peter K. Weyl / Пер. с англ. Г.И. Баранова, В.В. Панова, А.О. Шпайхера. Под ред. А.Ф. Трешникова. — Л.: «Гидрометеоиздат», 1977. — 504 с илл. с. — 50 000 экз.
24 Химический состав воды водоисточников . Влияние хим.Состава воды воды на гомеостаз организма животныхз. Лечение и профилактика заболеваний .
Химический состав воды зависит от источника водоснабжения. В постоянно используемых источниках наблюдается сравнительное постоянство химического состава. Вода в природе никогда не встречается в виде химически чистого соединения. В ней всегда содержится большое количество различных элементов и соединений, состав и соотношение которых зависят от:
условий формирования,
состава водоносных пород,
техногенных факторов,
антропогенных факторов.
При этом образуются биохимические зоны (провинции) и появляются массовые нарушение обмена веществ у животных.
Основная часть сухого остатка пресных вод представлена хлоридами и сульфатами. Воды с большим содержанием солей имеют солоноватый или горьковатый привкус, что служит основанием для ограничения их содержания в воде на уровне порога ощущения: 350 мг/л для хлоридов и 500 мг/л для сульфатов.
Установлено, что вода с повышенной минерализацией влияет на секреторную деятельность желудка, нарушает водно-солевое равновесие, в результате чего наступает рассогласование многих метаболических и биохимических процессов в ор-ганизме.
Реакция животных на минеральный состав воды различна и зависит от их вида, возраста и физиологического состояния, а также количества и состава солей в воде. Менее требовательны к минерализации воды верблюды, затем овцы и козы. Молодые и беременные животные острее реагируют на минеральный состав воды.
При содержании сульфатов (соли серной кислоты) в воде более 750 мг/л и более, она оказывает послабляющее действие у животных возникает диарея. Высокие концентрации сульфатов (1000мг/л) могут вызвать нарушение секреторной деятельности желудка, процессов переваривания и всасывания. Однако некоторые виды сельскохозяйственных животных имеют врожденную толерантность к высокой концентрации сульфатов до 2500 мг/л.
Хлориды в воде могут быть минерального и органического происхождения. Высокая концентрация минеральных хлоридов наблюдается в районах с солончаковыми почвами, они богаты хлористыми соединениями. Минеральные хлориды при концентрации выше 1 % придают воде соленый вкус, при использовании такой воды возможно нарушение электролитического баланса в организме и как следствие простое обезвоживание тканей организма. Органические хлориды, присутствующие в воде свидетельствуют о разложении органических веществ.
Жесткость воды обусловлена суммарным содержанием кальция (Ca(HCO3) и магния Mg (HCO3)2. Кроме них в воде содержатся еще 12 элементов (в том числе бериллий, бор, кадмий, калий, натрий) и другие анионы. Жесткая вода (особенно при резком переходе на ее использование для питьевых целей) вызывает расстройства желудочно-кишечного тракта и даже снижение продуктивности. Как правило, в эндемических зонах, где источники воды (питьевой) характеризуются высокой жесткостью, у животных часто развивается мочекаменная болезнь.
На организм животных отрицательно воздействуют нитриты и нитраты, которые попадают в водоемы с полей (минеральные удобрения). Нитриты и нитраты при взаимодействии с некоторыми аминами образуют нитрозамины, которые могут синтезироваться в природных водоемах, почве, желудочно-кишечном тракте животных. Нитрозамины относят к активным канцерогенам.
В воде обнаружено до 65 микроэлементов, содержащихся в тканях животных и растений в концентрациях, соответствующих тысячным долям процента и менее. Микроэлементы участвуют в минеральном обмене и существенно влияют на общий обмен, выступая в роли катализаторов.
Фтор играет важную роль в образовании костной ткани и особенно зубов. Основной источник обеспечения организма фтором – питьевая вода. При пониженном содержании в ней фтора (ниже 0,5 мг/л) нарушается прочность зубной эмали, при его избыточном содержании (1,0-1,5 мг/л) возникает так называемый флюороз, который характеризуется появлением коричневых пятен на эмали зубов.
При недостатке йода в питьевой воде (ниже 0,5 мг/л) ведет к увеличению щитовидной железы, при этом происходит задержка роста и развития. Для нормального функционирования щитовидной железы необходимое поступление в организм йода 200-300мкг/сут.
В питьевую воду могут попадать токсические вещества (пестициды, инсектициды, дезинфектанты, тяжелые металлы и др.), вызывающие серьезные отравления и приводящие к смерти животных.
Вода играет значительную роль в возникновении некоторых инфекционных, вирусных и инвазионных болезней сельскохозяйственных животных (сибирская язва, эмфизематозный карбункул, инфекционная анемия лошадей, бруцеллез, туляремия, пастереллез, сальмонеллезы, лептоспироз, сап, чума и рожа свиней, ящур, мно-гие паразитарные болезни и др.).
Патогенные микроорганизмы могут находиться в воде длительное время. Так, кишечная палочка в дистиллированной воде выживает в течение 21-72 сут, в речной 21-183.
Жизнеспособность (выживаемость) микроорганизмов в воде зависит от ее температуры, наличия органических веществ и химического состава растворенных компонентов. Однако выявить присутствие патогенных микроорганизмов довольно сложно. Для этого используют косвенные бактериологические показатели загрязнения воды – микробное число, коли-титр и коли-индекс.
Вода может быть носителем инвазионного начала или средой обитания для промежуточного хозяина возбудителей паразитарных болезней. Возникновение фасциолеза, кокцидиоза, малярии, трихомоноза, лямблиоза, диктиокаулеза у животных и человека чаще всего связано с употреблением недоброкачественной воды, которая содержит инвазионное начало.
Таким образом, природная вода не всегда может удовлетворить физиологическим и гигиеническим потребностям животных. При ее потреблении возникают различные заболевания, снижаются продуктивность и качество продукции. Микробная и паразитарная флора природной воды способна вызвать вспышки заразных болезней – инфекционных и инвазионных, чаще всего кишечны
Калорийность Вода водопроводная, городская. Химический состав и пищевая ценность.
Пищевая ценность и химический состав «Вода водопроводная, городская».
В таблице приведено содержание пищевых веществ (калорийности, белков, жиров, углеводов, витаминов и минералов) на 100 грамм съедобной части.
| Нутриент | Количество | Норма** | % от нормы в 100 г | % от нормы в 100 ккал | 100% нормы |
| Вода | 99.9 г | 2273 г | 4.4% | 2275 г | |
| Зола | 0.1 г | ~ | |||
| Макроэлементы | |||||
| Калий, K | 1 мг | 2500 мг | 250000 г | ||
| Кальций, Ca | 3 мг | 1000 мг | 0.3% | 33333 г | |
| Магний, Mg | 1 мг | 400 мг | 0.3% | 40000 г | |
| Натрий, Na | 3 мг | 1300 мг | 0.2% | 43333 г | |
| Микроэлементы | |||||
| Медь, Cu | 9 мкг | 1000 мкг | 0.9% | 11111 г | |
| Фтор, F | 81.1 мкг | 4000 мкг | 2% | 4932 г |
Энергетическая ценность Вода водопроводная, городская составляет 0 кКал.
- fl oz = 29.6 гр (0 кКал)
- cup 8 fl oz = 237 гр (0 кКал)
- liter = 1000 гр (0 кКал)
- 3 ice cube (3/4 fl oz) = 64 гр (0 кКал)
Основной источник: USDA National Nutrient Database for Standard Reference. Подробнее.
** В данной таблице указаны средние нормы витаминов и минералов для взрослого человека. Если вы хотите узнать нормы с учетом вашего пола, возраста и других факторов, тогда воспользуйтесь приложением «Мой здоровый рацион».
1.2. Основные компоненты физико-химического состава природных вод
Химические компоненты природных вод делят на 6 групп:
главные ионы;
растворенные газы;
растворенные органические вещества;
микроэлементы;
биогенные вещества;
токсичные элементы.
Иногда выделяют еще одну группу – взвешенные вещества.
Экспериментально установлено, что в открытом океане независимо от абсолютной концентрации соотношения между главными ионами основного солевого состава остаются примерно постоянными.
Предложено подразделять все природные воды по преобладающему аниону на три класса:
Каждый класс по преобладающему катиону подразделяется на три группы:
— кальциевую;
магниевую;
натриевую.
Гидрокарбонатный и карбонатный ионыявляются важнейшей составной частью ионного состава пресных и маломинерализованных природных вод суши. Появляются эти ионы в воде в результате растворения солей угольной кислоты – карбонатов кальция и магния.
Соли СаСО3иMgCO3трудно растворимы в воде и могут перейти в раствор только в присутствии углекислого газа
СаСО3+ СО2+ Н2О = Са(НСО3)2
Ионы НСО3–, СО32–, Са2+, Н+и Н2СО3находятся между собой в растворе в определенных количественных отношениях, определяющихся константой диссоциации угольной кислоты по первой и второй ступени (К1= 3.10– 7 , К2= 4.10– 11). Эти ионы и угольная кислота образуют карбонатную систему химического равновесия, т.е. изменение содержания одного из них влечет за собой изменение содержания другого, что имеет большое значение для поддержания реакции среды в природных водах.
Хлорид – ионы обычно занимают первое место среди анионов в воде океанов, морей, сильно минерализованных озер, меньше их в воде рек. Источники хлорид-ионов в воде – продукты выветривания магматических пород, в которых хлор присутствует в рассеянном состоянии, колоссальные залежи хлористых солей осадочных пород, вулканические выбросы. Широкому распространению хлоридов в природных водах суши в значительной мере способствует деятельность человека, т.к. большое промышленное и физиолобиологическое значениеNaClспособствует рассеянию его по земной поверхности. ИоныCl–не усваиваются растениями и бактериями и выделяются в свободном состоянии организмами животных, поэтому круговорот их в земной коре несложен. Повышенное содержание хлоридов ухудшает вкусовые качества воды, делает ее малопригодной для питьевого водоснабжения и ограничивает применение для других целей. Концентрация хлоридов и ее колебания могут служить одним из критериев загрязненности водоема хозяйственно-бытовыми стоками.
Сульфат – ионытакже важнейшие анионы природной воды и вместе с хлорид-ионами составляют главную часть анионного состава воды морей и сильно минерализованных озер. Содержание сульфат-ионов в природных водах лимитируется присутствием в воде катионов Са2+, которые образуют с сульфат-ионами малорастворимое соединениеCaSO4.
Основными источниками растворенных в воде сульфатов являются различные осадочные породы, в состав которых входит гипс СаSO4 .2H2O. Источниками сульфат-ионов в природной воде служат и процессы окисления самородной серы, протекающие по уравнению
2S+ 3O2+ 2H2O= 2H2SO4,
а также окисление широко распространенных в земной коре сульфидных соединений.
На содержание сульфат-ионов в природных водах оказывают влияние процессы распада и окисления органических веществ растительного и животного происхождения, содержащих серу. Вблизи населенных пунктов присутствие сульфат-ионов в воде часто оказывается результатом загрязнения ее бытовыми и промышленными сточными водами.
Сульфат-ионы являются устойчивыми. При отсутствии кислорода сульфаты могут быть восстановлены обычно под действием сульфатредуцирующих бактерий, обнаруженных в морях и в водах нефтеносных месторождений, до сероводорода. Получающийся в процессе восстановления сульфатов сероводород в дальнейшем при соприкосновении с воздухом вновь окисляется вначале до серы
2 H2S+O2= 2H2O+ 2S,
а затем до сульфатов.
Повышенное содержание сульфатов в воде ухудшает ее органолептические свойства. Сульфаты могут придавать воде слабительные свойства, поэтому их содержание строго регламентируется.
При значительном содержании в воде хлоридов и сульфатов они являются причиной ее агрессивности по отношению к бетону. Так, сульфат-ионы могут взаимодействовать с известью цемента с образованием гипса, что вызывает увеличение объема и образование трещин в бетоне. Присутствие в воде значительного количества хлоридов приводит к выщелачиванию и разрушению бетонного камня вследствие образования растворимых хлоридов кальция и магния.
Ионы щелочных металлов. Из ионов щелочных металлов в природных водах в наибольших количествах находятся ионыNa+, в значительно меньших – ионы К+. Подобно хлорид–ионам, ионыNa+являются характерными ионами сильноминерализованных вод.
Важнейшим источником катионов натрия в природных водах являются его залежи в виде хлористых солей, находящиеся среди различных осадочных пород морского, а в засушливых районах и континентального происхождения.
Д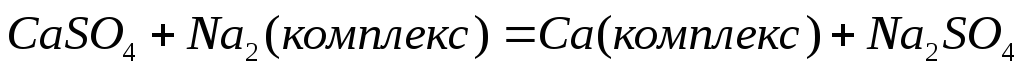 ругим
источником ионов щелочных металлов в
природной воде являются продукты
выветривания горных пород. Калий
содержится, главным образом, в кислых
изверженных породах (ортоклаз, мусковит),
а натрий входит в состав различных
алюмосиликатов. Кроме того, в ряде
случаев происходит обменная адсорбция
ионов Са2+иNa+в породах, в результате чего в растворе
взамен ионов Са2+появляется
эквивалентное количество ионовNa+по схеме:
ругим
источником ионов щелочных металлов в
природной воде являются продукты
выветривания горных пород. Калий
содержится, главным образом, в кислых
изверженных породах (ортоклаз, мусковит),
а натрий входит в состав различных
алюмосиликатов. Кроме того, в ряде
случаев происходит обменная адсорбция
ионов Са2+иNa+в породах, в результате чего в растворе
взамен ионов Са2+появляется
эквивалентное количество ионовNa+по схеме:
Ионы магния и кальция.Если в сильноминерализованных водах доминирует катион натрия, то в маломинерализованных водах обычно доминирует катион кальция, гораздо реже – магния.
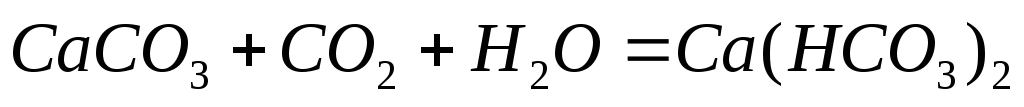 Основным
источником катионов Са2+в природных
водах являются известняки, которые
растворяются угольной кислотой,
находящейся в воде, с образованием
гидрокарбонатов
Основным
источником катионов Са2+в природных
водах являются известняки, которые
растворяются угольной кислотой,
находящейся в воде, с образованием
гидрокарбонатов
Другим источником катионов Са2+в природных водах является гипс, весьма распространенный в осадочных породах.
Катионы магния поступают в воду преимущественно при растворении доломитов (MgCO3.CaCO3), мергелей или продуктов выветривания коренных пород.
Присутствие катионов кальция и магния обусловливает жесткость воды.
Растворенные газы. Из растворенных в воде газов наибольшее значение имеют кислород и оксид углерода (IV) (углекислый газ), а также азот, сероводород, метан и др.
Растворимость газа в воде зависит от его природы, парциального давления и температуры. Для данной температуры растворимость может быть определена по закону Генри:
С = К×Р,
где С – растворимость газа, мг/дм3;
К – коэффициент пропорциональности, равный растворимости
газа при данной температуре и давлении 1 атм;
Р – парциальное давление газа, атм.
Концентрация любого газа в воде стремится перейти в равновесие с парциальным давлением этого газа над водой, поэтому непрерывно происходят обратимые процессы сорбции и десорбции.
Кислороднаходится в природной воде в виде растворенных молекул. Его присутствие является обязательным условием для существования большинства организмов, населяющих водоемы.
Вода обогащается кислородом за счет растворения кислорода атмосферы и за счет его выделения водной растительностью в процессе фотосинтеза. Дождевые и снеговые воды обычно пересыщены кислородом, поэтому их поступление в водоем увеличивает его аэрацию. Уменьшение содержания растворенного кислорода в воде происходит вследствие его выделения в атмосферу и из-за потребления на окисление органических веществ при дыхании организмов, брожении, минерализации органических остатков. Наличие растворенного кислорода является одной из причин коррозионной агрессивности воды по отношению к металлам. Концентрация кислорода определяет величину окислительно-восстановительного потенциала и в значительной мере направление и скорость процессов химического и биохимического окисления. Кислородный режим оказывает сильное влияние на жизнь водоема.
Содержание кислорода в воде обычно выражают в мг/дм3, в природных водах его содержание колеблется в пределах от 0 до 14 мг/дм3.
Углекислый газ.Углекислый газ находится в воде главным образом в виде растворенных молекул СО2. Однако часть их, около 1%, вступает во взаимодействие с водой, образуя угольную кислоту
СО2+ Н2О = Н2СО3
Обычно же не разделяют СО2и Н2СО3и под углекислым газом подразумевают их сумму.
Источником углекислого газа в природных водах являются, прежде всего, процессы окисления органического вещества, происходящие как непосредственно в воде, так и в почвах и илах, с которыми соприкасается вода. Сюда относятся дыхание водных организмов и различные виды брожения распадающихся органических остатков. Обогащают воду углекислым газом и геохимические процессы в осадочных породах. Поглощение СО2из атмосферы наблюдается почти исключительно в морях и очень редко в водах суши.
Из процессов, направленных на уменьшение СО2в природных водах, важнейшими являются удаление в атмосферу из-за перенасыщенности воды этим газом; расходование его на переход карбонатных пород в раствор; потребление водной растительностью при фотосинтезе.
Содержание углекислого газа в природных водах колеблется в очень широких пределах: от нескольких десятков долей до нескольких сотен мг/дм3. Наименьшее его количество наблюдается в морях, наибольшее – в подземных водах. Обычно весной и летом содержание диоксида углерода в водоеме понижается, а в осенне-зимний период увеличивается, достигая максимума в конце зимы. Повышенные концентрации СО2 угнетающе действуют на животные организмы. В реках и озерах из-за постоянного выделения в атмосферу, а также значительного потребления при фотосинтезе содержание СО2редко превышает 20-30 мг/дм3. При высоких концентрациях углекислого газа воды становятся агрессивными по отношению к металлам и бетону, т.к. при этом образуются растворимые гидрокарбонаты, нарушающие структуру этих материалов.
Прочие газы.Появление в природных водах сероводорода и метана указывает на наличие гнилостных процессов, протекающих в водоемах при ограниченном доступе воздуха. В природных условиях как сероводород, так и метан чаще встречаются в подземных водах. Однако наличие этих газов, в особенности Н2S, в реках и озерах может быть следствием сброса неочищенных сточных вод.
Растворенные органические вещества. Эта группа веществ включает различные органические соединения: органические кислоты, спирты, альдегиды и кетоны, сложные эфиры, белки, углеводы, амины, свободные аминокислоты и т.д. По происхождению растворенные органические вещества можно разделить на автохтонные – продукты метаболизма и биохимического распада остатков организмов – и аллохтонные, которые поступают в водную среду с поверхностными стоками с площади водосбора с ливневыми и талыми водами, с атмосферными осадками и сточными водами.
При разложении отмерших растений и их гумификации образуется сложная смесь высокомолекулярных органических соединений – гумусовые вещества, прежде всего гуминовые кислоты и фульвокислоты. Поверхностный сток с заболоченной площади водосбора приносит в природную воду большое количество этих веществ. Окраска природных вод связана, как правило, с наличием в водоеме гумусовых веществ. Содержание гумусовых веществ в речных водах около 5 – 10 мг/дм3, в озерных до 150 мг/дм3.
Загрязнение природных вод происходит и ядохимикатами, применяемыми в сельском хозяйстве.
К числу постоянных источников органического вещества следует отнести также бытовые и промышленные сточные воды, попадающие в подземные воды и реки. Состав этих веществ весьма различен. К ним относятся поверхностно-активные вещества (ПАВ), фенолы, нефтепродукты и др.
Ввиду сложности определения индивидуальных органических веществ, их многообразия и малых природных концентраций для их количественной характеристики используют косвенные показатели: общее содержание Сорг;Nорг; Рорг, перманганатную или дихроматную окисляемость воды (ХПК), биохимическое потребление кислорода (БПК).
Микроэлементы. В природных водах установлено наличие более 70 химических элементов. Веществ, совершенно не растворимых в воде, нет и каждый элемент, встречающийся в земной коре, содержится и в природных водах. К микроэлементам, по А.П. Виноградову, относятся те элементы, содержание которых в воде меньше 10–3 %. В группу микроэлементов входят все металлы, кроме главных ионов и железа, а также некоторые анионы.
Тяжелые металлы (медь, кобальт, никель, марганец, цинк и др.) находятся в природных водах в небольших количествах, что объясняется небольшим содержанием их в почвах и грунтах.
Среднее содержание ионов брома в пресных водах колеблется в пределах 0,001 – 0,2 мг/дм3. Содержание ионов иода значительно меньше – до 0,003 мг/дм3, в морских водах оно повышается до 0,05 мг/дм3. Содержание фтора в воде озер, рек и артезианских скважин колеблется в пределах 0,04 – 0,3 мг/дм3. Содержание бора в пресных водах примерно 0,01 мг/дм3, в морских водах – 1,5 – 4,4 мг/дм3.
Биогенные вещества. К биогенным принадлежат вещества, в той или иной мере связанные своим происхождением с жизнедеятельностью водных организмов. Присутствие этих веществ в воде, в свою очередь, определяет возможность существования водных организмов. Выделение этой группы является несколько условным, т.к. в жизненных процессах принимают участие и другие ионы, в частности ионы Са2+,Mg2+, К+. Биогенные вещества находятся в воде в виде ионов, а также в виде коллоидов.
Соединения азота. Из неорганических соединений азота в природной воде встречаются катионы аммония (NH4+), нитритные (NO2–) и нитратные (NO3–) анионы. Сходство их генезиса и возможность взаимного перехода одного в другой дают основание объединить их в одну группу.
О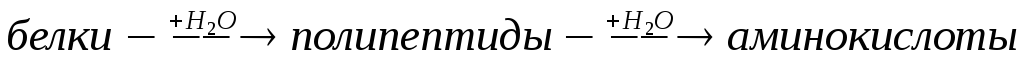 сновным
источником появления в природной водеNH4+, а затемNO3– иNO2–являются различные сложные органические
вещества животного и растительного
происхождения, содержащие в своем
составе белок. Некоторые микроорганизмы
способны под действием протеолитических
ферментоврасщеплять
молекулы белка на пептидные цепочки и
отдельные аминокислоты:
сновным
источником появления в природной водеNH4+, а затемNO3– иNO2–являются различные сложные органические
вещества животного и растительного
происхождения, содержащие в своем
составе белок. Некоторые микроорганизмы
способны под действием протеолитических
ферментоврасщеплять
молекулы белка на пептидные цепочки и
отдельные аминокислоты:
Образовавшиеся аминокислоты далее разлагаются при участии бактерий и ферментов с выделением аммиака.
Разложение (дезаминирование) аминокислот может осуществляться при участии воды (гидролитическое дезаминирование)
R CHNH2COOH + H2O R CHOH – COOH + NH3;
кислорода (окислительное дезаминирование)
RCHNH2COOH+O2R–СО–COOH+NH3
и водорода (восстановительное дезаминирование)
RCHNH2COOH+H2RCH2COOH+NH3.
Процесс разложения продуктов гидролиза белковых соединений микроорганизмами с выделением аммиака называется аммонификацией.
Вместе с тем катионы аммония могут появляться и другим путем – из неорганических соединений. Замечено присутствие NH4+в болотистых водах, богатых гумусовыми веществами, которые, по-видимому, способны восстанавливать нитраты доNH4+. Нитраты и нитриты могут быть восстановлены доNH4+и другими веществами, например, сероводородом и железом (II). Кроме того,NH4+часто попадает в водоемы в составе промышленных сточных вод, например, азотно-туковых, содовых, коксо-газовых и других заводов.
Наличие аммиака в воде всегда вызывает подозрение в загрязнении воды сточными водами.
В природной воде аммиак довольно неустойчив и под влиянием нитрифицирующих бактерий окисляется сначала до азотистой кислоты, а затем до азотной кислоты (реакции нитрификации)
2 NH3+ О2= 2 НNО2+ 2 Н2О
(NH4)2СО3+ 3 О2= 2 НNО2+ СО2+ 3 Н2О
2 НNО2+ О2= 2 НNО3
Другим важнейшим источником непосредственного обогащения природных вод нитратами являются получающиеся при атмосферных электрических разрядах оксиды азота, которые после поглощения атмосферными водами попадают на земную поверхность. Нитратные ионы встречаются в поверхностных природных водах в количествах несколько больших, чем нитритные. В то же время в подземных водах содержание нитритов обычно значительно выше, особенно в верхних водоносных горизонтах.
При исследовании поверхностных вод по соотношению содержания в них аммиака, нитритов и нитратов можно судить о времени загрязнения воды. Так, наличие в воде аммиака и отсутствие нитритов указывает на свежее загрязнение воды. Отсутствие аммиака в воде при наличии нитритов и особенно нитратов свидетельствует, что загрязнение воды произошло давно, и прошел процесс самоочищения.
Соединения фосфора.Минеральный фосфор в природных водах в растворенном состоянии находится главным образом в виде гидрофосфат-иона НРО42–, в меньшей мере дигидрофосфат- иона Н2РО4–, еще меньше фосфат – иона РО43–. Содержание тех или иных ионов ортофосфорной кислоты определяется реакцией среды.
Органический растворенный фосфор является составной частью сложных органических соединений. Фосфор может находиться в природной воде и во взвешенных частицах как минерального, так и органического происхождения.
Соединения фосфора, хотя и присутствуют в природных водах в ничтожных количествах, имеют исключительно важное значение для развития растительной жизни, являясь зачастую одним из факторов, лимитирующих и определяющих развитие растительных организмов и, следовательно, продуктивность водоемов. Именно увеличение содержания фосфора в пресных водоемах обычно становится причиной их эвтрофирования.
Соединения железаочень часто встречаются в природных водах вследствие перехода их в раствор из различных горных пород, в которых железо широко распространено. Переход железа в раствор может происходить под действием окислителей или кислот. В болотистых водах железо часто находится в виде сложных гумусовых комплексов.
Форма, в которой железо находится в природных водах, может быть весьма разнообразной. Преобладающее в подземных водах закисное железо присутствует в воде водоемов в виде растворимых солей гидрокарбоната железа (II)Fe(HCO3)2и карбонатаFeCO3, которые устойчивы только при содержании больших количеств СО2и отсутствии кислорода. В противном случае происходит гидролиз, и железо переходит в малорастворимый гидроксид железа (II)
Fe(HCO3)2+ 2 Н2О =Fe(OН)2+ 2 Н2СО3,
который далее легко окисляется в гидроксид железа (III)
4 Fe(ОH)2+ О2+ 2 Н2О = 4Fe(ОH)3.
Процесс окисления во многих случаях протекает при участии микроорганизмов, которые используют выделяющуюся при этом энергию в процессе жизнедеятельности.
Fe(ОH)3очень мало растворим, но может присутствовать в растворе в коллоидном состоянии, которое, по-видимому, является основной формой существования железа в поверхностных водах.
Воды, содержащие железо в значительных количествах, обычно имеют кислую реакцию среды. Это характерно для железистых вод, если происхождение железа связано с растворением сульфата железа (III).
Fe2(SO4)3 + 6 H2O = 2 Fe(OH)3 + 3 H2SO4
Соединения железа (III) чаще встречаются в поверхностных водах (сотые, реже десятые доли мг/дм3), соединения железа (II) –преимущественно в подземных водах в несколько больших количествах (до 1 мг/дм3).
Соединения кремния.Повсеместное распространение кремния в природе обеспечивает его непрерывное поступление в природные воды в виде выщелачиваемой водой кремневой кислоты и ее щелочных солей, содержащих ионыHSiO3–иSiO32–, а часть кремния находится в коллоидном состоянии, в частицах составаSiO2Н2О, а также в виде поликремневой кислоты состава хSiO2уН2О. Кроме того, в водах присутствуют и органические соединения кремния.
Наибольшие количества кремния встречаются в подземных водах, наименьшие – в поверхностных слоях открытых водоемов, где растения потребляют кремний. Обычно содержание кремния в открытых водоемах колеблется от десятых долей мг/дм3в морях до 10 мг/дм3в водах суши.
Токсичные вещества. К этой группе веществ относят тяжелые металлы (ртуть, кадмий, свинец и др.), нефтепродукты, хлорорганические и другие пестициды, фенолы, синтетические поверхностно-активные вещества (СПАВ) и т.д.
Взвешенные вещества.Содержание взвешенных веществ в воде называется мутностью и выражается в г/м3или мг/дм3. Мутность речной воды зависит от скорости течения и расхода воды. Основная причина наличия взвешенных частиц – эрозия русла и склонов. В некоторых водоемах источником взвешенных веществ органического происхождения является планктон, развитие которого наблюдается преимущественно в летние месяцы.
Производственные сточные воды нередко содержат значительные количества взвешенных частиц. Допустимое увеличение концентрации их в природных водах жестко нормируется.
3. Состав природных вод
[Характеристика химического состава атмосферных осадков,
поверхностных вод (речных, озёрных, морских, океанических).
Общие сведения о химическом составе подземных вод: минерализация,
макро–, мезо–, микрокомпоненты. Газовый состав, органические
вещества, микробиологический состав подземных вод].
Природные, в том числе подземные, воды представляют собой сложные системы, состоящие из собственно воды, о свойствах которой мы говорили на прошлой лекции, разнообразных ионов химических элементов, газообразных молекул, органических соединений, микроорганизмов, сложных органоминеральных комплексов и т.д. Но всё–таки главными компонентами природных растворов, изучаемыми гидрогеохимией, являются шесть ионов: НСО3–, SO42–, С1–, Ca+, Mg+ и Na+.
Прежде, чем начать рассмотрение химического состава природных и, главным образом, подземных вод, будет нелишним вспомнить о способах выражения химического анализа воды, о подходах к систематике, или классификации природных вод. В гидрогеохимической практике приняты три основные формы выражения концентрации компонентов. Первая форма — это г/л или мг/л. Это масса химического вещества, содержащегося в 1 л природного раствора. Реже массу химического вещества рассчитывают не на объёмную единицу (л), а на массовую (кг), и получается единица измерения г/кг. Вторая форма выражения концентрации — это г–экв или мг–экв. Чтобы получить миллиграмм–эквивалентное выражение концентрации надо величину концентрации в мг/л разделить на эквивалентную массу иона. Эквивалентная масса иона равна атомной массе, делённой на валентность. Например, эквивалентная масса Са2+ составляет 40,08 : 2 = 20,04, а Na+ — 23,0 : 1 = 23,0. Эквивалентная форма выражения результатов анализа по существу равнозначна молярной форме выражения; при этом концентрации веществ выражены в тех химически равноценных единицах, пропорционально которым они вступают между собой в реакции и связаны в солях, будучи в твёрдом состоянии. При качественно выполненном анализе Σ мг–экв анионов равна Σ мг–экв катионов. Наконец третья форма выражения концентраций — это %–эквивалентная форма. Сумма мг–эквивалентов анионов принимается за 100 % и сумма мг–эквивалентов катионов — за 100 % и рассчитывается, какой процент составляет концентрация каждого иона (в мг–экв) от общей суммы катионов или анионов. Приведём пример анализа воды, полученной из среднедевонских отложений (гл. 251 м) в д. Обабье Браславского района.
мг/л | мг–экв/л | % мг–экв | |
Са2+ | 71,42 | 3,564 | 42,90 |
Mg2+ | 29,78 | 2,451 | 29,51 |
Na+ | 49,20 | 2,140 | 25,76 |
K+ | 6,00 | 0,153 | 1,84 |
Сумма катионов | 8,307 | 100,00 | |
Cl– | 74,96 | 2,114 | 25,45 |
SO42– | 33,33 | 0,694 | 8,35 |
HCO3– | 335,50 | 5,499 | 66,20 |
Сумма анионов | 8,307 | 100,00 |
Одной из важнейших характеристик химического состава природных вод является их минерализация, т.е. сумма растворённых солей; она выражается в г/л, мг/л, г/кг, мг/кг, может даваться в процентах (%), промилле (‰), в эквивалентном выражении. Иногда, главным образом в океанологии, вместо термина “минерализация” применяется термин “солёность”. Это синонимы.
Химический состав природных вод очень разнообразен. Это вызывает необходимость систематизации химического состава вод. С этой целью предложены ряд классификаций и множество способов наглядного изображения химического состава вод (графики, формулы, коэффициенты и т.п.).
Наиболее распространено выражение химического состава воды в виде формулы Курлова. Эта формула представляет собой инструмент не только выражения состава воды, но и определения её типа, т.е. это инструмент классифицирования вод по химическому составу. Формула Курлова была предложена в 1928 г. и с этого времени её вид претерпел изменения. Современный и наиболее рациональный вид формулы Курлова покажем на примере такой формулы для приведенного выше химического анализа воды из среднедевонских отложений Браславского района.
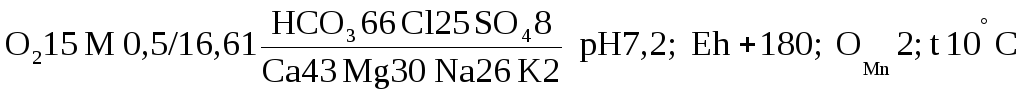 .
.
Итак, в левой стороне формулы выписывается (в мг/л) содержание газов, а затем микрокомпонентов, если их количество представляет геохимический интерес. Далее записывается минерализация воды (М) в виде дроби: в числителе в массовой форме (в г/л с точностью до одного десятичного знака), в знаменателе — в мг–эквивалентной форме. Далее, в псевдодробь записываются в %–эквивалентном выражении (с точностью до целых процентов) в нисходящем порядке все анионы (в числителе) и катионы (в знаменателе), содержание которых составляет более 1 %–экв. Справа от псевдодроби записывают показатели, характеризующие состояние воды (рН, Еh), перманганатную окисляемость в мг О/л, характеризующую содержание в воде органических веществ, а также температуру воды. Для сильноминерализованных вод в конце формулы проставляют плотность воды. При наименовании воды по её ионному составу по формуле Курлова учитываются ионы, концентрация которых превышает 20 %–экв. При этом сначала называются подчинённые ионы, а затем преобладающие. Вода, формула которой изображена выше, будет называться хлоридно–гидрокарбонатной натриево–магниево–кальциевой.
В большинстве случаев гидрогеохимической практики простое чтение формулы Курлова, как мы это только что сделали, оказывается достаточным для определения характера воды. Однако иногда (при гидрогеохимической оценке нефтегазоносности, при изучении минеральных лечебных вод, при решении специальных вопросов теоретической гидрогеохимии) необходимо провести более детальную типизацию воды по химическому составу. Тогда исследуют соотношения ионов (в мг–экв или %–экв.), которые по существу отражают, какие соли присутствуют в растворе, как связаны между собой катионы и анионы.
Почти все природные воды укладываются в четыре типа (в типе III — два подтипа), характеризующиеся следующими соотношениями ионов:
I) HCO3– > Ca2+ + Mg2+,
II) HCO3– < Ca2+ + Mg2+ < HCO3– + SO42–,
IIIa) Cl– < Na+ + Mg2+,
IIIб) Cl– > Na+ + Mg2+,
IV) HCO3– = 0.
Применив указанные соотношения к нашей воде из Браславского района (см. формулу Курлова), легко установить, что вода относится ко II типу, к которому относится большинство подземных вод малой и умеренной минерализации.
Итак, мы произвели типизацию подземной воды по химическому составу. И произвели её по существу, следуя наиболее принятой классификации О.А. Алекина –Е.В. Посохова. В основу этой классификации положены два принципа: преобладающих ионов и соотношения между ионами. Все природные воды по преобладающему аниону делятся на классы: гидрокарбонатный, сульфатный, хлоридный и промежуточные (гидрокарбонатно–сульфатный, сульфатно–хлоридный и т.д.), а классы по преобладающему катиону делятся на группы: кальциевых, магниевых, натриевых и смешанных (кальциево–магниевых, натриево–кальциевых и т.д.) вод. В пределах групп выделяются типы вод по соотношению ионов.
По величине минерализации природные воды подразделяются на пресные (до 1 г/кг), солоноватые (1,0–10,0 г/кг), солёные (10,0–35,0 г/кг) и рассолы (35–>370 г/кг). В пределах названных групп существует более дробное деление, как показано в таблице.
Воды | Минерализация | |
г/кг | г/л | |
Пресные ультрапресные умеренно нормально | < 0,1–1,0 < 0,1 0,1–0,5 0,5–1,0 | < 0,1–1,0 < 0,1 0,1–0,5 0,5–1,0 |
Солоноватые слабо средне сильно | 1,0–10,0 1,0–3,0 3,0–5,0 5,0–10,0 | 1,0–10,0 1,0–3,0 3,0–5,0 5,0–10,0 |
Солёные слабо сильно | 10,0–35,0 10,0–25,0 25,0–35,0 | 10,1–36,0 10,1–25,4 25,4–36,0 |
Рассолы слабые крепкие весьма крепкие предельно насыщенные | 35,0– > 370,0 35,0–135,0 135,0–265,0 265,0–370,0 > 370 | 36,0– > 500,0 36,0–150,0 150,0–320,0 320,0–500,0 > 500,0 |
Кстати, в этой таблице можно видеть, как сильно начинают различаться цифры минерализации, выраженной в г/кг и г/л при большой минерализации. Это связано с существенным ростом плотности воды при увеличении минерализации (пресная вода имеет плотность 1,0 г/см3; морская вода с минерализацией 36 г/л — 1,03 г/см3, а рассол с минерализацией 394 г/л — 1,28 г/см3).
Теперь кратко рассмотрим особенности состава атмосферных и поверхностных вод Земли, которые дают начало подземным водам.
Атмосферные (метеорные) воды. Несмотря на довольно большое разнообразие химического состава незагрязнённых промышленными отходами дождевых и снеговых вод, всё же они, как правило, отличаются низкой минерализацией, не превышающей в районах гумидного климата 50, а нередко и 20 мг/л. Но в некоторых районах морских побережий за счёт солей, захватываемых с поверхности моря, минерализация дождевых вод в отдельные периоды года может быть более 100 мг/л. Из моря или океана атмосферные осадки заимствуют натрий, хлор, иод, бром. В Западной Европе содержание хлора в атмосферных осадках в непосредственной близости от берегов морей достигает иногда 200–300 мг/л. С удалением от морских побережий в глубь континентов всё большую роль в атмосферных осадках играют вещества, поступающие в атмосферу в результате развевания и последующего растворения пылеватых частиц почв и горных пород, а в условиях засушливого климата — и легкорастворимых солей. В последнем случае состав метеорных осадков становится сульфатным и даже хлоридным.
Важно отметить, что с каждым годом все больше возрастает роль техногенного фактора, который сильно изменяет состав атмосферным осадков. Выбросы в атмосферу газов, загрязнение её разнообразными отходами приводят к образованию в атмосфере кислот, щелочей, обогащению атмосферных вод различными металлами, органическими соединениями и солями. Из–за того, что минерализация атмосферных вод мала, а источников поступления вещества в атмосферу много, метеорные воды характеризуются большим разнообразием химических типов. Кроме солей атмосферные воды содержат растворённые азот, кислород, углекислый газ, инертные газы.
Речные воды. Воды подавляющего числа рек имеют небольшую минерализацию (менее 0,5 г/л). Это, как правило, гидрокарбонатные кальциевые воды. В степной полосе и пустынях преимущественно распространены реки с сульфатной кальциевой или натриевой водой. Минерализация вод таких рек чаще всего 0,5–1 г/л. В отдельных случаях, как, например, в реке Кума, она достигает 4–5 г/л. Реки с водой хлоридного класса также распространены редко.
Из биогенных компонентов химического состава для речных вод наиболее характерны соединения азота и фосфора. Органическое вещество в реках представлено, главным образом, гуминовыми соединениями. Из растворённых газов в речных водах наибольшее значение имеют кислород и углекислый газ.
В исключительных случаях реки характеризуются совершенно уникальным составом. Например, р. Риу–Негру в Колумбии содержит воду, в которой присутствует 11 г/кг серной кислоты и 9 г/кг соляной. В истоке этой реки находятся, по–видимому, активные вулканы.
Озерные воды. По минерализации воды озёр делятся на пресные (до 1 г/л), солоноватые (до 35 г/л) и соляные (свыше 35 г/л).
Вода подавляющего большинства пресных озёр гидрокарбонатная кальциевая. Таковы, например, озёра Нарочь, Байкал, Ладожское, Онежское, Гурон, Мичиган, Танганьика. Химический состав воды пресных озёр определяется составом вод втекающих в них рек.
Сложнее обстоит дело с солоноватыми озёрами. В них вода подвергается испарительному концентрированию, а при этом происходят изменения в соотношении главных ионов и, следовательно, изменение её химического состава. К категории крупных солоноватых озёр относятся Балхаш, Иссык–Куль и Аральское море. По преобладающим анионам вода в них является хлоридно–сульфатной или сульфатно–хлоридной, по катионному составу — магниево–натриевой.
Соляные озёра делятся на три типа по химическому составу воды. Это: содовые или карбонатные, сульфатные и хлоридные. Соляные озёра бессточные, расположены в аридной зоне. На базе некоторых соляных озёр осуществляется промышленная добыча либо осаждающихся солей, либо высококонцентрированных вод (рассолов). Так, в заливе Кара–Богаз–Гол (Туркмения) много лет шла добыча мирабилита (Nа2SO4 · 10Н2О). В Израиле из хлоридных магниево–натриевых рассолов Мёртвого моря (это озеро) с минерализацией 300–320 г/л извлекают хлористый калий и бромидные продукты. В воде Мёртвого моря содержится 6 г/кг брома — самое большое количество, когда–либо зарегистрированное для любой поверхностной воды. Интересно, что такое же содержание брома установлено и в подземных рассолах Гомельской области (Припятский прогиб).
Состав и количество органического вещества в озёрных водах весьма разнообразны и зависят от физико–географических условий нахождения озёра, его биологической продуктивности, ионного состава воды, температуры и др. В состав растворённых газов озёрных вод входят кислород, азот, углекислый газ, иногда сероводород и метан.
Морские и океанические воды. В морской и океанической воде обнаружены все химические элементы. Однако основную массу солей составляют одиннадцать главных компонентов, которые в средней океанической воде имеют такие концентрации (в г/л): Na+ — 11,03; Mg2+ — 1,33; К+ — 0,40; Са2+ — 0,42; Sr2+ — 0,01; Cl– — 19,83; SO42– — 2,77; НСО3– — 0,15; Br– — 0,07; F– — 0,01 и Н3ВО4 — 0,03. Эти компоненты дают в сумме 99,9 % массы всех растворённых в океанической воде соединений. Минерализация средней океанической воды составляет 36 г/л, или 35 г/кг. Формула Курлова для океанической воды в упрощённом виде записывается так:
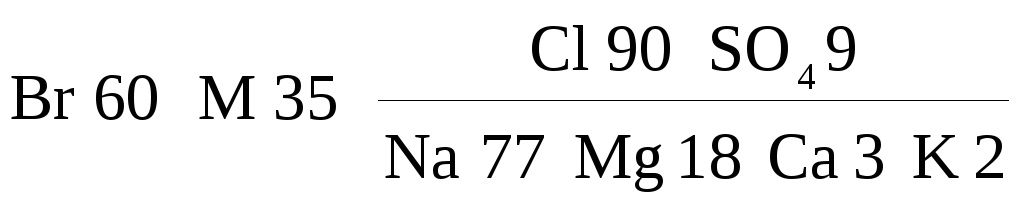 .
.
Таким образом, современная океаническая вода является хлоридной натриевой, относящейся к типу III, подтипу а, согласно классификации О.А. Алёкина – Е.В. Посохова.
Ещё в 1819 г. Марсет установил, что морская и океаническая вода в разных районах земного шара содержит одни и те же химические компоненты в очень близких пропорциях, а различия в химическом составе состоят только в общем количестве присутствующих солей, т.е. в минерализации. Действительно, минерализация воды составляет для Белого моря 3, Балтийского — 7, Черного — 18, Мраморного — 25, Средиземного и Красного — 38 г/кг.
В водах Мирового океана содержится существенное количество органического вещества, источником которого является весь органический мир, населяющий воды. Среднее содержание органического вещества в океанической воде 1,5–2,5 мг/л, в водах окраинных и внутренних морей концентрация органического вещества увеличивается. Например, в Азовском море она доходит до 6 мг/л. Среди органических веществ преобладают липиды, углеводороды и гуминовые вещества.
В морской воде также присутствуют растворённые газы. Это кислород, азот, углекислый газ, сероводород, углеводороды и инертные газы.
Заканчивая краткий рассказ о поверхностных водах нашей планеты, интересно отметить, что при сравнении среднего химического состава вод Мирового океана и поверхностных вод суши ярко бросается в глаза диссиметрия Земли в составе поверхностных вод. Если в Мировом океане резко преобладают хлор и натрий, то в речных и озёрных водах — гидрокарбонат и кальций. Диссиметрия наблюдается и по общей концентрации солей: в Мировом океане концентрация растворённых веществ в среднем в 179 раз превышает таковую в водах рек и озёр.
Перейдём, наконец, к вещественному составу подземных вод, который складывается из ионов, газов, органического вещества, микрофлоры.
Состав растворённых ионов в подземных водах определяется распространённостью химических элементов в земной коре и растворимостью соединений, образуемых этими элементами. Распространённость и содержание минеральных веществ в подземных водах различны, в связи с чем среди них выделяются макрокомпоненты и микрокомпоненты, а иногда и промежуточная группа — второстепенных компонентов (или мезокомпоненты).
Макрокомпоненты определяют химический тип воды, её общую минерализацию и название. К макрокомпонентам относятся Са, Мg, Na, К (отнесение последнего в эту группу является спорным), С1, S и С). Это химические элементы, которые имеют высокий кларк, т.е. высокое среднее содержание в земной коре и образуют хорошо растворимые соединения. Мы назвали макрокомпоненты в виде химических элементов, но в воде они присутствуют в виде ионов: (Са2+, Мg2+, Na+, К+, С1–, SO42– и НСО3–.
Второстепенными компонентами подземных вод принято считать азотистые соединения (NH4+, NO3–), кремнекислоту H3SiO4, Fe2+, Fe3+, Al. Эти элементы всегда присутствуют в подземных водах, но содержание их обычно невелико, что связано либо с их высоким кларком, но низкой растворимостью соединений, либо с низким кларком, но сравнительно хорошей растворимостью солей.
Микрокомпоненты содержатся в подземных водах, как правило, в незначительных количествах, определяемых миллиграммами, микрограммами и долями микрограммов в 1 литре. Но иногда их концентрации достигают количеств, соизмеримых с макрокомпонентами. В этом случае они входят в формулу химического состава воды. Микрокомпоненты представлены химическими элементами, которые имеют низкий кларк в литосфере и соединения которых отличаются низкой растворимостью. Микрокомпонентами считаются бром, иод, фтор, бор, литий, рубидий, цезий, стронций, барий, мышьяк, молибден, медь, кобальт, цинк, свинец, ванадий, никель и др.
Простое перечисление макро–, мезо– и микрокомпонентов не даёт представления о размахе колебаний их концентраций в подземных водах. Поэтому отметим, что концентрация химических элементов в подземных водах колеблется от сотен граммов на литр (макрокомпоненты) до миллиардных долей г/л (микрокомпоненты).
Очень большой диапазон имеет и минерализация подземных вод. Увеличение минерализации происходит за счёт появления в подземных водах всё более растворимых соединений. Наименее минерализованными (менее 10 мг/л) являются ультрапресные гидрокарбонатные кальциевые воды (карбонат кальция относительно слаборастворим), наиболее минерализованными (до 760 г/л) — предельно насыщенные хлоридные кальциевые рассолы (хлорид кальция чрезвычайно хорошо растворим).
Итак, мы отметили, что подземные воды весьма разнообразны по минерализации, по размаху концентраций отдельных химических компонентов. Теперь подчеркнём чрезвычайное разнообразие химических типов подземных вод. Посмотрим это на примере подземных вод Беларуси, для территории которой гидрогеохимик В.М. Шиманович насчитал около 75 химических разновидностей подземных вод.
Сплошным чехлом мощностью 200–300 м на территории Беларуси залегают пресные воды. Эти воды сосредоточены, главным образом, в четвертичных отложениях, но не только в них. Здесь весьма характерны гидрокарбонатные кальциевые воды. Местами, например, в районе Витебска, где питьевое водоснабжение города основано на заборе воды из девонских доломитовых пород, воды гидрокарбонатные магниево–кальциевые и кальциево–магниевые. В других случаях, например, в районе Минска в пресных подземных водах, получаемых из морских терригенных отложений верхнего протерозоя, существенное значение среди катионов приобретает натрий. Встречаются воды гидрокарбонатные кальциево–натриевые, натриевые и др.
Кроме пресных широко представлены в недрах нашей республики солоноватые, солёные воды и рассолы. На большей части территории Беларуси (северо–восточная четверть) повсеместно распространена так называемая сульфатная пачка наровского горизонта среднего девона. Эта пачка сложена гипсом и залегает на глубинах 200–400 м.
Очень характерно, что к ней (немного выше или немного ниже её) часто приурочены сульфатные воды с преобладанием кальция среди катионов. Минерализация этих вод в среднем около 2 г/л, что совпадает с величиной растворимости сульфата кальция.
Глубже 300–400 м почти повсеместно залегают хлоридные солоноватые и солёные преимущественно хлоридные натриевые подземные воды, а в пределах двух крупных геологических структур Беларуси — Оршанской впадины на северо-востоке республики и Припятского прогиба на юго-востоке — на больших глубинах обнаруживаются подземные рассолы. Особенно интересны рассолы Припятского прогиба. Они насыщают здесь надсолевые, внутрисолевые, межсолевые и подсолевые карбонатные и терригенные отложения, которые по возрасту относятся к позднему и среднему девону и позднему протерозою и залегают на глубинах 2–5 км. Минерализация рассолов Припятского прогиба достигает 460 г/л. Рассолы хлоридные. При минерализации менее 280–300 г/л они натриевые; при минерализации свыше 280–300 г/л — преимущественно кальциевые. В рассолах повышенные и высокие (так называемые промышленные) концентрации ряда микрокомпонентов: брома, иода, стронция, бора, лития, рубидия, цезия. Концентрация Вr достигает 6 г/л, а Sr 4 г/л. Это как раз тот случай, когда микрокомпоненты находятся в таких высоких концентрациях, что они по существу ухе выходят из разряда микрокомпонентов и переходят в категорию макрокомпонентов. Любопытно, что в наиболее концентрированных рассолах содержание натрия — типичного макрокомпонента — снижается до 5 г/л и становится соизмеримым с концентрациями стронция и брома. Ещё более яркий пример того, как второстепенный компонент становится главным и определяющим тип воды: на Ельской площади Припятского прогиба во внутрисолевом терригенном прослое на глубине около 2,5 км обнаружены рассолы с концентрацией аммония до 23 г/л. Эти рассолы следует определить как хлоридные аммониево–натриевые:
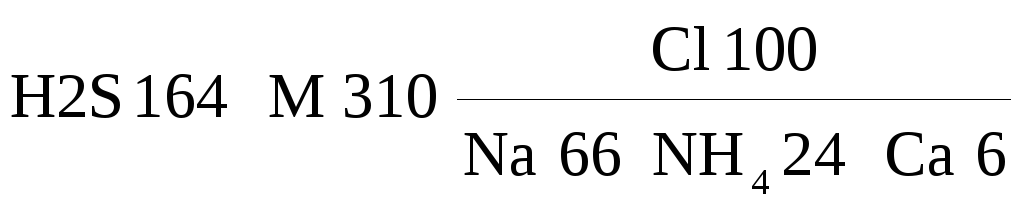 .
.
В.И. Вернадский писал, что “в земной коре нет воды, не заключающей в растворе определённого количества и определённого состава газов”. Поэтому кратко рассмотрим газовый состав подземных вод. Основными газами, содержащимися в подземных водах, являются кислород O2, азот N2, углекислота СО2, сероводород Н2S, водород Н2 и углеводороды (метан СН4 и более тяжелые ТУ). Кроме того, подземные воды содержат инертные газы — Не, Ne, Ar и др.
При изучении подземных вод важное значение имеет равновесие вода – газ. Обычно газ растворён в воде, но при его избытке часть его может находиться в свободном (спонтанном) состоянии, т.е. в виде мельчайших пузырьков в порах горных пород. Поглощение и выделение газа водой — процессы, которые могут спровоцироваться изменением ионно–солевого состава воды. Растворимость газов в воде зависит от температуры, давления и минерализации воды.
С ростом температуры примерно до 80–90 °С растворимость газов уменьшается, а при дальнейшем повышении температуры — увеличивается.
С увеличением давления растворимость газов возрастает. Именно поэтому воды кавказских минеральных источников газируют углекислотой. На глубине в этих водах растворено большое количество СO2; при выходе на поверхность снижается давление и уменьшается растворимость газа, который из растворённого состояния переходит в свободное.
Рост минерализации воды способствует снижению растворимости газов.
Наименьшей растворимостью в воде обладает гелий, а наибольшей сероводород.
По происхождению газы делятся на: 1) воздушные (N2, O2, СO2, Ne, Аr), проникающие в литосферу из атмосферного воздуха; 2) биохимические (СН4, СО2, N2, H2S, Н2, O2, ТУ), образующиеся при разложении микроорганизмами органических и минеральных веществ; 3) химические (СO2, H2S, Н2, СН4 и др.), образующиеся при взаимодействии воды и породы; 4) радиоактивного происхождения (Не, Rn, O2).
Кислород в подземных водах содержится в количествам до 15–20 мг/л. С глубиной его концентрация, как правило, уменьшается, так как он расходуется на окисление минеральных и органическим соединений. Вместе с тем, высокие концентрации кислорода обнаружены в рассолах на глубинах 2–3 км. Здесь он связан с разложением молекул воды под действием радиоактивного излучения (радиолиз воды).
Содержание углекислоты в подземных водах достигает 20 и даже 40 г/л. СО2 является участником реакций, определяющих одно из важнейших в природе карбонатных равновесий CO2 — CO32– — HCO3–.
Столь же важный агент химических реакций и сероводород, входящий в систему H2S — SO42–. Его концентрация в подземных водам достигает 3 г/л.
Азот очень широко распространён практически во всех типам подземных вод. Его обычная концентрация — десятки–сотни мг/л, максимальная — 1200 мг/л.
Углеводородные газы (СН4 и др.) обычно присутствуют в водах нефтегазоносных бассейнов. Их содержание может достигать 13000 см3 в литре.
Гелия в подземных водах немного (десятые доли – единицы см3/л). В последние годы он привлекает внимание как показатель глубинных разломов и предвеcтник землетрясений.
Газовый состав — один из основных компонентов минеральных (лечебных) подземных вод, в связи с чем по газовому составу выделяются типы минеральных вод: сероводородные, метановые, азотные, углекислые, радоновые. Радоновые, генетически связанные с кристаллическими породами фундамента, воды имеются в западной части Беларуси, где они используются в санаторной практике.
В подземных водах содержится широкая гамма разнообразных органических соединений. Это жирные, нафтеновые и карбоновые кислоты, битум, фенолы, бензол, толуол, аминокислоты, амины, спирты, сложные эфиры. Количественная характеристика органического вещества подземных вод выражается концентрацией органического углерода (Сорг), или величиной окисляемости — перманганатной, бихроматной и др. (в мг О/л). В подземных водах содержание Сорг колеблется от десятых долей до сотен мг/л. Наиболее обогащены органическим веществом воды нефтяных месторождений (до 800 мг/л).
Основными источниками поступления органических веществ в подземную воду являются почвы, горные породы, особенно торф, уголь, горючие сланцы, залежи нефти.
В подземных водах широко распространены разнообразные микроорганизмы, среди которых наиболее изучены аэробные и анаэробные бактерии. Первые развиваются при наличие свободного кислорода, который используется ими для дыхания, вторые черпают необходимый им кислород из кислородсодержащих органических (углеводы, спирты и др.) и минеральных (нитраты, сульфаты) соединений. Число бактерий в подземных водах колеблется в больших пределах — от нескольких тысяч до 2 млн клеток в 1 мл воды.
В грунтовых водах распространены гнилостные бактерии и сапрофиты, разлагающие вещества белкового характера. Более глубокие подземные воды характеризуются развитием бактерий, активно участвующим в окислительно–восстановительных реакциях. Это сульфатредуцирующие, метанообразующие, денитрифицирующие, тионовые и другие бактерии. Верхний предел температуры, при которой может протекать жизнедеятельность микрофлоры 80–90 °С. Минерализация воды и её химический состав не являются сдерживающим фактором для развития микроорганизмов. Существует ряд микроорганизмов, способных существовать при концентрации солей 300 г/л и более.
Химический состав природной воды
По своему химическому составу природные воды являются весьма разнообразными, в них содержится большинство известных химических соединений. Количество тех или иных химических веществ в воде зависит от многих условий, например, геологических, физико-географических и т.п.
По значению для организма человека химические вещества, встречающиеся в природной воде, можно разделить «на четыре основные группы.
К первой группе следует отнести вещества, являющиеся показателями возможного загрязнения воды патогенными микроорганизмами. К таким веществам относятся азотсодержащие соединения; органические вещества, обусловливающие так называемую окисляемость; хлориды, фосфаты, растворенный кислород и биохимическая потребность воды в кислороде (БПК), сероводород, показатель концентрации водородных ионов (рН).
Азот в воде может присутствовать в виде как органических, так и неорганических соединений. Органические соединения представлены так называемым альбуминовым азотом (низшие пептиды, аминокислоты, мочевина и т.п.). Однако, определение его в воде не нашло широкого распространения из-за сложности методики и трудности дифференцирования азота животного происхождения и растительного. На практике широко используется определение неорганических соединений азота: ионов аммония (NН4), ионов азотистой (NО3) и азотной (NО3) кислот. Они появляются в воде, главным образом, в результате конечного распада веществ белкового происхождения. Причем вначале образуется аммиак, затем под действием ферментов нитрифицирующих бактерий в присутствии достаточного количества кислорода аммиак окисляется до азотистой и азотной кислот.
Химический состав органических веществ весьма сложен и разнообразен. Они образуются в воде за счет жизнедеятельности водных организмов и растений, а также в результате их распада после отмирания. Органические вещества могут попадать в воду с атмосферными, ливневыми, хозяйственно-бытовыми и техническими сточными водами. Суммарное содержание органических веществ определяется по количеству миллиграммов кислорода, пошедшего на окисление в 1 л воды всех веществ, способных окисляться (окисляемость воды). Чистые подземные воды имеют окисляемость 1-2 мг/л О2; грунтовые воды — 2-4 мг/л и воды поверхностных водоисточников 6-8 мг/л О2.
Источником кислорода в природных водах является атмосфера и жизнедеятельность некоторых водных организмов.
Содержание кислорода в воде зависит от площади соприкосновения поверхности ее со свободной атмосферой, от температуры, давления, интенсивности биологических и биохимических процессов.
Подземные воды практически не содержат кислород. В поверхностных водах при слабом развитии биологических и биохимических процессов кислород находится в пределах 6-8 мг/л летом и 8-10 мг/л — зимой.
При интенсивно протекающих биологических процессах, сопровождающихся фотосинтезом, может иметь место перенасыщение воды кислородом (до 120-130 % от максимально возможного насыщения при данной температуре). И, наоборот, при интенсивно развитых биологических процессах окислительного характера содержание кислорода может снижаться до ничтожно малых величин.
Очень чистой считается вода, в которой количество кислорода за 5 суток уменьшилось на 1 мг в литре, чистая вода — 2 мг/л, довольно чистая — 3-4 мг/л, загрязненная — 4-5 мг/л и очень грязная — более 5 мг/л.
Соединения фосфора могут попасть в воду из земной коры, за счет распада органических веществ белковой природы и за счет смыва атмосферными водами фосфатных удобрений с полей. Однако большое количество фосфора может поступать с хозяйственно-бытовыми и техническими сточными водами. К примеру, в суточной моче человека содержится от 2 до 2,5 г фосфора, а в каловых массах — около 8 % от всего сухого содержимого. В связи с этим обстоятельством фосфорные соединения рассматриваются как один из показателей загрязнения воды экскрементами.
В большинстве природных вод сероводород отсутствует, значительное его количество (до 40 мг/л) может встречаться в некоторых водах глубокого грунтового происхождения. Гигиеническое значение сероводорода заключается в его влиянии на запах воды. Концентрация порядка 0,28 мг/л является крайним пределом переносимости. Источником появления сероводорода в воде могут служить органические вещества белковой природы.
Хлориды встречаются практически во всех природных водах в виде анионов хлора, соединенных с одним из катионов, чаще всего с натрием. Они попадают в воду из почвы, а также с хозяйственно-бытовыми и промышленными стоками. С одной стороны, они влияют на вкусовые свойства воды, с другой- могут служить показателем возможного загрязнения ее указанными выше стоками. Допускается содержание хлоридов в воде централизованного хозяйственно-питьевого водоснабжения до 350 мг/л.
Основными веществами, определяющими реакцию воды (рН), является угольная кислота и ее соли. Обычная величина рН природных вод колеблется от 6,5 до 8,5.
Гигиеническое значение рН заключается в том, что значительные колебания рН от обычных величин могут происходить вследствие попадания в воду промышленных и бытовых стоков, а в экстремальных ситуациях — различного рода химических веществ, в том числе сильнодействующих и отравляющих.
Ко второй группе относятся вещества, в известных концентрациях оказывающие вредное действие на организм человека. К этой группе относятся такие вещества, присутствие которых в воде во всех случаях нежелательно или должно быть строго ограничено. Одни из них имеют природное происхождение, другие представляют собой продукт производственной и бытовой деятельности людей.
К числу природных веществ отнесены бериллий, молибден, мышьяк, нитраты, свинец, селен, стронций и фтор. Сюда же можно отнести и радиоактивные природные вещества, обусловливающие фоновую радиоактивность воды. Конечно же, все эти вещества могут быть и хозяйственно-бытового происхождения. Продукты производственной деятельности людей включают большое количество органических и неорганических соединений, а также большую группу радиоактивных неприродных веществ.
К третьей группе относятся вещества, имеющие положительное биологическое значение. Сюда относятся некоторые минеральные вещества, присутствие которых в воде желательно в определенных концентрациях. К ним принадлежат фтор, железо, медь, йод, цинк, марганец, кремний, кобальт, молибден, селен, хром, никель, олово и ванадий. Конечно же, основным источником поступления их в организм является пища. Роль же воды известна лишь в отношении фтора, отчасти йода, в какой-то мере железа, марганца, меди, цинка и кремния.
Содержание фтора в природных водах колеблется от сотых долей до 5 и даже 12 мг/л. Кроме природного происхождения, фтор может попадать в водоисточники с промышленными стоками.
Физиолого-гигиеническое значение фтора определяется его влиянием на формирование костного аппарата и, в первую очередь, на ткани зубов. Недостаток поступления фтора в организм приводит к кариесу зубов. Избыточное количество фтора в воде свыше 2-5 мг/л также нежелательно. Считается, что в этих случаях могут возникать очаговые разрушения эмали зубов, а в дальнейшем всего зуба. Однако, в последние годы, американские исследователи пришли к выводу, что данная патология вызывается другими факторами, в частности, недостатком полноценных белков, кальция, магния и витаминов в пище. Ион фтора, наоборот, уменьшает вероятность проявления этого заболевания.
При недостаточном поступлении в организм йода у человека появляется зоб, называемый эндемическим, так как заболевание связано с определенной местностью. Основным поставщиком йода является пища, с водой в организм человека он поступает в количестве 4-5%. В то же время вода играет роль показателя обеспеченности йодом данной местности и вероятности возникновения зоба среди населения.
Содержание железа в поверхностных водах обычно небольшое, несколько больше его содержится в подземных водах (до десятков мг/л).
Биологическое значение железа очень велико. Оно входит в состав гемоглобина, ферментов, участвующих в тканевом дыхании, в состав клеточных ядер. Основным поставщиком железа является пища, с питьевой водой поступает 10-15 % от его общего количества. Токсическим действием железо почти не обладает. Длительное потребление его в количестве 300 мг в день вызывало лишь явления легкого гастроэнтерита.
Присутствие больших количеств (более 1 мг/л) железа в воде считается нежелательным, главным образом, из-за ухудшения физических свойств воды и вяжущего привкуса.
Значение марганца для человека установлено сравнительно недавно, в 1972 году. При его недостатке наблюдается задержка развития костного аппарата, умственная отсталость, стерильность, гипохромазия волос и другие расстройства. В больших количествах (более 0,5 мг/л) марганец изменяет окраску воды, придает ей вяжущий привкус и вызывает появление коричневых пятен на белье при его стирке. Токсичность марганца при пероральном потреблении очень незначительна.
В природных водах медь содержится в пределах от 20 до 400 мкг/л. Медь стимулирует созревание эритроцитов, гормональную активность передней доли гипофиза, способствует переходу железа из неорганических молекул в железо-парафины. При дефиците меди возникает анемия, остеопороз, атаксия, альбинизм, слабоумие, потеря эластичности стенок крупных сосудов.
К истинному биоэлементу относится также цинк, который входит в состав многих ферментов, гормона поджелудочной железы, обладает липотропным и антихолистеринемическим действием, усиливает толерантность к инфекциям и способствует усвоению белков. При его недостатке возникает потеря обоняния и вкуса, затрудняется имплантация зародышей, замедляется рост. Употребление воды, содержащей до 30 мг/л цинка никакого отрицательного действия на людей не оказывает. Токсическое действие наступает при концентрациях порядка сотен и тысяч мг/л.
К четвертой группе относятся химические вещества индифферентные и даже полезные для организма. К этой группе веществ относятся такие, отсутствие или наличие которых не сказывается на качестве воды, и только по достижении определенных концентраций они ухудшают органолептические (вкус, запах) или физические (прозрачность, цветность) свойства воды. К таким веществам принадлежат: сульфаты, карбонаты и гидрокарбонаты, ионы кальция, магния, натрия, калия, свободная углекислота, гумусовые вещества, коллоидные взвеси кремния и окиси алюминия, а также сухой остаток и показатель общей минерализации.
Химический состав природных вод
Перечень необходимых для усвоения знаний
В результате освоения материалов раздела студенты должны
знать:
– основные естественные и антропогенные процессы, обуславливающие физические свойства и химический состав природных вод;
– основные вещества, присутствующие в воде водоемов;
– классификацию вод по степени солености;
– источники образования сточных вод;
– особенности химического состава воды р. Кама.
Вода занимает особое место среди природных богатств Земли – она незаменима. Вода будет необходима во все века и всюду, где существуют земные формы жизни.
Вода является одним из наиболее распространенных и важнейших веществ на Земле. В природных условиях вода не встречается в химически чистом состоянии. В результате постоянного соприкосновения с различными веществами она представляет собою раствор весьма сложного состава. Состав природной воды зависит от химических и физико-химических процессов, главные из которых растворение твердых веществ водой, выделение из раствора осадков, поглощение газов, обмен ионами между твердым веществом и раствором, процессы гидролиза, комплексообразования, окислительно-восстановительные процессы. На формирование состава природных вод также влияют биохимические процессы. К ним относятся минерализация органического вещества; фотосинтез, определяющий состав растворенных газов и появление в природной воде органического вещества; биохимические процессы с участием неорганических соединений, например, образование аммиака, нитритов, нитратов, сероводорода и др. В результате абиотических и биотических процессов может существенно изменяться токсичность веществ в воде и степень загрязнения ими водоема. Так, процессы биометилирования ртути приводят к образованию из неорганических солей более токсичных липофильных продуктов, способных как к кумуляции в организмах гидробионтов, так и к улетучиванию.
1.1. Основные этапы формирования химического состава природных вод
Процесс формирования химического состава природных вод осуществляется в несколько этапов, на каждом из которых определяющую роль играют различные факторы.
Первым этапом формирования поверхностных вод является взаимодействие их с атмосферой. Еще находясь в атмосфере, мельчайшие капли воды при своем падении на Землю увлекают из воздуха различные вещества. Источником минерального состава атмосферных осадков являются вулканические выбросы, оксиды азота, образующиеся при грозовых разрядах, а также антропогенное загрязнение воздуха, обусловленное промышленными выбросами и работой автотранспорта. В состав атмосферных осадков входят и радиоактивные загрязнения, и пестициды.
Общее количество веществ, растворенных и взвешенных в дождевой воде, колеблется в пределах 10 – 20 мг/дм3. Это, прежде всего, газы – азот, кислород, диоксид углерода, оксиды азота и серы, ионы солей (SO42–,Cl–,HCO3–,NO3–,NH4+,Ca2+,Mg2+,Na+). Кроме того, дождевые воды содержат микроорганизмы и пыль в виде механических примесей.
Вторымэтапом формирования состава природных вод является взаимодействие выпавших атмосферных осадков с почвенным покровом, при этом важную роль играет наличие растительности и ее характер. Приобретаемый при соприкосновении с почвой химический состав воды зависит от характера почвы. Вода, фильтруясь через почву, выщелачивает ее растворимые части, изменяя при этом свой состав: увеличивается содержание ионов и органических веществ, изменяется содержание растворенных газов. При взаимодействии воды с почвой содержание кислорода в воде уменьшается, а оксида углерода (IV) увеличивается, что объясняется окислением органических веществ. Наряду с растворением солей наблюдаются явления адсорбции и ионного обмена. Если вода фильтруется через бедные солями торфянисто-тундровые или болотные почвы, то она обогащается большим количеством органических веществ и лишь незначительно — ионами. Больше обогащают ионами воду черноземные и каштановые почвы, еще больше солонцеватые. Значительной ионообменной способностью обладают многие почвы, в особенности чернозем и торф, что связано с наличием в них гуминовых кислот.
Третьими основным этапом формирования химического состава природных вод является их взаимодействие с минералами литосферы. Породы, слагающие земную кору, могут обогащать природные воды солями в результате выветривания изверженных и образовавшихся из них обломочных пород и растворения солей, находящихся в осадочных породах.
Основная часть минералов, образовавшихся в глубинных слоях Земли, попав в условия биосферы, начинает постепенно изменяться и разрушаться. Это разрушение называют выветриванием. В зависимости от того, какому агенту принадлежит ведущая роль в разрушении горных пород, различают:
физическое выветривание;
химическое выветривание;
биологическое выветривание.
Обычно они происходят одновременно. Химическое выветривание горных пород происходит под действием воды и воздуха в результате различных химических реакций, прежде всего гидролиза, гидратации, ионного обмена, окисления, карбонатизации и обычного химического растворения.
Для минерализации воды особое значение имеет выветривание различных алюмосиликатов, которые разлагаются, главным образом при гидролизе. Так, гидролиз обычного полевого шпата (ортоклаза) приводит к образованию нового силиката – каолина, составляющего основу различных глин:
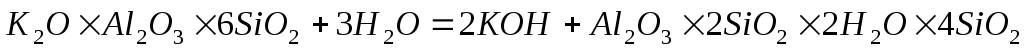
Разложение плагиоклаза под действием воды, содержащей диоксид углерода, может быть представлено следующими схемами
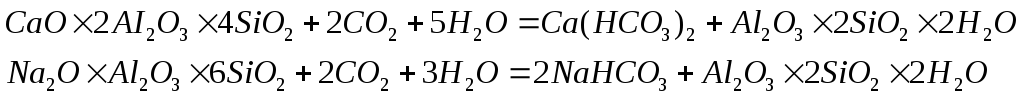
Выветриванию подвергаются и сульфиды металлов, причем в этом случае процесс ускоряется за счет окислительного действия кислорода. В результате окисления сульфидов тяжелых металлов получаются сульфаты металлов и (или) серная кислота, например:
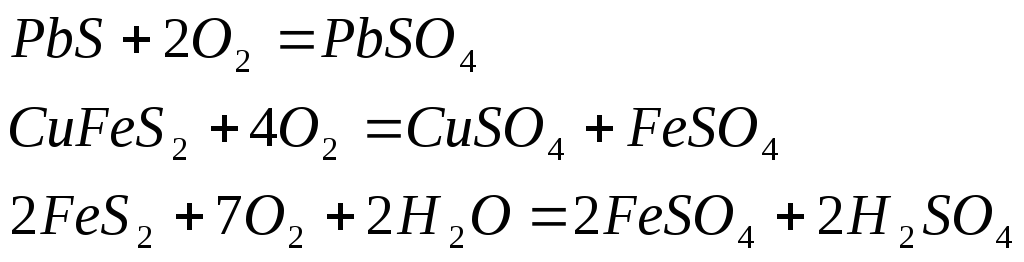
С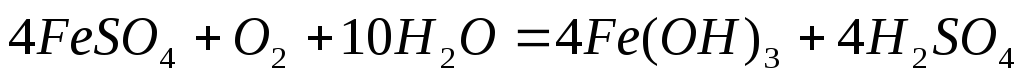 ульфаты
железа (II) окисляются,
образуя гидроксид железа (III)
ульфаты
железа (II) окисляются,
образуя гидроксид железа (III)
Серная кислота энергично взаимодействует с горными породами, особенно карбонатными, при этом образуются более растворимые по сравнению с карбонатами сульфаты и углекислый газ.
Растворимыми продуктами процессов выветривания являются соли Са(НСО3)2,Mg(HCO3)2,NaHCO3,KHCO3,K2SO4,MgSO4,NaCl, а также производные кремневой кислоты и микроэлементы, что приводит к накоплению в воде ионов Са2+,Mg2+, К+,Na+, НСО3–,Cl–,SO42–.
Продукты выветривания в течение геологических периодов извлекались текучими водами. Часть ионов при этом аккумулировались в бессточных областях, другая выносилась в океан. В формировании анионного состава природных вод важную роль сыграли выделяющиеся при вулканических извержениях газы: сероводород, аммиак, хлористый водород, оксид серы (IV). Наряду с многовековой аккумуляцией ионов в океане происходило и происходит в настоящее время выделение их из морской воды в виде солей и осадков. В результате геотектонических причин выпавшие на дно соли со временем оказались на суше, образуя залежи осадочных пород. Под действием текучих вод морские отложения легко растворимых солей вновь растворялись и переносились в океан. Таким образом, между материком и океаном существует непрерывный обмен солями.
П омимо
прямого растворения в воде, породы могут
обмениваться своими ионами с ионами
воды.
омимо
прямого растворения в воде, породы могут
обмениваться своими ионами с ионами
воды.
Свой отпечаток на формирование химического состава природных вод наложило и развитие жизни на Земле. Разложение в почвах растительных остатков, приводящее к образованию СО2и органических кислот, ускорило процессы химического растворения минералов в почвах и подстилающих породах. Минерализации природных вод способствует и деятельность почвенных микроорганизмов, перерабатывающих органические вещества.
Непосредственное воздействие на химический состав природных вод оказывает хозяйственная деятельность человека, т.к. сбрасываемые в водоемы бытовые и промышленные сточные воды резко изменяют естественный химический состав вод. Особенно большое влияние на изменение химического состава природных вод оказывают сточные воды целлюлозно-бумажной, химической и нефтехимической промышленности, предприятий черной и цветной металлургии, коммунально-бытового хозяйства, а также смыв минеральных и органических удобрений, балластных веществ, пестицидов с полей в реки, озера, моря и их вымывание по профилю почв до грунтовых вод.