Вода — Википедия
| Вода | |||
|---|---|---|---|
| |||
Вода в бассейне({{{изображение}}}) | |||
| Систематическое наименование | Оксид водорода Вода[1] | ||
| Традиционные названия | вода | ||
| Хим. формула | H2O | ||
| Состояние | жидкость | ||
| Молярная масса | 18,01528 г/моль | ||
| Плотность | 0,9982 г/см3[2] | ||
| Твёрдость | 1,5[4] | ||
| Динамическая вязкость | 0,00101 Па·с | ||
| Кинематическая вязкость | 0,01012 см²/с (при 20 °C) | ||
| Скорость звука в веществе | (дистиллированная вода) 1348 м/с | ||
| Температура | |||
| • плавления | 273,1 K (0 ° C) | ||
| • кипения | 373,1 K (99,974 ° C) °C | ||
| • разложения | 2200 °C | ||
| Тройная точка | 273,2 K (0,01 ° C), 611,72 Па | ||
| Критическая точка | 647,1 K (374 ° C), 22,064 МПа | ||
| Мол. теплоёмк. | 75,37 Дж/(моль·К) | ||
| Теплопроводность | 0,56 Вт/(м·K) | ||
| Энтальпия | |||
| • образования | -285,83 кДж/моль | ||
| Удельная теплота испарения | 2256,2 кДж/кг[3] | ||
| Удельная теплота плавления | 332,4 кДж/кг[3] | ||
| Показатель преломления | 1,3945, 1,33432, 1,32612, 1,39336, 1,33298 и 1,32524 | ||
| Рег. номер CAS | 7732-18-5 | ||
| PubChem | 962 | ||
| Рег. номер EINECS | |||
| SMILES | |||
| InChI | |||
| RTECS | ZC0110000 | ||
| ChEBI | 15377 | ||
| ChemSpider | 937 | ||
| NFPA 704 |  | ||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
 | |||
 71 % поверхности Земли покрывает вода
71 % поверхности Земли покрывает водаВода́ (оксид водорода) — бинарное неорганическое соединение с химической формулой H2O: молекула воды состоит из двух атомов водорода и одного — кислорода, которые соединены между собой ковалентной связью. При нормальных условиях представляет собой прозрачную жидкость, не имеющую цвета (при малой толщине слоя), запаха и вкуса. В твёрдом состоянии называется льдом (кристаллы льда могут образовывать снег или иней), а в газообразном — водяным паром. Вода также может существовать в виде жидких кристаллов (на гидрофильных поверхностях)
Вода является хорошим сильнополярным растворителем. В природных условиях всегда содержит растворённые вещества (соли, газы).
Исключительно важна роль воды в глобальном кругообороте вещества и энергии[7], возникновении и поддержании жизни на Земле, в химическом строении живых организмов, в формировании климата и погоды. Вода является важнейшим веществом для всех живых существ на Земле[8].
Всего на Земле около 1400 млн км³ воды. Вода покрывает 71 % поверхности земного шара (океаны, моря, озёра, реки, льды — 361,13 млн км²[9][10]
Происходит от др.-русск. вода, далее от праславянского *voda[13] (ср. ст.-слав. вода, болг. вода́, сербохорв. во̀да, словен. vóda, чеш. voda, слвц. voda, польск. woda, в.-луж., н.-луж. woda), затем от праиндоевропейского *wed-, родственно лит.
С формальной точки зрения вода имеет несколько различных корректных химических названий:
- Оксид водорода: бинарное соединение водорода с атомом кислорода в степени окисления −2, встречается также устаревшее название окись водорода.
- Гидроксид водорода: соединение гидроксильной группы OH— и катиона (H+)
- Гидроксильная кислота: воду можно рассматривать как соединение катиона H+, который может быть замещён металлом, и «гидроксильного остатка» OH—
- Монооксид дигидрогена
- Дигидромонооксид
Физические свойства[править | править код]
При переходе в твёрдое состояние молекулы воды упорядочиваются, при этом объёмы пустот между молекулами увеличиваются, и общая плотность воды падает, что и объясняет меньшую плотность (больший объём) воды в фазе льда. При испарении, напротив, все водородные связи рвутся. Разрыв связей требует много энергии, отчего у воды самая большая удельная теплоёмкость среди прочих жидкостей и твёрдых веществ. Для того чтобы нагреть один литр воды на один градус, требуется затратить 4,1868 кДж энергии. Благодаря этому свойству вода нередко используется как теплоноситель.
Помимо большой удельной теплоёмкости, вода также имеет большие значения удельной теплоты плавления (333,55 кДж/кг при 0 °C) и парообразования (2250 кДж/кг).
| Температура, °С | Удельная теплоёмкость воды, кДж/(кг*К) |
|---|---|
| -60 (лёд) | 1,64 |
| -20 (лёд) | 2,01 |
| -10 (лёд) | 2,22 |
| 0 (лёд) | 2,11 |
| 0 (чистая вода) | 4,218 |
| 10 | 4,192 |
| 20 | 4,182 |
| 4,178 | |
| 60 | 4,184 |
| 80 | 4,196 |
| 100 | 4,216 |
Физические свойства разных изотопных модификаций воды при различных температурах[19]:
| Модификация воды | Максимальная плотность при температуре, °С | Тройная точка при температуре, °С |
|---|---|---|
| Н2O | 3,9834 | 0,01 |
| D2O | 11,2 | 3,82 |
| T2O | 13,4 | 4,49 |
| Н218O | 4,3 | 0,31 |
Вода обладает также высоким поверхностным натяжением, уступая в этом только ртути
Вода является хорошим растворителем полярных веществ. Каждая молекула растворяемого вещества окружается молекулами воды, причём положительно заряженные участки молекулы растворяемого вещества притягивают атомы кислорода, а отрицательно заряженные — атомы водорода. Поскольку молекула воды мала по размерам, много молекул воды могут окружить каждую молекулу растворяемого вещества.
Это свойство воды используется живыми существами. В живой клетке и в межклеточном пространстве вступают во взаимодействие растворы различных веществ в воде[23]. Вода необходима для жизни всех без исключения одноклеточных и многоклеточных живых существ на Земле.
Вода обладает отрицательным электрическим потенциалом поверхности.
 Капля, ударяющаяся о поверхность воды
Капля, ударяющаяся о поверхность водыЧистая вода — хороший изолятор. При нормальных условиях вода слабо диссоциирована и концентрация протонов (точнее, ионов гидроксония H3O+) и гидроксильных ионов OH− составляет 10-7 моль/л. Но поскольку вода — хороший растворитель, в ней практически всегда растворены те или иные соли, то есть присутствуют другие положительные и отрицательные ионы. Благодаря этому вода проводит электричество. По электропроводности воды можно определить её чистоту.
Вода имеет показатель преломления n=1,33 в оптическом диапазоне. Однако она сильно поглощает инфракрасное излучение, и поэтому водяной пар является основным естественным парниковым газом, отвечающим более чем за 60 % парникового эффекта. Благодаря большому дипольному моменту молекул, вода также поглощает микроволновое излучение, на чём основан принцип действия микроволновой печи.
Агрегатные состояния[править | править код]
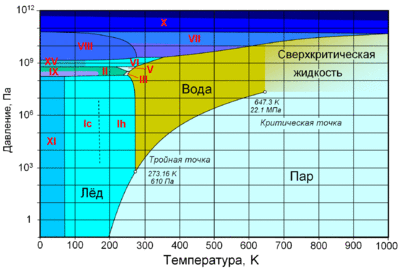
По состоянию различают:

При нормальном атмосферном давлении (760 мм рт. ст., 101 325 Па) вода переходит в твёрдое состояние при температуре в 0 °C и кипит (превращается в водяной пар) при температуре 100 °C (значения 0 °C и 100 °C были выбраны как соответствующие температурам таяния льда и кипения воды при создании температурной шкалы «по Цельсию»). При снижении давления температура таяния (плавления) льда медленно растёт, а температура кипения воды — падает. При давлении в 611,73 Па (около 0,006 атм) температура кипения и плавления совпадает и становится равной 0,01 °C. Такие давление и температура называются тройной точкой воды. При более низком давлении вода не может находиться в жидком состоянии, и лёд превращается непосредственно в пар. Температура возгонки (сублимации) льда падает со снижением давления. При высоком давлении существуют модификации льда с температурами плавления выше комнатной.
С ростом давления температура кипения воды растёт[24]:
| Давление, атм. | Температура кипения (Ткип), °C |
|---|---|
| 0,987 (105 Па — нормальные условия) | 99,63 |
| 1 | 100 |
| 2 | 120 |
| 6 | 158 |
| 218,5 | 374,1 |
При росте давления плотность насыщенного водяного пара в точке кипения тоже растёт, а жидкой воды — падает. При температуре 374 °C (647 K) и давлении 22,064 МПа (218 атм) вода проходит критическую точку. В этой точке плотность и другие свойства жидкой и газообразной воды совпадают. При более высоком давлении и/или температуре исчезает разница между жидкой водой и водяным паром. Такое агрегатное состояние называют «сверхкритическая жидкость».
Вода может находиться в метастабильных состояниях — пересыщенный пар, перегретая жидкость, переохлаждённая жидкость. Эти состояния могут существовать длительное время, однако они неустойчивы и при соприкосновении с более устойчивой фазой происходит переход. Например, можно получить переохлаждённую жидкость, охладив чистую воду в чистом сосуде ниже 0 °C, однако при появлении центра кристаллизации жидкая вода быстро превращается в лёд.
Оптические свойства[править | править код]
Они оцениваются по прозрачности воды, которая, в свою очередь, зависит от длины волны излучения, проходящего через воду. Вследствие поглощения оранжевых и красных компонентов света вода приобретает голубоватую окраску. Вода прозрачна только для видимого света и сильно поглощает инфракрасное излучение, поэтому на инфракрасных фотографиях водная поверхность всегда получается чёрной. Ультрафиолетовые лучи легко проходят через воду, поэтому растительные организмы способны развиваться в толще воды и на дне водоёмов, инфракрасные лучи проникают только в поверхностный слой. Вода отражает 5 % солнечных лучей, в то время как снег — около 85 %. Под лёд океана проникает только 2 % солнечного света.
Изотопные модификации[править | править код]
И кислород, и водород имеют природные и искусственные изотопы. В зависимости от типа изотопов водорода, входящих в молекулу, выделяют следующие виды воды:
Последние три вида возможны, так как молекула воды содержит два атома водорода. Протий — самый лёгкий изотоп водорода, дейтерий имеет атомную массу 2,0141017778 а. е. м., тритий — самый тяжёлый, атомная масса 3,0160492777 а. е. м. В воде из-под крана тяжелокислородной воды (H2O17 и H2O18) содержится больше, чем воды D2O16: их содержание, соответственно, 1,8 кг и 0,15 кг на тонну[18].
Хотя тяжёлая вода часто считается мёртвой водой, так как живые организмы в ней жить не могут, некоторые микроорганизмы могут быть приучены к существованию в ней[18].
По стабильным изотопам кислорода 16O, 17O и 18O существуют три разновидности молекул воды. Таким образом, по изотопному составу существуют 18 различных молекул воды. В действительности любая вода содержит все разновидности молекул.
Химические свойства[править | править код]
Вода является наиболее распространённым растворителем на планете Земля, во многом определяющим характер земной химии, как науки. Большая часть химии, при её зарождении как науки, начиналась именно как химия водных растворов веществ.
Её иногда рассматривают как амфолит — и кислоту и основание одновременно (катион H+анион OH−). В отсутствие посторонних веществ в воде одинакова концентрация гидроксид-ионов и ионов водорода (или ионов гидроксония), pKa ≈ 16.
Вода — химически активное вещество. Сильно полярные молекулы воды сольватируют ионы и молекулы, образуют гидраты и кристаллогидраты. Сольволиз, и в частности гидролиз, происходит в живой и неживой природе, и широко используется в химической промышленности.
Воду можно получать:
- в ходе реакций —
- 2h3O2→2h3O+O2↑{\displaystyle {\mathsf {2H_{2}O_{2}\rightarrow 2H_{2}O+O_{2}\uparrow }}}
- NaHCO3+Ch4COOH→Ch4COONa+h3O+CO2↑{\displaystyle {\mathsf {NaHCO_{3}+CH_{3}COOH\rightarrow CH_{3}COONa+H_{2}O+CO_{2}\uparrow }}}
- 2Ch4COOH+CaCO3→Ca(Ch4COO)2+h3O+CO2↑{\displaystyle {\mathsf {2CH_{3}COOH+CaCO_{3}\rightarrow Ca(CH_{3}COO)_{2}+H_{2}O+CO_{2}\uparrow }}}
- h3SO4+2KOH→K2SO4+2h3O{\displaystyle {\mathsf {H_{2}SO_{4}+2KOH\rightarrow K_{2}SO_{4}+2H_{2}O}}}
- HNO3+Nh5OH→Nh5NO3+h3O{\displaystyle {\mathsf {HNO_{3}+NH_{4}OH\rightarrow NH_{4}NO_{3}+H_{2}O}}}
- 2Ch4COOH+Ba(OH)2→Ba(Ch4COO)2+2h3O{\displaystyle {\mathsf {2CH_{3}COOH+Ba(OH)_{2}\rightarrow Ba(CH_{3}COO)_{2}+2H_{2}O}}}
- Восстановлением водородом оксидов металлов —
- CuO+h3→Cu+h3O{\displaystyle {\mathsf {CuO+H_{2}\rightarrow Cu+H_{2}O}}}
Под воздействием очень высоких температур или электрического тока (при электролизе)[25], а также под воздействием ионизирующего излучения, как установил в 1902 году[26]Фридрих Гизель[en] при исследовании водного раствора бромида радия[27], вода разлагается на молекулярный кислород и молекулярный водород:
- 2h3O→2h3↑+O2↑{\displaystyle {\mathsf {2H_{2}O\rightarrow 2H_{2}\uparrow +O_{2}\uparrow }}}
Вода реагирует при комнатной температуре:
- 2h3O+2Na→2NaOH+h3↑{\displaystyle {\mathsf {2H_{2}O+2Na\rightarrow 2NaOH+H_{2}\uparrow }}}
- со фтором и межгалоидными соединениями
- 2h3O+2F2→4HF+O2{\displaystyle {\mathsf {2H_{2}O+2F_{2}\rightarrow 4HF+O_{2}}}}
- h3O+F2→HF+HOF{\displaystyle {\mathsf {H_{2}O+F_{2}\rightarrow HF+HOF}}} (при низких температурах)
- 3h3O+2IF5→5HF+HIO3{\displaystyle {\mathsf {3H_{2}O+2IF_{5}\rightarrow 5HF+HIO_{3}}}}
- 9h3O+5BrF3→15HF+Br2+3HBrO3{\displaystyle {\mathsf {9H_{2}O+5BrF_{3}\rightarrow 15HF+Br_{2}+3HBrO_{3}}}}
- с солями, образованными слабой кислотой и слабым основанием, вызывая их полный гидролиз
- Al2S3+6h3O→2Al(OH)3↓+3h3S↑{\displaystyle {\mathsf {Al_{2}S_{3}+6H_{2}O\rightarrow 2Al(OH)_{3}\downarrow +3H_{2}S\uparrow }}}
- с ангидридами и галогенангидридами карбоновых и неорганических кислот
- с активными металлорганическими соединениями (диэтилцинк, реактивы Гриньяра, метилнатрий и т. д.)
- с карбидами, нитридами, фосфидами, силицидами, гидридами активных металлов (кальция, натрия, лития и др.)
- со многими солями, образуя гидраты
- с боранами, силанами
- с кетенами, недоокисью углерода
- с фторидами благородных газов
Вода реагирует при нагревании:
- 4h3O+3Fe→Fe3O4+4h3{\displaystyle {\mathsf {4H_{2}O+3Fe\rightarrow Fe_{3}O_{4}+4H_{2}}}}
- h3O+C⇄ CO+h3{\displaystyle {\mathsf {H_{2}O+C\rightleftarrows \ CO+H_{2}}}}
- с некоторыми алкилгалогенидами
Вода реагирует в присутствии катализатора:
- с амидами, эфирами карбоновых кислот
- с ацетиленом и другими алкинами
- с алкенами
- с нитрилами
Волновая функция основного состояния воды[править | править код]
В валентном приближении электронная конфигурация молекулы h3O{\displaystyle {\ce {h3O}}} в основном состоянии: (1a1)1(1b2)2(1b1)2(2b2)0(3a1)0.{\displaystyle (1a_{1})^{1}(1b_{2})^{2}(1b_{1})^{2}(2b_{2})^{0}(3a_{1})^{0}.} Молекула имеет замкнутую оболочку, неспаренных электронов нет. Заняты электронами четыре молекулярные орбитали (МО) — по два электрона на каждой МО ϕi{\displaystyle \phi _{i}}, один со спином α{\displaystyle \alpha }, другой со спином β{\displaystyle \beta }, или 8 спин-орбиталей ψ{\displaystyle \psi }. Волновая функция молекулы, Ψ{\displaystyle \Psi }, представленная единственным детерминантом Слэтера Ф, имеет вид
|ϕ1a1(1)α(1)ϕ1a1(1)β(1)ϕ1b2(1)α(1)…ϕ1b1(1)β(1)ϕ1a1(2)α(2)ϕ1a1(2)β(2)ϕ1b2(2)α(2)…ϕ1b1(2)β(2)ϕ1a1(3)α(3)ϕ1a1(3)β(3)ϕ
«Вода России» — Химический состав воды
Хими́ческий соста́в воды́ – совокупность находящихся в воде веществ в различных химических и физических состояниях.
Общеизвестна химическая формула воды – Н2О. Однако до конца XVIII в. считалось, что вода является неделимым веществом. В 1781 г. английский ученый Генри Кавендиш доказал, что вода состоит из двух элементов, которые позже французский учёный Антуан Лавуазье назвал кислородом и водородом. Дальнейшие исследования показали, что вещество «вода» обладает уникальной структурой и не менее уникальными свойствами. Во-первых, она состоит из соединения двух газов, причем никакие другие газы, смешиваясь между собой, не образуют жидкость. Во-вторых, вода имеет максимальную плотность при 4°С, благодаря чему лёд плавает на её поверхности и предохраняет её от полного замерзания. В-третьих, вода меняет удельную теплоёмкость в интервале от точки плавления (0°С) до точки кипения (100°С). Наименьшая удельная теплоёмкость приходится на интервал в 30–40°С. Последнее обстоятельство во многом определило пути эволюции: этот интервал – температура тела теплокровных животных.
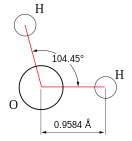
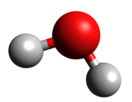
Большинство необычных свойств воды определяется строением её молекулы, физической природой составляющих её атомов и компоновкой самих молекул. Молекула воды напоминает равнобедренный треугольник, в основании которого расположены ядра атома водорода, а в вершине – ядро атома кислорода. Поэтому молекула воды характеризуется значительной полярностью: отрицательный и положительный заряды в ней разнесены. В результате молекулы воды способны ассоциировать, то есть образовывать группировки, называемыми кластерами.
Атомы водорода и кислорода имеют несколько природных изотопов. Например, у водорода их три: обычный водород (протий), тяжёлый водород (дейтерий) и сверхтяжёлый радиоактивный водород (тритий).
В природе наиболее распространена вода, состоящая из обычных изотопов кислорода и водорода (99,73%). Тяжёлая вода (оксид дейтерия) внешне выглядит, как обычная. Тяжёлая вода используется в ядерных реакторах для торможения нейтронов. Сверхтяжёлую воду применяют в термоядерных реакциях.
Из химических свойств воды следует отметить одно из самых важных – способность растворять твёрдые вещества и вымывать их, поэтому в водных объектах, поверхностных и подземных, обнаружены почти все известные науке химические элементы. Механизмом растворения многих кристаллических солей является гидролитическая диссоциация, когда молекула соли распадается на ионы с положительным и отрицательным зарядом – соответственно на катионы и анионы. Поскольку вода – диполь, ионы окружают молекулы воды, формируя так называемую гидратную оболочку. Силы взаимодействия ионов с молекулами воды достаточно велики. Вот почему в состав многих минералов входит вода.
Процесс, обратный растворению – осаждение (седиментация), т.е. выпадение веществ из водного раствора. Благодаря этому процессу образовались месторождения солей хлоридов натрия, калия, магния и многих других. Возникают трудности в использовании для хозяйственных целей воды с высоким содержанием растворённых солей. Так, высокое содержание солей магния и кальция, так называемых солей жёсткости, приводит к образованию накипи, ухудшает качество питьевой воды и не позволяет использовать такую воду в ряде производств.
В процессе природного круговорота вода, соприкасаясь со всевозможными веществами, становится раствором различного, зачастую очень сложного состава. Наименьшая концентрация растворённых веществ (десятки миллиграмм в литре) отмечается в атмосферных осадках, ледниках и снежниках, поскольку при испарении вода теряет бόльшую часть растворённых в ней веществ. Однако при выпадении в виде дождя или снега вода поглощает аэрозоли и пыль, которые содержатся в атмосфере. Поэтому в местах, где сильно загрязнена атмосфера, осадки становятся источниками загрязнения водных объектов. Количественный показатель содержания растворённых в воде веществ называется общей минерализацией и выражается величиной мг/л или г/л. Содержание растворённых веществ в воде морей и океанов выражают также в относительных единицах, как правило, в промилле (‰), то есть г/кг, и называют солёностью (иногда – минерализацией). Если в одном литре природной воды содержится до 1 г (1000 мг) растворённых веществ, её считают пресной, от 1 до 25 г – солоноватой, от 25 до 50 г – солёной (или морской солёности) и выше 50 г – высокосолёной (или рассолом). Если выделить из океанской воды все соли, они покрыли бы поверхность земного шара слоем стометровой толщины.
Важнейшее свойство природной воды заключается в том, что она является «буфером» в отношении кислотности. Свойство буферности кислотности – это способность воды сохранять более или менее неизменным содержание ионов водорода (Н+), т.е. сохранять значение рН при попадании в неё определенного количества кислоты или основания, которые нейтрализуются растворёнными в ней углекислым газом и гидрокарбонат-ионами. С концентрацией гидрокарбонат-ионов напрямую связана устойчивость состава природной воды к кислотным дождям.
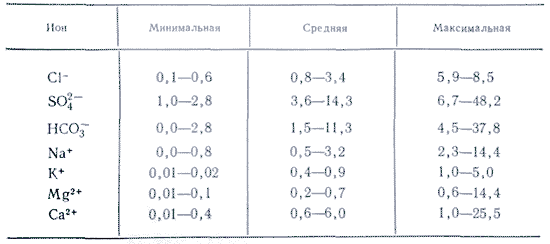
В водных растворах подавляющее большинство солей существуют в виде ионов. В природных водах преобладают три аниона (гидрокарбонат HCO3–, хлорид Cl– и сульфат SO42-) и четыре катиона (кальций Ca2+, магний Mg2+, натрий Na+ и калий K+) – их называют главными ионами. Хлорид-ионы придают воде солёный вкус, сульфат-ионы, ионы кальция и магния – горький; гидрокарбонат-ионы безвкусны. Они составляют в пресных водах свыше 90% всех растворённых веществ. В ряде случаев к главным компонентам можно отнести также калий, бром, стронций и др.
Под влиянием климатических и других условий химический состав природных вод изменяется и приобретает черты, характерные для различных видов природных вод (атмосферные осадки, реки, озёра, подземные воды).
Вещества, содержащиеся в природных и техногенных водах, можно условно разделить на классы. По составу: органические и минеральные; по форме нахождения: растворённые и взвешенные; по происхождению: природные и антропогенные; по действию на живые организмы: токсичные и нетоксичные; по концентрации: макроэлементы – мезоэлементы – микроэлементы. В воде могут быть растворены газы (кислород, углекислый газ, азот, сероводород, метан и пр.).
Химический состав природной воды определяет путь, совершённый водой в процессе своего круговорота и течения по поверхности Земли. Количество растворённых и взвешенных веществ в воде зависит, во-первых, от состава пород, с которыми она соприкасалась, во-вторых, от природно-климатических условий бассейна, в третьих, от уровня антропогенной нагрузки на бассейн водного объекта, в-четвёртых, от населяющих водные объекты живых организмов.
Воды большинства чистых рек принадлежат к гидрокарбонатному классу, с преобладанием ионов кальция. Реки сульфатного и хлоридного классов сравнительно малочисленны. Они распространены преимущественно в степной полосе и полупустынях. Преобладающими катионами природных вод хлоридного класса являются, главным образом, ионы натрия. Воды хлоридного класса отличаются высокой минерализацией.
В случае, если промышленные и бытовые стоки (очищенные или частично очищенные) составляют значительную часть стока реки, они заметно влияют на катионно-анионный состав. Например, вода р. Москвы от гидрокарбонатно-кальциевого на входе в город меняет свой состав при выходе из города на воду с составом катионов: Na→K→Ca→Mg→NH4+ и составом анионов: HCO→Cl–→SO→NO→PO.
Минерализация и химический состав воды озёр в отличие от рек меняются в очень широких пределах. Различие в минерализации отражается и на ионном составе воды озёр. С увеличением минерализации озёрной воды происходит относительный рост ионов в её составе в такой последовательности: для анионов HCO→SO→Cl–; для катионов Ca2+→Mg2+→Na+.
Состав морской воды характеризуется большим содержанием солей. Если в водах материкового стока чаще всего наблюдается соотношение концентраций: HCO3— →SO42-→Cl— и Ca2+→Mg2+→Na+ или Ca2+→Na+→Mg2+, то для морских вод, начиная с общей минерализации 1 г/кг, соотношения меняются: Cl–→SO→HCO и Na+→Mg2+→Ca2+. Концентрации микроэлементов обычно очень малы, в сумме они не превышают 0,01% массы всех растворённых солей. Чем более изолировано море от океана, тем заметнее отличается состав его воды от состава воды в океане. Первостепенное значение имеют условия водообмена с океаном, соотношение объёма материкового стока с объёмом моря, глубина моря и характер химического состава вод впадающих рек.
Подземные воды отличаются исключительным разнообразием химического состава, в том числе и ионного. Ионный состав подземных вод прежде всего зависит от условий их формирования и залегания.
В настоящее время состав поверхностных вод в густо населённых районах мира в значительной мере формируется за счёт различных поверхностных (диффузных) источников загрязнения. Это сток с сельскохозяйственных и городских территорий, с производственных площадок, дорог, с осадками, а также при определенных условиях – вторичное загрязнение из донных отложений. К диффузным источникам добавляются точечные, преимущественно в городах. Сточные воды, поступающие в черте города, сильно различаются по составу. Для бытовых стоков основными показателями загрязнения являются биогенные элементы, т. е. вещества, способствующие росту микроводорослей, органические вещества, синтетические поверхностно-активные вещества (СПАВ), бактерии. В последние годы возрастает объём ксенобиотиков в сточных водах. Это лекарства, средства гигиены, моющие средства. Номенклатура этих «новых» загрязняющих веществ насчитывает многие тысячи наименований. Влияние на живые организмы и здоровье людей большинства из них остается неизученным, для таких веществ нормативы содержания в природной воде заведомо отсутствуют.
Современные водные объекты по составу содержащихся в них веществ сильно отличаются от их природного ненарушенного человеком состояния. Это отличие будет нарастать, если не принимать меры по снижению уровня загрязнений от хозяйственной деятельности.
Н.М. Щеголькова
Химический состав воды
Если капельку природной воды нанести на стекло и подождать, пока она испарится, то на месте капли будут видны белые разводы — это кристаллизуются растворимые в воде соли. Содержание солей в природных водах различается в тысячи раз. Например, в литре дождевой воды содержатся единицы, максимум десятки миллиграммов солей. А в литре воды из залива Кара-Богаз-Гол (Каспийское море) — 300 г, почти треть от массы раствора.
Основные (преобладающие) компоненты
В водных растворах подавляющее большинство солей существует в виде ионов. В природных водах преобладают три аниона (гидрокарбонат HCO3—,хлорид Cl—исульфат SO42-) и четыре катиона (кальций Ca2+,магний Mg2+,натрий Na+икалий K+) — их называют главными ионами. Хлорид-ионы придают воде солёный вкус, сульфат-ионы, ионы кальция и магния — горький, гидрокарбонат-ионы безвкусны. Они составляют в пресных водах свыше 90-95 %, а в высокоминерализованных — свыше 99 % всех растворенных веществ. Обычно нижним пределом концентрации для главных ионов считают 1 мг/л, поэтому в ряде случаев, например для морских и некоторых подземных вод, к главным компонентам можно отнести также Br—, B3+, Sr3+и др. Отнесение ионов K+к числу главных является спорным. В подземных и поверхностных водах эти ионы, как правило, занимают второстепенное положение. Только в атмосферных осадках ионы K+могут играть главную роль.
Однако ионная форма главных компонентов свойственна в полной мере лишь маломинерализованным водам. При увеличении концентрации между ионами усиливается взаимодействие, направленное на ассоциацию, т.е. процесс, обратный диссоциации. При этом образуются ассоциированные ионные пары, например MgHCO3+, CaHCO3+.
Под влиянием климатических и других условий химический состав природных вод изменяется и приобретает характерные черты, иногда специфические для различных видов природных вод (атмосферные осадки, реки, озера, подземные воды).
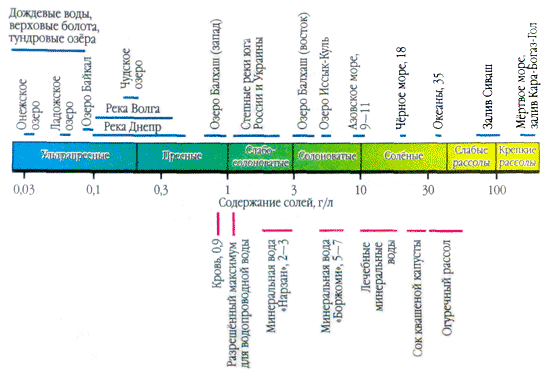
Атмосферные осадкииз всех природных вод наименее минерализованы, но по химическому составу растворенных в них веществ они не менее разнообразны, чем другие природные воды. Источником их состава являются аэрозоли атмосферы. Ионный состав их довольно разнообразен. При колебаниях средней многолетней минерализации атмосферных осадков в европейской части России в пределах 10-20 мг/л и экстремальных значениях для всей территории 3-4 и 50-60 мг/л ионный состав характеризуется пестротой, причем среди анионов большей частью преобладает SO42-или HCO3—, а среди катионов в зависимости от степени удаленности от побережья Ca2+или Na+. Непосредственно у побережья при ветре, дующем с моря, в результате ветрового механического выноса солей концентрация хлора в осадках бывает повышенной. По мере удаления от побережья относительная концентрация Cl—падает, а SO42-, Ca2+и Mg2+, наоборот, повышается. Причиной повышения содержания SO42-и Ca2+является обогащение атмосферы аэрозолями континентального происхождения. По мере продвижения в глубь континента часть морских аэрозолей вымывается. Наибольшие изменения испытывает концентрация SO42-. Если увеличение содержания Ca2+и Na+связано, скорее всего, с минеральной пылью почв и пород, на поверхности которых всегда присутствуют эти соли, то увеличение содержания SO42-обусловлено, с одной стороны, окислением SO2и H2S, с другой — поднятием сернокислых солей с засоленных поверхностей.
Не поддаются даже приблизительной оценке громадные количества солевых частиц, поднимаемых с почв, соленых озер, поверхности льда, удобрений и, наконец, выбрасываемых химическими и металлургическими производствами, и выбрасываемые в атмосферу в результате другой деятельность людей, а в дальнейшем вымываемые осадками.
Воды большинства рекпринадлежат к гидрокарбонатному классу. По составу катионов эта вода имеет почти исключительно преобладание кальция; гидрокарбонатные воды с преобладанием магния и натрия — крайне редкое явление. Из природных вод гидрокарбонатного класса наиболее распространены воды малой минерализации (суммарное содержание солей до 200 мг/л).
Реки с водой, относящейся к сульфатному классу, сравнительно малочисленны. Они распространены преимущественно в степной полосе и частично в полупустынях. В составе катионов природных вод сульфатного класса, так же как и в водах гидрокарбонатного класса, преобладает кальций. Однако ряд рек сульфатного класса имеет преобладание натрия. По минерализации воды сульфатного класса значительно превосходят воды гидрокарбонатного класса. Речные сульфатные воды с малой (общее количество солей до 200 мг/л) и средней (общее количество солей с 200 до 500 мг/л) минерализацией встречаются сравнительно редко. Наиболее характерна для этих рек повышенная (общее количество солей с 500 до 1000 мг/л), а иногда и высокая (общее количество солей более 1000 мг/л) минерализация воды.
Реки, воды которых относятся к хлоридному классу, встречаются почти так же редко, как и реки, в воде которых преобладают сульфаты. К этой территории относятся преимущественно степные районы и полупустыни. Преобладающими катионами природных вод хлоридного класса являются главным образом ионы натрия. Воды хлоридного класса отличаются высокой минерализацией — свыше 1000 мг/л, реже от 500 до 1000 мг/л.
Приведенная характеристика ионного состава речной воды относится к периоду летней межени. До некоторой степени она характеризует состав и в период ледостава. Существенно иная, значительно меньшая минерализация воды наблюдается в период весеннего половодья.
В распределении ионного состава речной воды на территории России наблюдается определенная закономерность. Имеется общая тенденция к увеличению минерализации воды на большей территории европейской части России с севера на юг и с запада на восток. Зональность ионного состава речных вод объясняется не только действием климатических условий настоящего времени, но и в значительной мере климатом прошлого. Степень выщелоченности почв и пород, наличие в них легкорастворимых солей или засоленность почв — это естественный результат многовекового воздействия соответствующих климатических условий. Нарушают зональность химического состава воды рек на территории России различия состава пород и условий их залегания.
Минерализация и химический состав воды озерв отличие от рек меняется в очень широких пределах. Реки с минерализацией воды свыше 100-200 мг/л, в каких бы условиях они ни находились, — очень редкое явление, в то время как минерализация воды озер бывает от очень низкой, в несколько десятков мг/л (т.е. мало отличающейся от дождевом) до очень высокой 3-3,5% (соляные озера с рассолом до предела насыщенного солями). Различие в минерализации отражается и на ионном составе воды озер. В нем наблюдаются закономерности, которые свойственны и химическому составу речной воды. С увеличением минерализации озерной воды происходит относительный рост ионов в ее составе в такой последовательности: HCO3—→SO42-→Cl—; Ca2+→Mg2+→Na+. При минерализации до 500-1000 мг/л в составе озерной воды преобладают гидрокарбонатные ионы, свыше 0,1% — чаще всего сульфатные, а по достижении 0,3-0,5% в зависимости от литологических особенностей водосборной площади — сульфатные или хлоридные воды. В составе катионов озерных вод преобладающая роль кальция сохраняется лишь до 0,1-0,2%. При дальнейшем росте минерализации эту роль начинают играть ионы натрия. Ионы магния, так же как и во всех других водах, сохраняют при всех минерализациях промежуточное положение. Причина подобного распределения ионного состава заключается в различной растворимости солей. Подавляющая часть пресных озер, так же как и рек, по составу вод гидрокарбонатно-кальциевые.
Состав морской водыхарактеризуется большим содержанием солей. Если в водах материкового стока чаще всего наблюдается соотношение концентраций: HCO3—> SO42-> Cl—и Ca2+> Mg2+> Na+или Ca2+> Na+> Mg2+, то для солоноватых и морских вод, начиная с общей минерализации 1 г/кг, соотношения меняются:: Cl—> SO42-> HCO3—и Na+> Mg2+> Ca2+. Изменение соотношений между нонами от речных к морским водам объясняется последовательным достижением предела растворимости слаборастворимых солей по мере повышения минерализации воды. В сумме ионы и соединения главных компонентов составляют по массе 99,99 % массы всех растворенных в океанской воде минеральных веществ.
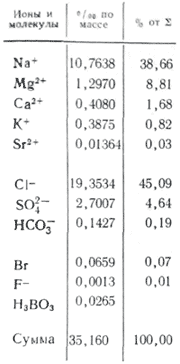
Между элементами основного солевого состава океанской воды, между каждым из них и их суммой существует практическое постоянство соотношений концентраций. Окончательно его доказал У. Дитмар, выполнивший полный химический анализ (хлориды, сульфаты, кальций, магний, натрий) 77 проб воды, доставленных из всех океанов с различных глубин экспедицией на «Челленджере»: в воде открытого океана независимо от абсолютной концентрации количественные соотношения между главными компонентами основного солевого состава всегда постоянны (закон Дитмара). Под влиянием испарения, атмосферных осадков, образования и таяния льдов изменяется лишь общее количество солей, содержащихся в морской воде, но их соотношения в пределах погрешностей определений практически не меняются. Таким образом, если известно точное отношение общего количества солей и концентраций всех основных компонентов в 1 кг воды к концентрации какого-либо одного ингредиента, то лишь по одному определению можно вычислить полный солевой состав океанской воды. В качестве такого «реперного» ингредиента избрана «хлорность», представляющая собой количество граммов ионов хлора, эквивалентное сумме галогенов (кроме фторидов, которые не осаждаются азотнокислым серебром), содержащихся в 1 кг морской воды (определение Серенсена). Постоянство состава океанской воды слегка нарушается под опресняющим влиянием материкового стока в приустьевых участках и во внутренних морях при затрудненном водообмене с океаном. В составе главных компонентов концентрации катионов кальция и магния, а также сумма концентраций анионов слабых кислот (HCO3—, CO32-, H2BO3—) подвержены более чем на 1 % отклонениям от постоянства соотношении в связи с извлечением карбоната кальция из воды в поверхностных слоях и растворением его на глубинах.
Концентрации микроэлементов настолько малы, что в сумме они не превышают 0,01 % массы всех растворенных солей. Из обобщающей сводки В.В. Гордеева и А.П. Лисицына следует, что в наибольших концентрациях встречаются литий (180 мкг/л), рубидий (120 мкг/л), барий (18 мкг/л), в наименьших — золото (0,004 мкг/л), редкоземельные элементы (менее 0,001 мкг/л), радий (10-7мкг/л).
Чем более изолированно море от океана, тем заметнее отличается состав его воды от состава воды в океане. Первостепенное значение имеют условия водообмена с океаном, соотношение объема материкового стока с объемом моря, глубина моря и характер химического состава вод впадающих рек.
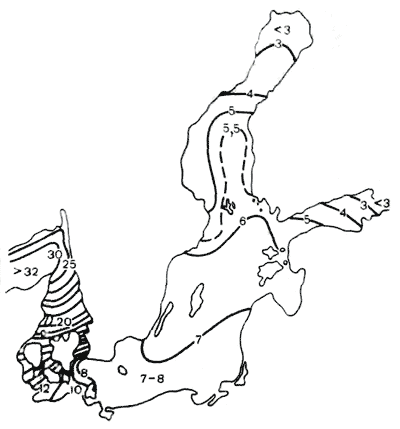
Подземные водыотличаются исключительным разнообразием химического состава, в том числе и ионного. Состав воды бывает всех классов, групп и типов. Ионный состав подземных вод прежде всего зависит от условий их формирования и залегания.
Билет 3
Химический состав воды💦
Вода, согласно ее формуле — h3O, должна состоять лишь из смеси двух газов – водорода и кислорода, однако это лишь не более чем лабораторный стандарт. На самом же деле она представляет собой смесь самых различных веществ, находящихся в самых разных физических и химических состояниях. Химический состав природной воды весьма и весьма разнообразен.
Факторы, влияющие на формирование химического состава

Произведенный в лаборатории химический анализ воды позволяет определить состав всех примесей органического и минерального происхождения, которые находятся в жидкости в форме молекул, ионов, суспензий, коллоидов и эмульсий. На химический состав как поверхностных, так и подземных вод существенно оказывают влияние географическое расположение, геологическое строение и климатические условия местности, в которой они находятся.
💦Кратко рассмотрим химический состав природной воды, представляющей собой довольно сложную дисперсионную систему, где вода – дисперсная среда, а органические, минеральные вещества, газы и живые микроорганизмы – дисперсная фаза.
Около 90 — 95 процентов компонентов, содержащихся в растворенном виде в воде, составляют соли, которые существуют там в виде ионов. В природной воде всегда присутствует «набор» из трех анионов и четырех катионов (HCO3-, SO42 -, Cl-, Ca2+, Mg2+, Na+ , K+), которые принято называть главными ионами.
Одни из них безвкусны, другие же придают жидкости горький и солёный вкус. Поступают они в воду, главным образом, из почвы, горных пород и минералов. Часть из этих ионов имеет происхождение от производственной деятельности человека. Содержатся эти макрокомпоненты в воде в самых различных концентрациях.
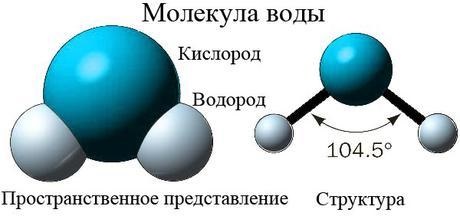
Природная вода, кроме главных ионов, содержит в своем составе еще и различные газы, разумеется, в растворенном виде. Одним из важнейших является кислород, который придает жидкости свежий вкус. Этого газа в воде может содержаться разное количество, все зависит от природных условий. Помимо кислорода, в воде содержатся такие газы, как азот и метан, не имеющие ни вкуса, ни запаха, а так же токсичный сероводород, который придает жидкости крайне неприятный запах. Концентрация этих газов в воде определяется главным образом ее температурой.
Помимо этого, в воде содержатся биогенные вещества, которые составляют большую часть всех существующих живых организмов. К ним в основном относятся соединения фосфора и азота. Что касается азота, то он в природной воде может содержаться как в органической форме, так и неорганической. Концентрация биогенных веществ в такой жидкости может быть в самых различный пределах – от всего лишь следов до 10-ти миллиграммов на литр. Основные источники этих веществ – атмосферные осадки, поступления с поверхностными стоками, а так же сельскохозяйственными, промышленными и бытовыми сточными водами.
Неотъемлемыми составляющими воды являются и микроэлементы, которых содержится в жидкости менее одного миллиграмма на литр. К ним относятся, практически, все известные металлы, за исключением железа и главных ионов и некоторые из неметаллов. Очень важными из них являются фтор и йод, обеспечивающие организму человека нормальное функционирование.
Помимо прочего, в воде присутствуют и растворенные органические вещества. Это, по сути, органические формы упомянутых выше биогенных веществ. К ним относятся: углеводы, органические кислоты, фенолы, альдегиды, спирты, ароматические соединения, эфиры и так далее.
В химический состав воды, помимо перечисленных, входят еще и токсичные соединения и вещества – нефтепродукты, тяжелые металлы, СПАВ, хлорорганические пестициды, фенолы и так далее.
Природная вода ввиду присутствия в ней большого числа пузырьков газа и различных взвешенных частиц, считается негомогенной средой.
Химический состав воды, свойства воды, качество воды
«Воды! Воды! Ее так много вокруг, но и очень мало, если рассматривать ее как пригодную для употребления воду!»
Вода, которая поступает из муниципального водопровода, давно перестала быть залогом чистоты и здоровья. Прорывая колодец или пробуривая скважину, не исключено, что некогда на этом месте были захоронения тяжелых металлов.
Проходя через породы, вода приобретает свойства, характерные для них. Так, при прохождении через известковые породы, вода становится известковой, через доломитовые породы — магниевой. Проходя через каменную соль и гипс, вода насыщается ернокислыми и хлористыми солями и становится минеральной.
Химический состав воды
Качество воды характеризуется ее свойствами
Мы подробно опишем свойства воды и их влияние на здоровье человека, на состояние систем водоснабжения и сантехнику, на работу бытовых приборов.
1. Водородный показатель (рН, ед рН ) — это десятичный логарифм концентрации ионов водорода, взятый с обратным знаком. Для всего живого в воде минимально возможная величина рН = 5, в питьевой воде допускается рН 6,0-9,0, в воде водоемов хозяйственно — питьевого и культурно-бытового водопользования — 6,5-8,5. Величина рН природной воды определяется, как правило, соотношением концентраций гидрокарбонатных анионов и свободного СО2
2. Общая жесткость— это совокупность концентраций ионов магния и кальция. В зависимости от величины общей жесткости воды различают воду очень мягкую (0 — 1,5 мг-экв/л), мягкую (1,5 — 3 мг-экв/л), средней жесткости (3 — 6 мг-экв/л), жесткую(6-9 мг-экв/л), очень жесткую (более 9 мг-экв/л). Оптимальной физиологический уровень жесткости составляет 3,0-3,5 мг-экв/л. Постоянное употребление внутрь воды с повышенной жесткостью приводит к накоплению солей в организме и, в конечном итоге, к заболеваниям суставов (артриты, полиартриты), к образованию камней в почках, желчном и мочевом пузырях.Жесткость выше 4,5 мг-экв/л приводит к интенсивному накоплению осадка в системе водоснабжения и на сантехнике, мешает работе бытовых приборов. Согласно инструкции по эксплуатации бытовой техники жесткость воды не должна превышать 1,5-2,0 мг-экв/л.
3. Хлориды Содержание хлоридов в природных водах колеблется в широких пределах (от долей миллиграмма до нескольких граммов на литр) и обусловлено вымыванием солесодержащих пород или сбросом в водоемы промышленных и бытовых сточных вод. Наличие в воде хлоридов более 350 мг/л придает ей солоноватый привкус и приводит к нарушению пищеварительной системы у людей.
4. Сульфаты Содержание сульфатов в природных водах колеблется в широких пределах (от долей миллиграмма до нескольких граммов на литр) и обусловлено вымыванием солесодержащих пород или сбросом в водоемы промышленных и бытовых сточных вод. Наличие в воде сульфатов более 500 мг/л придает ей солоноватый привкус и приводит к нарушению работы пищеварительной системы у людей.
5. Нитраты Нитраты содержатся главным образом в поверхностных водах. Нитраты в концентрации более 20 мг/л оказывают токсическое действие на организм человека. Постоянное употребление воды с повышенным содержанием нитратов приводит к заболеваниям крови, сердечно-сосудистой системы, вызывает метгемоглобинемию у детей.
6. Сульфиды (сероводород) Встречаются в основном в подземных источниках воды, образуясь в результате процессов восстановления и разложения некоторых минеральных солей (гипса, серного колчедана др.). В поверхностных водах сероводород почти не встречается, т.к. легко окисляется. Появление его в поверхностных источниках может быть следствием протекания гнилостных процессов или сброса неочищенных сточных вод. Наличие в воде сероводорода придает ей неприятный запах, интенсифицирует процесс коррозии трубопроводов и вызывает их зарастание вследствие развития серобактерий.
7. Железо Содержание железа в воде выше норматива способствует накоплению осадка в системе водоснабжения, интенсивному окрашиванию сантехнического оборудования. Железо придает воде неприятную красно-коричневую окраску, ухудшает ее вкус, вызывает развитие железобактерий, отложение осадка в трубах и их засорение. Эти обрастания вторично ухудшают органолептические свойства воды за счет слизеобразования, присущего железобактериям. Высокое содержание железа в воде приводит к неблагоприятному воздействию на кожу, может сказаться на морфологическом составе крови, способствует возникновению аллергических реакций.
8. Марганец По данным ВОЗ, содержание марганца в питьевой воде до 0,5 мг/л не приводит к нарушению здоровья человека. Однако присутствие марганца в таких концентрациях может быть неприемлемым для водопотребителей, поскольку вода имеет металлический привкус и окрашивает ткани при стирке. Присутствие марганца в питьевой воде может вызывать накопление отложений в системе распределения. Даже при концентрации 0,02 мг/л марганец часто образует пленку на трубах, которая отслаивается в виде черного осадка.
9. Окисляемость перманганатная то общая концентрация кислорода, соответствующая количеству иона перманганата (MnO-4), потребляемому при обработке данным окислителем пробы воды. Характеризует меру наличия в воде органических и окисляемых неорганических веществ. Этот параметр в основном предназначен для оценки качества водопроводной воды. Значение перманганатной окисляемости выше 2 мгО2/л свидетельствует о содержании в воде легко окисляющихся органических соединений, многие из которых отрицательно влияют на печень, почки, репродуктивную функцию организма. При обеззараживании такой воды хлорированием образуются хлоруглеводороды, значительно более вредные для здоровья населения (например, хлорфенол).
10. Аммоний (по NH+4) (азот аммонийный) Конечный продукт разложения белковых веществ -аммиак. Наличие в воде аммиака растительного или минерального происхождения не опасно в санитарном отношении. Если же аммиак образуется в результате разложения белка сточных вод, такая вода непригодна для питья. Превышение в питьевой воде ПДК по содержанию аммония может свидетельствовать о попадании фекальных стоков или органических удобрений в источник. По данным ВОЗ, содержание аммония не должно превышать 0,5 мг/л. Постоянный прием внутрь воды с повышенным содержанием аммония вызывает хронический ацидоз и изменения в тканях. Кроме того, аммиак (в виде газа) раздражает конъюнктиву глаз и слизистые оболочки.
11. Щелочность (потребление кислоты аликвотной частью образца воды при титровании 0,05н НС1). Под общей щелочностью воды подразумевается сумма содержащихся в воде гидроксильных ионов ОН и анионов слабых кислот, например угольной (НСО-3 и СО-2/3)
12. Кремний Кремневая кислота относится к слабым минеральным кислотам, соли которых присутствуют в природной воде. В некоторых реках, а также в скважинах диоксид кремния присутствует в виде чрезвычайно мелко диспергированных коллоидных частиц.
13. Сухой остаток Минерализация воды характеризуется двумя аналитически определяемыми показателями — сухим остатком и жесткостью. Сухой остаток определяется термогравиметрическим методом (выпаривание пробы воды на водяной бане и высушивания чашки при 105°С. В процессе обработки из пробы удаляются летучие компоненты и вещества, разлагающиеся с образованием летучих компонентов. Для гигиенистов сухой остаток служит ориентиром содержания в воде неорганических солей.
14. Кислород растворенный. Кислород присутствует в природной воде в результате его растворения при контакте воды с воздухом. Концентрация растворенного О 2резко снижается с повышением температуры воды. Так, при температуре 20 °С растворимость составляет 9080 мкг/кг, при 60 °С — 4700 мкг/кг, при 80 °С — 1500 мкг/кг.
15. Углекислый газ. Углекислый газ присутствует в природной воде как в результате его растворения из воздуха, так и за счет протекания в воде и почве различных биохимических процессов. Равновесная концентрация СО2 в воде также значительно снижается с ростом температуры. Так, при 20 °С растворимость составляет 500 мкг/кг, при 60 — 190 мкг/кг, при 80- 100 мкг/кг. Растворенный в воде углекислый газ образует угольную кислоту СО 2+Н2О→Н2СО3, которая диссоциирует с образованием бикарбонатных и карбонатных ионов:Н2СО3 ->Н++ НСО-3 НСО-3-> Н++ СО-23 Соотношение между концентрациями различных форм угольной кислоты в воде зависит от pН и температуры.
16. Хлор остаточный С уровнем избыточного, или так называемого остаточного, хлора в воде связывают в настоящее время представление о надежности обеззараживания. Поскольку хлорирование воды проводят хлором, находящимся в воде в свободной или связанной форме, остаточные его количества присутствуют в воде в виде свободного (хлорноватистая кислота, гипохлоритный ион) или связанного (хлораминового) хлора. В силу бактерицидной активности этих форм хлора различны и нормативы их содержания в питьевой воде (для свободного хлора — 0,3-0,5 мг/л, для связанного — 0,8-1,2 мг/л). Все соединения активного хлора обладают очень сильным бактерицидным действием, но если их концентрация больше нормативов, то они вызывают раздражение кожи, слизистых оболочек, дыхательных путей. Известно также, что при хлорировании воды образуется НСlO которая взаимодействует с железом, образуя растворимые соли, что повышает коррозионную активность такой воды.
17. Медь и её соединения широко распространены в природе, поэтому их часто обнаруживают в природных водах. Концентрации меди в природных водах обычно составляют десятые доли мг/л, в питьевой воде могут увеличиваться за счет вымывания из материалов труб и арматуры, особенно мягкой, активной водой. Свойства меди в воде зависят от значения рH воды, концентрации в ней карбонатов, хлоридов и сульфатов. Медь придает воде неприятный вяжущий привкус в низких концентрациях (более 1,0 мг/л).
18. Алюминий Высокие концентрации алюминия в природной воде встречаются нечасто и зависят от многих факторов (рН, наличия и концентрации комплексообразователей, окислительно — восстановительный потенциал системы, загрязнение промышленными сточными водами). В основном источником поступления алюминия в водопроводную воду являются коагулянты на основе солей алюминия.
Имеются сведения о нейротоксичности алюминия, его способности накапливаться при определенных условиях в нервной ткани, печени и жизненно важных областях головного мозга.
Опыт работы лаборатории по анализу качества воды показал, что к наиболее распространенным загрязнителям воды (содержание компонентов превышает нормативы), скажем в Московской области, можно отнести железо, марганец, сульфиды, фториды, соли кальция и магния, органические соединения.
Таким образом, чтобы ответить на вопрос о пригодности воды для питья необходимо оценить образец как минимум по вышеуказанным параметрам.
Вода — химический состав, пищевая ценность, БЖУ
Вес порции, г { { { В стаканах { {1 ст — 237,0 г2 ст — 474,0 г3 ст — 711,0 г4 ст — 948,0 г5 ст — 1 185,0 г6 ст — 1 422,0 г7 ст — 1 659,0 г8 ст — 1 896,0 г9 ст — 2 133,0 г10 ст — 2 370,0 г11 ст — 2 607,0 г12 ст — 2 844,0 г13 ст — 3 081,0 г14 ст — 3 318,0 г15 ст — 3 555,0 г16 ст — 3 792,0 г17 ст — 4 029,0 г18 ст — 4 266,0 г19 ст — 4 503,0 г20 ст — 4 740,0 г21 ст — 4 977,0 г22 ст — 5 214,0 г23 ст — 5 451,0 г24 ст — 5 688,0 г25 ст — 5 925,0 г26 ст — 6 162,0 г27 ст — 6 399,0 г28 ст — 6 636,0 г29 ст — 6 873,0 г30 ст — 7 110,0 г31 ст — 7 347,0 г32 ст — 7 584,0 г33 ст — 7 821,0 г34 ст — 8 058,0 г35 ст — 8 295,0 г36 ст — 8 532,0 г37 ст — 8 769,0 г38 ст — 9 006,0 г39 ст — 9 243,0 г40 ст — 9 480,0 г41 ст — 9 717,0 г42 ст — 9 954,0 г43 ст — 10 191,0 г44 ст — 10 428,0 г45 ст — 10 665,0 г46 ст — 10 902,0 г47 ст — 11 139,0 г48 ст — 11 376,0 г49 ст — 11 613,0 г50 ст — 11 850,0 г51 ст — 12 087,0 г52 ст — 12 324,0 г53 ст — 12 561,0 г54 ст — 12 798,0 г55 ст — 13 035,0 г56 ст — 13 272,0 г57 ст — 13 509,0 г58 ст — 13 746,0 г59 ст — 13 983,0 г60 ст — 14 220,0 г61 ст — 14 457,0 г62 ст — 14 694,0 г63 ст — 14 931,0 г64 ст — 15 168,0 г65 ст — 15 405,0 г66 ст — 15 642,0 г67 ст — 15 879,0 г68 ст — 16 116,0 г69 ст — 16 353,0 г70 ст — 16 590,0 г71 ст — 16 827,0 г72 ст — 17 064,0 г73 ст — 17 301,0 г74 ст — 17 538,0 г75 ст — 17 775,0 г76 ст — 18 012,0 г77 ст — 18 249,0 г78 ст — 18 486,0 г79 ст — 18 723,0 г80 ст — 18 960,0 г81 ст — 19 197,0 г82 ст — 19 434,0 г83 ст — 19 671,0 г84 ст — 19 908,0 г85 ст — 20 145,0 г86 ст — 20 382,0 г87 ст — 20 619,0 г88 ст — 20 856,0 г89 ст — 21 093,0 г90 ст — 21 330,0 г91 ст — 21 567,0 г92 ст — 21 804,0 г93 ст — 22 041,0 г94 ст — 22 278,0 г95 ст — 22 515,0 г96 ст — 22 752,0 г97 ст — 22 989,0 г98 ст — 23 226,0 г99 ст — 23 463,0 г100 ст — 23 700,0 г
3. Состав природных вод
[Характеристика химического состава атмосферных осадков,
поверхностных вод (речных, озёрных, морских, океанических).
Общие сведения о химическом составе подземных вод: минерализация,
макро–, мезо–, микрокомпоненты. Газовый состав, органические
вещества, микробиологический состав подземных вод].
Природные, в том числе подземные, воды представляют собой сложные системы, состоящие из собственно воды, о свойствах которой мы говорили на прошлой лекции, разнообразных ионов химических элементов, газообразных молекул, органических соединений, микроорганизмов, сложных органоминеральных комплексов и т.д. Но всё–таки главными компонентами природных растворов, изучаемыми гидрогеохимией, являются шесть ионов: НСО3–, SO42–, С1–, Ca+, Mg+ и Na+.
Прежде, чем начать рассмотрение химического состава природных и, главным образом, подземных вод, будет нелишним вспомнить о способах выражения химического анализа воды, о подходах к систематике, или классификации природных вод. В гидрогеохимической практике приняты три основные формы выражения концентрации компонентов. Первая форма — это г/л или мг/л. Это масса химического вещества, содержащегося в 1 л природного раствора. Реже массу химического вещества рассчитывают не на объёмную единицу (л), а на массовую (кг), и получается единица измерения г/кг. Вторая форма выражения концентрации — это г–экв или мг–экв. Чтобы получить миллиграмм–эквивалентное выражение концентрации надо величину концентрации в мг/л разделить на эквивалентную массу иона. Эквивалентная масса иона равна атомной массе, делённой на валентность. Например, эквивалентная масса Са2+ составляет 40,08 : 2 = 20,04, а Na+ — 23,0 : 1 = 23,0. Эквивалентная форма выражения результатов анализа по существу равнозначна молярной форме выражения; при этом концентрации веществ выражены в тех химически равноценных единицах, пропорционально которым они вступают между собой в реакции и связаны в солях, будучи в твёрдом состоянии. При качественно выполненном анализе Σ мг–экв анионов равна Σ мг–экв катионов. Наконец третья форма выражения концентраций — это %–эквивалентная форма. Сумма мг–эквивалентов анионов принимается за 100 % и сумма мг–эквивалентов катионов — за 100 % и рассчитывается, какой процент составляет концентрация каждого иона (в мг–экв) от общей суммы катионов или анионов. Приведём пример анализа воды, полученной из среднедевонских отложений (гл. 251 м) в д. Обабье Браславского района.
мг/л | мг–экв/л | % мг–экв | |
Са2+ | 71,42 | 3,564 | 42,90 |
Mg2+ | 29,78 | 2,451 | 29,51 |
Na+ | 49,20 | 2,140 | 25,76 |
K+ | 6,00 | 0,153 | 1,84 |
Сумма катионов | 8,307 | 100,00 | |
Cl– | 74,96 | 2,114 | 25,45 |
SO42– | 33,33 | 0,694 | 8,35 |
HCO3– | 335,50 | 5,499 | 66,20 |
Сумма анионов | 8,307 | 100,00 |
Одной из важнейших характеристик химического состава природных вод является их минерализация, т.е. сумма растворённых солей; она выражается в г/л, мг/л, г/кг, мг/кг, может даваться в процентах (%), промилле (‰), в эквивалентном выражении. Иногда, главным образом в океанологии, вместо термина “минерализация” применяется термин “солёность”. Это синонимы.
Химический состав природных вод очень разнообразен. Это вызывает необходимость систематизации химического состава вод. С этой целью предложены ряд классификаций и множество способов наглядного изображения химического состава вод (графики, формулы, коэффициенты и т.п.).
Наиболее распространено выражение химического состава воды в виде формулы Курлова. Эта формула представляет собой инструмент не только выражения состава воды, но и определения её типа, т.е. это инструмент классифицирования вод по химическому составу. Формула Курлова была предложена в 1928 г. и с этого времени её вид претерпел изменения. Современный и наиболее рациональный вид формулы Курлова покажем на примере такой формулы для приведенного выше химического анализа воды из среднедевонских отложений Браславского района.
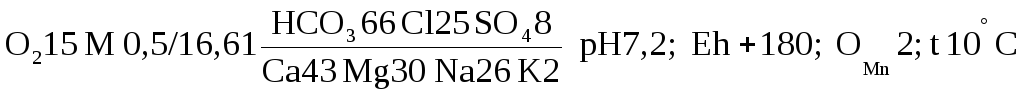 .
.
Итак, в левой стороне формулы выписывается (в мг/л) содержание газов, а затем микрокомпонентов, если их количество представляет геохимический интерес. Далее записывается минерализация воды (М) в виде дроби: в числителе в массовой форме (в г/л с точностью до одного десятичного знака), в знаменателе — в мг–эквивалентной форме. Далее, в псевдодробь записываются в %–эквивалентном выражении (с точностью до целых процентов) в нисходящем порядке все анионы (в числителе) и катионы (в знаменателе), содержание которых составляет более 1 %–экв. Справа от псевдодроби записывают показатели, характеризующие состояние воды (рН, Еh), перманганатную окисляемость в мг О/л, характеризующую содержание в воде органических веществ, а также температуру воды. Для сильноминерализованных вод в конце формулы проставляют плотность воды. При наименовании воды по её ионному составу по формуле Курлова учитываются ионы, концентрация которых превышает 20 %–экв. При этом сначала называются подчинённые ионы, а затем преобладающие. Вода, формула которой изображена выше, будет называться хлоридно–гидрокарбонатной натриево–магниево–кальциевой.
В большинстве случаев гидрогеохимической практики простое чтение формулы Курлова, как мы это только что сделали, оказывается достаточным для определения характера воды. Однако иногда (при гидрогеохимической оценке нефтегазоносности, при изучении минеральных лечебных вод, при решении специальных вопросов теоретической гидрогеохимии) необходимо провести более детальную типизацию воды по химическому составу. Тогда исследуют соотношения ионов (в мг–экв или %–экв.), которые по существу отражают, какие соли присутствуют в растворе, как связаны между собой катионы и анионы.
Почти все природные воды укладываются в четыре типа (в типе III — два подтипа), характеризующиеся следующими соотношениями ионов:
I) HCO3– > Ca2+ + Mg2+,
II) HCO3– < Ca2+ + Mg2+ < HCO3– + SO42–,
IIIa) Cl– < Na+ + Mg2+,
IIIб) Cl– > Na+ + Mg2+,
IV) HCO3– = 0.
Применив указанные соотношения к нашей воде из Браславского района (см. формулу Курлова), легко установить, что вода относится ко II типу, к которому относится большинство подземных вод малой и умеренной минерализации.
Итак, мы произвели типизацию подземной воды по химическому составу. И произвели её по существу, следуя наиболее принятой классификации О.А. Алекина –Е.В. Посохова. В основу этой классификации положены два принципа: преобладающих ионов и соотношения между ионами. Все природные воды по преобладающему аниону делятся на классы: гидрокарбонатный, сульфатный, хлоридный и промежуточные (гидрокарбонатно–сульфатный, сульфатно–хлоридный и т.д.), а классы по преобладающему катиону делятся на группы: кальциевых, магниевых, натриевых и смешанных (кальциево–магниевых, натриево–кальциевых и т.д.) вод. В пределах групп выделяются типы вод по соотношению ионов.
По величине минерализации природные воды подразделяются на пресные (до 1 г/кг), солоноватые (1,0–10,0 г/кг), солёные (10,0–35,0 г/кг) и рассолы (35–>370 г/кг). В пределах названных групп существует более дробное деление, как показано в таблице.
Воды | Минерализация | |
г/кг | г/л | |
Пресные ультрапресные умеренно нормально | < 0,1–1,0 < 0,1 0,1–0,5 0,5–1,0 | < 0,1–1,0 < 0,1 0,1–0,5 0,5–1,0 |
Солоноватые слабо средне сильно | 1,0–10,0 1,0–3,0 3,0–5,0 5,0–10,0 | 1,0–10,0 1,0–3,0 3,0–5,0 5,0–10,0 |
Солёные слабо сильно | 10,0–35,0 10,0–25,0 25,0–35,0 | 10,1–36,0 10,1–25,4 25,4–36,0 |
Рассолы слабые крепкие весьма крепкие предельно насыщенные | 35,0– > 370,0 35,0–135,0 135,0–265,0 265,0–370,0 > 370 | 36,0– > 500,0 36,0–150,0 150,0–320,0 320,0–500,0 > 500,0 |
Кстати, в этой таблице можно видеть, как сильно начинают различаться цифры минерализации, выраженной в г/кг и г/л при большой минерализации. Это связано с существенным ростом плотности воды при увеличении минерализации (пресная вода имеет плотность 1,0 г/см3; морская вода с минерализацией 36 г/л — 1,03 г/см3, а рассол с минерализацией 394 г/л — 1,28 г/см3).
Теперь кратко рассмотрим особенности состава атмосферных и поверхностных вод Земли, которые дают начало подземным водам.
Атмосферные (метеорные) воды. Несмотря на довольно большое разнообразие химического состава незагрязнённых промышленными отходами дождевых и снеговых вод, всё же они, как правило, отличаются низкой минерализацией, не превышающей в районах гумидного климата 50, а нередко и 20 мг/л. Но в некоторых районах морских побережий за счёт солей, захватываемых с поверхности моря, минерализация дождевых вод в отдельные периоды года может быть более 100 мг/л. Из моря или океана атмосферные осадки заимствуют натрий, хлор, иод, бром. В Западной Европе содержание хлора в атмосферных осадках в непосредственной близости от берегов морей достигает иногда 200–300 мг/л. С удалением от морских побережий в глубь континентов всё большую роль в атмосферных осадках играют вещества, поступающие в атмосферу в результате развевания и последующего растворения пылеватых частиц почв и горных пород, а в условиях засушливого климата — и легкорастворимых солей. В последнем случае состав метеорных осадков становится сульфатным и даже хлоридным.
Важно отметить, что с каждым годом все больше возрастает роль техногенного фактора, который сильно изменяет состав атмосферным осадков. Выбросы в атмосферу газов, загрязнение её разнообразными отходами приводят к образованию в атмосфере кислот, щелочей, обогащению атмосферных вод различными металлами, органическими соединениями и солями. Из–за того, что минерализация атмосферных вод мала, а источников поступления вещества в атмосферу много, метеорные воды характеризуются большим разнообразием химических типов. Кроме солей атмосферные воды содержат растворённые азот, кислород, углекислый газ, инертные газы.
Речные воды. Воды подавляющего числа рек имеют небольшую минерализацию (менее 0,5 г/л). Это, как правило, гидрокарбонатные кальциевые воды. В степной полосе и пустынях преимущественно распространены реки с сульфатной кальциевой или натриевой водой. Минерализация вод таких рек чаще всего 0,5–1 г/л. В отдельных случаях, как, например, в реке Кума, она достигает 4–5 г/л. Реки с водой хлоридного класса также распространены редко.
Из биогенных компонентов химического состава для речных вод наиболее характерны соединения азота и фосфора. Органическое вещество в реках представлено, главным образом, гуминовыми соединениями. Из растворённых газов в речных водах наибольшее значение имеют кислород и углекислый газ.
В исключительных случаях реки характеризуются совершенно уникальным составом. Например, р. Риу–Негру в Колумбии содержит воду, в которой присутствует 11 г/кг серной кислоты и 9 г/кг соляной. В истоке этой реки находятся, по–видимому, активные вулканы.
Озерные воды. По минерализации воды озёр делятся на пресные (до 1 г/л), солоноватые (до 35 г/л) и соляные (свыше 35 г/л).
Вода подавляющего большинства пресных озёр гидрокарбонатная кальциевая. Таковы, например, озёра Нарочь, Байкал, Ладожское, Онежское, Гурон, Мичиган, Танганьика. Химический состав воды пресных озёр определяется составом вод втекающих в них рек.
Сложнее обстоит дело с солоноватыми озёрами. В них вода подвергается испарительному концентрированию, а при этом происходят изменения в соотношении главных ионов и, следовательно, изменение её химического состава. К категории крупных солоноватых озёр относятся Балхаш, Иссык–Куль и Аральское море. По преобладающим анионам вода в них является хлоридно–сульфатной или сульфатно–хлоридной, по катионному составу — магниево–натриевой.
Соляные озёра делятся на три типа по химическому составу воды. Это: содовые или карбонатные, сульфатные и хлоридные. Соляные озёра бессточные, расположены в аридной зоне. На базе некоторых соляных озёр осуществляется промышленная добыча либо осаждающихся солей, либо высококонцентрированных вод (рассолов). Так, в заливе Кара–Богаз–Гол (Туркмения) много лет шла добыча мирабилита (Nа2SO4 · 10Н2О). В Израиле из хлоридных магниево–натриевых рассолов Мёртвого моря (это озеро) с минерализацией 300–320 г/л извлекают хлористый калий и бромидные продукты. В воде Мёртвого моря содержится 6 г/кг брома — самое большое количество, когда–либо зарегистрированное для любой поверхностной воды. Интересно, что такое же содержание брома установлено и в подземных рассолах Гомельской области (Припятский прогиб).
Состав и количество органического вещества в озёрных водах весьма разнообразны и зависят от физико–географических условий нахождения озёра, его биологической продуктивности, ионного состава воды, температуры и др. В состав растворённых газов озёрных вод входят кислород, азот, углекислый газ, иногда сероводород и метан.
Морские и океанические воды. В морской и океанической воде обнаружены все химические элементы. Однако основную массу солей составляют одиннадцать главных компонентов, которые в средней океанической воде имеют такие концентрации (в г/л): Na+ — 11,03; Mg2+ — 1,33; К+ — 0,40; Са2+ — 0,42; Sr2+ — 0,01; Cl– — 19,83; SO42– — 2,77; НСО3– — 0,15; Br– — 0,07; F– — 0,01 и Н3ВО4 — 0,03. Эти компоненты дают в сумме 99,9 % массы всех растворённых в океанической воде соединений. Минерализация средней океанической воды составляет 36 г/л, или 35 г/кг. Формула Курлова для океанической воды в упрощённом виде записывается так:
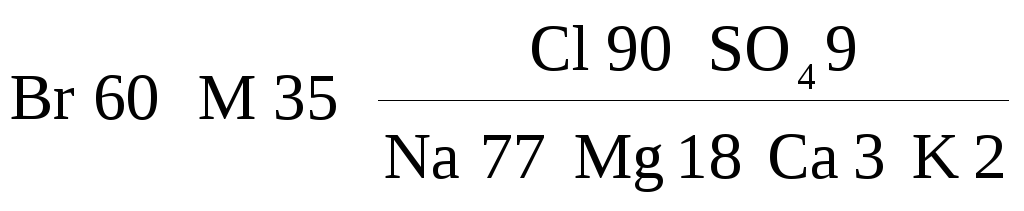 .
.
Таким образом, современная океаническая вода является хлоридной натриевой, относящейся к типу III, подтипу а, согласно классификации О.А. Алёкина – Е.В. Посохова.
Ещё в 1819 г. Марсет установил, что морская и океаническая вода в разных районах земного шара содержит одни и те же химические компоненты в очень близких пропорциях, а различия в химическом составе состоят только в общем количестве присутствующих солей, т.е. в минерализации. Действительно, минерализация воды составляет для Белого моря 3, Балтийского — 7, Черного — 18, Мраморного — 25, Средиземного и Красного — 38 г/кг.
В водах Мирового океана содержится существенное количество органического вещества, источником которого является весь органический мир, населяющий воды. Среднее содержание органического вещества в океанической воде 1,5–2,5 мг/л, в водах окраинных и внутренних морей концентрация органического вещества увеличивается. Например, в Азовском море она доходит до 6 мг/л. Среди органических веществ преобладают липиды, углеводороды и гуминовые вещества.
В морской воде также присутствуют растворённые газы. Это кислород, азот, углекислый газ, сероводород, углеводороды и инертные газы.
Заканчивая краткий рассказ о поверхностных водах нашей планеты, интересно отметить, что при сравнении среднего химического состава вод Мирового океана и поверхностных вод суши ярко бросается в глаза диссиметрия Земли в составе поверхностных вод. Если в Мировом океане резко преобладают хлор и натрий, то в речных и озёрных водах — гидрокарбонат и кальций. Диссиметрия наблюдается и по общей концентрации солей: в Мировом океане концентрация растворённых веществ в среднем в 179 раз превышает таковую в водах рек и озёр.
Перейдём, наконец, к вещественному составу подземных вод, который складывается из ионов, газов, органического вещества, микрофлоры.
Состав растворённых ионов в подземных водах определяется распространённостью химических элементов в земной коре и растворимостью соединений, образуемых этими элементами. Распространённость и содержание минеральных веществ в подземных водах различны, в связи с чем среди них выделяются макрокомпоненты и микрокомпоненты, а иногда и промежуточная группа — второстепенных компонентов (или мезокомпоненты).
Макрокомпоненты определяют химический тип воды, её общую минерализацию и название. К макрокомпонентам относятся Са, Мg, Na, К (отнесение последнего в эту группу является спорным), С1, S и С). Это химические элементы, которые имеют высокий кларк, т.е. высокое среднее содержание в земной коре и образуют хорошо растворимые соединения. Мы назвали макрокомпоненты в виде химических элементов, но в воде они присутствуют в виде ионов: (Са2+, Мg2+, Na+, К+, С1–, SO42– и НСО3–.
Второстепенными компонентами подземных вод принято считать азотистые соединения (NH4+, NO3–), кремнекислоту H3SiO4, Fe2+, Fe3+, Al. Эти элементы всегда присутствуют в подземных водах, но содержание их обычно невелико, что связано либо с их высоким кларком, но низкой растворимостью соединений, либо с низким кларком, но сравнительно хорошей растворимостью солей.
Микрокомпоненты содержатся в подземных водах, как правило, в незначительных количествах, определяемых миллиграммами, микрограммами и долями микрограммов в 1 литре. Но иногда их концентрации достигают количеств, соизмеримых с макрокомпонентами. В этом случае они входят в формулу химического состава воды. Микрокомпоненты представлены химическими элементами, которые имеют низкий кларк в литосфере и соединения которых отличаются низкой растворимостью. Микрокомпонентами считаются бром, иод, фтор, бор, литий, рубидий, цезий, стронций, барий, мышьяк, молибден, медь, кобальт, цинк, свинец, ванадий, никель и др.
Простое перечисление макро–, мезо– и микрокомпонентов не даёт представления о размахе колебаний их концентраций в подземных водах. Поэтому отметим, что концентрация химических элементов в подземных водах колеблется от сотен граммов на литр (макрокомпоненты) до миллиардных долей г/л (микрокомпоненты).
Очень большой диапазон имеет и минерализация подземных вод. Увеличение минерализации происходит за счёт появления в подземных водах всё более растворимых соединений. Наименее минерализованными (менее 10 мг/л) являются ультрапресные гидрокарбонатные кальциевые воды (карбонат кальция относительно слаборастворим), наиболее минерализованными (до 760 г/л) — предельно насыщенные хлоридные кальциевые рассолы (хлорид кальция чрезвычайно хорошо растворим).
Итак, мы отметили, что подземные воды весьма разнообразны по минерализации, по размаху концентраций отдельных химических компонентов. Теперь подчеркнём чрезвычайное разнообразие химических типов подземных вод. Посмотрим это на примере подземных вод Беларуси, для территории которой гидрогеохимик В.М. Шиманович насчитал около 75 химических разновидностей подземных вод.
Сплошным чехлом мощностью 200–300 м на территории Беларуси залегают пресные воды. Эти воды сосредоточены, главным образом, в четвертичных отложениях, но не только в них. Здесь весьма характерны гидрокарбонатные кальциевые воды. Местами, например, в районе Витебска, где питьевое водоснабжение города основано на заборе воды из девонских доломитовых пород, воды гидрокарбонатные магниево–кальциевые и кальциево–магниевые. В других случаях, например, в районе Минска в пресных подземных водах, получаемых из морских терригенных отложений верхнего протерозоя, существенное значение среди катионов приобретает натрий. Встречаются воды гидрокарбонатные кальциево–натриевые, натриевые и др.
Кроме пресных широко представлены в недрах нашей республики солоноватые, солёные воды и рассолы. На большей части территории Беларуси (северо–восточная четверть) повсеместно распространена так называемая сульфатная пачка наровского горизонта среднего девона. Эта пачка сложена гипсом и залегает на глубинах 200–400 м.
Очень характерно, что к ней (немного выше или немного ниже её) часто приурочены сульфатные воды с преобладанием кальция среди катионов. Минерализация этих вод в среднем около 2 г/л, что совпадает с величиной растворимости сульфата кальция.
Глубже 300–400 м почти повсеместно залегают хлоридные солоноватые и солёные преимущественно хлоридные натриевые подземные воды, а в пределах двух крупных геологических структур Беларуси — Оршанской впадины на северо-востоке республики и Припятского прогиба на юго-востоке — на больших глубинах обнаруживаются подземные рассолы. Особенно интересны рассолы Припятского прогиба. Они насыщают здесь надсолевые, внутрисолевые, межсолевые и подсолевые карбонатные и терригенные отложения, которые по возрасту относятся к позднему и среднему девону и позднему протерозою и залегают на глубинах 2–5 км. Минерализация рассолов Припятского прогиба достигает 460 г/л. Рассолы хлоридные. При минерализации менее 280–300 г/л они натриевые; при минерализации свыше 280–300 г/л — преимущественно кальциевые. В рассолах повышенные и высокие (так называемые промышленные) концентрации ряда микрокомпонентов: брома, иода, стронция, бора, лития, рубидия, цезия. Концентрация Вr достигает 6 г/л, а Sr 4 г/л. Это как раз тот случай, когда микрокомпоненты находятся в таких высоких концентрациях, что они по существу ухе выходят из разряда микрокомпонентов и переходят в категорию макрокомпонентов. Любопытно, что в наиболее концентрированных рассолах содержание натрия — типичного макрокомпонента — снижается до 5 г/л и становится соизмеримым с концентрациями стронция и брома. Ещё более яркий пример того, как второстепенный компонент становится главным и определяющим тип воды: на Ельской площади Припятского прогиба во внутрисолевом терригенном прослое на глубине около 2,5 км обнаружены рассолы с концентрацией аммония до 23 г/л. Эти рассолы следует определить как хлоридные аммониево–натриевые:
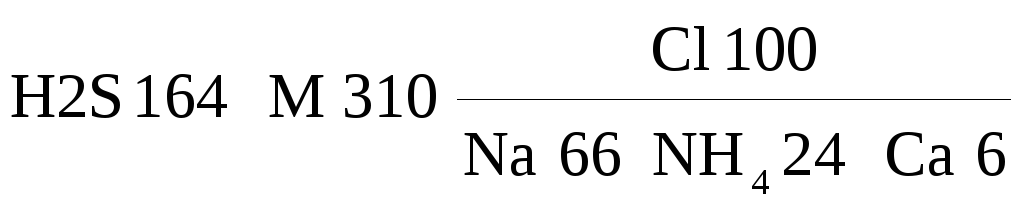 .
.
В.И. Вернадский писал, что “в земной коре нет воды, не заключающей в растворе определённого количества и определённого состава газов”. Поэтому кратко рассмотрим газовый состав подземных вод. Основными газами, содержащимися в подземных водах, являются кислород O2, азот N2, углекислота СО2, сероводород Н2S, водород Н2 и углеводороды (метан СН4 и более тяжелые ТУ). Кроме того, подземные воды содержат инертные газы — Не, Ne, Ar и др.
При изучении подземных вод важное значение имеет равновесие вода – газ. Обычно газ растворён в воде, но при его избытке часть его может находиться в свободном (спонтанном) состоянии, т.е. в виде мельчайших пузырьков в порах горных пород. Поглощение и выделение газа водой — процессы, которые могут спровоцироваться изменением ионно–солевого состава воды. Растворимость газов в воде зависит от температуры, давления и минерализации воды.
С ростом температуры примерно до 80–90 °С растворимость газов уменьшается, а при дальнейшем повышении температуры — увеличивается.
С увеличением давления растворимость газов возрастает. Именно поэтому воды кавказских минеральных источников газируют углекислотой. На глубине в этих водах растворено большое количество СO2; при выходе на поверхность снижается давление и уменьшается растворимость газа, который из растворённого состояния переходит в свободное.
Рост минерализации воды способствует снижению растворимости газов.
Наименьшей растворимостью в воде обладает гелий, а наибольшей сероводород.
По происхождению газы делятся на: 1) воздушные (N2, O2, СO2, Ne, Аr), проникающие в литосферу из атмосферного воздуха; 2) биохимические (СН4, СО2, N2, H2S, Н2, O2, ТУ), образующиеся при разложении микроорганизмами органических и минеральных веществ; 3) химические (СO2, H2S, Н2, СН4 и др.), образующиеся при взаимодействии воды и породы; 4) радиоактивного происхождения (Не, Rn, O2).
Кислород в подземных водах содержится в количествам до 15–20 мг/л. С глубиной его концентрация, как правило, уменьшается, так как он расходуется на окисление минеральных и органическим соединений. Вместе с тем, высокие концентрации кислорода обнаружены в рассолах на глубинах 2–3 км. Здесь он связан с разложением молекул воды под действием радиоактивного излучения (радиолиз воды).
Содержание углекислоты в подземных водах достигает 20 и даже 40 г/л. СО2 является участником реакций, определяющих одно из важнейших в природе карбонатных равновесий CO2 — CO32– — HCO3–.
Столь же важный агент химических реакций и сероводород, входящий в систему H2S — SO42–. Его концентрация в подземных водам достигает 3 г/л.
Азот очень широко распространён практически во всех типам подземных вод. Его обычная концентрация — десятки–сотни мг/л, максимальная — 1200 мг/л.
Углеводородные газы (СН4 и др.) обычно присутствуют в водах нефтегазоносных бассейнов. Их содержание может достигать 13000 см3 в литре.
Гелия в подземных водах немного (десятые доли – единицы см3/л). В последние годы он привлекает внимание как показатель глубинных разломов и предвеcтник землетрясений.
Газовый состав — один из основных компонентов минеральных (лечебных) подземных вод, в связи с чем по газовому составу выделяются типы минеральных вод: сероводородные, метановые, азотные, углекислые, радоновые. Радоновые, генетически связанные с кристаллическими породами фундамента, воды имеются в западной части Беларуси, где они используются в санаторной практике.
В подземных водах содержится широкая гамма разнообразных органических соединений. Это жирные, нафтеновые и карбоновые кислоты, битум, фенолы, бензол, толуол, аминокислоты, амины, спирты, сложные эфиры. Количественная характеристика органического вещества подземных вод выражается концентрацией органического углерода (Сорг), или величиной окисляемости — перманганатной, бихроматной и др. (в мг О/л). В подземных водах содержание Сорг колеблется от десятых долей до сотен мг/л. Наиболее обогащены органическим веществом воды нефтяных месторождений (до 800 мг/л).
Основными источниками поступления органических веществ в подземную воду являются почвы, горные породы, особенно торф, уголь, горючие сланцы, залежи нефти.
В подземных водах широко распространены разнообразные микроорганизмы, среди которых наиболее изучены аэробные и анаэробные бактерии. Первые развиваются при наличие свободного кислорода, который используется ими для дыхания, вторые черпают необходимый им кислород из кислородсодержащих органических (углеводы, спирты и др.) и минеральных (нитраты, сульфаты) соединений. Число бактерий в подземных водах колеблется в больших пределах — от нескольких тысяч до 2 млн клеток в 1 мл воды.
В грунтовых водах распространены гнилостные бактерии и сапрофиты, разлагающие вещества белкового характера. Более глубокие подземные воды характеризуются развитием бактерий, активно участвующим в окислительно–восстановительных реакциях. Это сульфатредуцирующие, метанообразующие, денитрифицирующие, тионовые и другие бактерии. Верхний предел температуры, при которой может протекать жизнедеятельность микрофлоры 80–90 °С. Минерализация воды и её химический состав не являются сдерживающим фактором для развития микроорганизмов. Существует ряд микроорганизмов, способных существовать при концентрации солей 300 г/л и более.
 (
(