Жесткость воды — ТеплоВики — энциклопедия отопления
Материал из ТеплоВики — энциклопедия отоплении
Жесткость воды определяется концентрацией ионов щелочноземельных металлов. К ним относятся преимущественно хлориды, сульфаты, гидрокарбонаты и т. д. По жесткости вода дополнительно подразделяется на:
- мягкую (до 7 °dH),
- средней жесткости (до 14 °dH),
- жесткую (до 21 °dH) и очень жесткую (> 21 °dH).
Чем выше степень жесткости, тем больше ионов содержится в воде. В настоящее время обозначение °dH (“градус немецкой жесткости”) вышло из употребления и применяется ммоль/л.
| Общая жесткость [ммоль/л] | [°dН]* (округл.) | Хар-ка |
|---|---|---|
| 0–1 | 0–6 | очень мягкая |
| 1–2 | 6–11 | мягкая |
| 2–3 | 11–17 | |
| 3–4 | 17–22 | жесткая |
| > 4 | >22 | очень жесткая |
Единицы измерения
Для численного выражения жёсткости воды указывают концентрацию в ней катионов кальция и магния. Рекомендованная единица системы СИ для измерения концентрации — моль на кубический метр (моль/м³), однако, на практике для измерения жёсткости чаще используется миллимоль на литр (ммоль/л).
В России для измерения жёсткости чаще используется нормальная концентрация ионов кальция и магния, выраженная в миллиграмм-эквивалентах на литр (мг-экв/л). Один мг-экв/л соответствует содержанию в литре воды 20,04 миллиграмм Ca2+ или 12,16 миллиграмм Mg2+ (атомная масса делённая на валентность). Числовое значение жесткости, выраженное в молях на кубический метр равно числовому значению жесткости, выраженному в миллиграмм эквивалентах на литр (или кубический дециметр), т.е.: 1моль/м3=1ммоль/л=1мг-экв/л=1мг-экв/дм3.
Иногда указывают концентрацию, отнесённую к единице массы, а не объёма, особенно, если температура воды может изменяться или если вода может содержать пар, что приводит к существенным изменениям плотности.
В разных странах использовались (иногда используются до сих пор) различные внесистемные единицы — градусы жёсткости.
| Градус | Обозначение | Определение | Величина | |
|---|---|---|---|---|
| мг-экв/л | ммоль/л | |||
| Немецкий | °dH (degrees of hardness), °dGH (German (Deutsche) Hardness), °dKH (для карбонатной жёсткости) | 1 часть оксида кальция (СаО) или 0.719 частей оксида магния (MgO) на 100 000 частей воды | 0,3566 | 0,3566 |
| Английский | °e | 1 гран CaCO3 на 1 английский галлон воды | 0,2848 | 0,2848 |
| Французский | °TH | 1 часть CaCO3 на 100000 частей воды | 0,1998 | 0,1998 |
| ppm | 1 часть CaCO3 на 1 000 000 частей воды | 0,0200 | 0,0200 | |
В СССР до 1952 года использовали градусы жёсткости, совпадавшие с немецкими.
Источники
Жесткость
Жесткостью называют свойство воды, обусловленное наличием в ней растворимых солей кальция и магния.
Жесткость воды — это один из основных критериев качества воды.
Химия жесткости
Понятие жесткости воды принято связывать с катионами кальция (Са2+) и в меньшей степени магния (Mg2+). В действительности, все двухвалентные катионы в той или иной степени влияют на жесткость. Они взаимодействуют с анионами, образуя соединения (соли жесткости) способные выпадать в осадок. Одновалентные катионы (например, натрий Na
В данной таблице приведены основные катионы металлов, вызывающие жесткость, и главные анионы, с которыми они ассоциируются.
Катионы | Анионы |
|---|---|
Кальций (Ca2+) | Гидрокарбонат (HCO3—) |
Магний (Mg2+) | Сульфат (SO42-) |
Стронций (Sr2+) | Хлорид (Cl—) |
Железо (Fe2+) | Нитрат (NO3—) |
Марганец (Mn2+) | Силикат (SiO32-) |
На практике стронций, железо и марганец оказывают на жесткость столь небольшое влияние, что ими, как правило, пренебрегают. Алюминий (Al
Виды жесткости.
Различают следующие виды жесткости.
Общая жесткость. Определяется суммарной концентрацией ионов кальция и магния. Представляет собой сумму карбонатной (временной) и некарбонатной (постоянной) жесткости.
Метод удаления: умягчение воды (ионообменные фильтры)
Карбонатная жесткость. Обусловлена наличием в воде гидрокарбонатов и карбонатов (при рН>8.3) кальция и магния. Данный тип жесткости почти полностью устраняется при кипячении воды и поэтому называется временной жесткостью. При нагреве воды гидрокарбонаты распадаются с образованием угольной кислоты и выпадением в осадок карбоната кальция и гидроксида магния.
Метод удаления №1: умягчение воды (ионообменные фильтры)
Метод удаления №2: обратный осмос (обессоливание воды)
Некарбонатная жесткость. Обусловлена присутствием кальциевых и магниевых солей сильных кислот (серной, азотной, соляной) и при кипячении не устраняется (постоянная жесткость).
Метод удаления №1: умягчение воды (ионообменные фильтры)
Метод удаления №2: обратный осмос (обессоливание воды)
Единицы измерения.
В мировой практике используется несколько единиц измерения жесткости, все они определенным образом соотносятся друг с другом. В России Госстандартом в качестве единицы жесткости воды установлен моль на кубический метр (моль/м3).
Кроме этого в зарубежных странах широко используются такие единицы жесткости, как немецкий градус (do, dH), французский градус (fo), американский градус, ppm CaCO3.
Соотношение этих единиц жесткости представлено в следующей таблице:
Единицы жесткости воды | ||||
|---|---|---|---|---|
Моль/м3 (мг-экв/л) | Немецкий градус, do | Французский градус, fo | Американский градус | ppm (мг/дм3)СаСО3 |
1.000 | 2.804 | 5.005 | 50.050 | 50.050 |
Примечание:
Один немецкий градус соответствует 10 мг/дм3 СаО или 17.86 мг/дм3 СаСО3 в воде.
Один французский градус соответствует 10 мг/дм3 СаСО3 в воде.
Один американский градус соответствует 1 мг/дм3 СаСО3 в воде.
Происхождение жесткости
Ионы кальция (Ca2+) и магния (Mg2+), а также других щелочноземельных металлов, обуславливающих жесткость, присутствуют во всех минерализованных водах. Их источником являются природные залежи известняков, гипса и доломитов. Ионы кальция и магния поступают в воду в результате взаимодействия растворенного диоксида углерода с минералами и при других процессах растворения и химического выветривания горных пород. Источником этих ионов могут служить также микробиологические процессы, протекающие в почвах на площади водосбора, в донных отложениях, а также сточные воды различных предприятий.
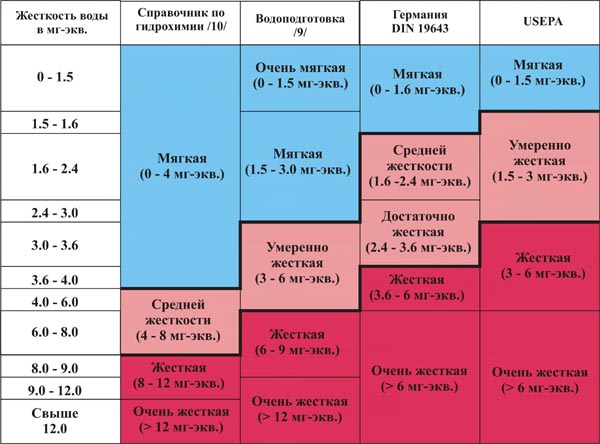
Жесткость воды колеблется в широких пределах и существует множество типов классификаций воды по степени ее жесткости. Ниже в таблице приведены целых четыре примера классификации. Две классификации из российских источников — из справочника «Гидрохимические показатели состояния окружающей среды» и учебника для вузов «Водоподготовка» /9/. A две — из зарубежных: нормы жесткости немецкого института стандартизации (DIN 19643) и классификация, принятая Агентством по охране окружающей среды США (USEPA) в 1986.
Таблица наглядно иллюстрирует гораздо более «жесткий» подход к проблеме жесткости «у них». Тому есть причины, о которых — ниже.
Обычно в маломинерализованных водах преобладает (до 70%-80%) жесткость, обусловленная ионами кальция (хотя в отдельных редких случаях магниевая жесткость может достигать 50-60%). С увеличением степени минерализации воды содержание ионов кальция (Са2+) быстро падает и редко превышает 1 г/л. Содержание же ионов магния (Mg2+) в высокоминерализованных водах может достигать нескольких граммов, а в соленых озерах — десятков граммов на один литр воды.
В целом, жесткость поверхностных вод, как правило, меньше жесткости вод подземных. Жесткость поверхностных вод подвержена заметным сезонным колебаниям, достигая обычно наибольшего значения в конце зимы и наименьшего в период половодья, когда обильно разбавляется мягкой дождевой и талой водой. Морская и океанская вода имеют очень высокую жесткость (десятки и сотни мг-экв/дм3).
Влияние жесткости на качество воды.
С точки зрения применения воды для питьевых нужд, ее приемлемость по степени жесткости может существенно варьироваться в зависимости от местных условий. Порог вкуса для иона кальция лежит (в пересчете на мг-эквивалент) в диапазоне 2-6 мг-экв/л, в зависимости от соответствующего аниона, а порог вкуса для магния и того ниже. В некоторых случаях для потребителей приемлема вода с жесткостью выше 10 мг-экв/л. Высокая жесткость ухудшает органолептические свойства воды, придавая ей горьковатый вкус и оказывая отрицательное действие на органы пищеварения.
Всемирная Организация Здравоохранения не предлагает какой-либо рекомендуемой величины жесткости по показаниям влияния на здоровье. В материалах ВОЗ говорится о том, что хотя ряд исследований и выявил статистически обратную зависимость между жесткостью питьевой воды и сердечно-сосудистыми заболеваниями, имеющиеся данные не достаточны для вывода о причинном характере этой связи. Аналогичным образом, однозначно не доказано, что мягкая вода оказывает отрицательный эффект на баланс минеральных веществ в организме человека.
Вместе с тем, в зависимости от рН и щелочности, вода с жесткостью выше 4 мг-экв/л может вызвать в распределительной системе отложение шлаков и накипи (карбоната кальция), особенно при нагревании. Именно поэтому нормами Котлонадзора вводятся очень жесткие требования к величине жесткости воды, используемой для питания котлов (0.05-0.1 мг-экв/л).
Кроме того, при взаимодействии солей жесткости с моющими веществами (мыло, стиральные порошки, шампуни) происходит образование «мыльных шлаков» в виде пены. Это приводит не только к значительному перерасходу моющих средств. Такая пена после высыхания остается в виде налета на сантехнике, белье, человеческой коже, на волосах (неприятное чувство «жестких» волос хорошо известное многим). Главным отрицательным воздействием этих шлаков на человека является то, что они разрушают естественную жировую пленку, которой всегда покрыта нормальная кожа и забивают ее поры. Признаком такого негативного воздействия является характерный «скрип» чисто вымытой кожи или волос. Оказывается, что вызывающее у некоторых раздражение чувство «мылкости» после пользования мягкой водой является признаком того, что защитная жировая пленка на коже цела и невредима. Именно она и скользит. В противном случае, приходится тратиться на лосьоны, умягчающие и увлажняющие кремы и прочие хитрости для восстановление той защиты кожи, которой нас и так снабдила матушка Природа.
Вместе с тем, необходимо упомянуть и о другой стороне медали. Мягкая вода с жесткостью менее 2 мг-экв/л имеет низкую буферную емкость (щелочность) и может, в зависимости от уровня рН и ряда других факторов, оказывать повышенное коррозионное воздействие на водопроводные трубы. Поэтому, в ряде применений (особенно в теплотехнике) иногда приходится проводить специальную обработку воды с целью достижения оптимального соотношения между жесткостью воды и ее коррозионной активностью.
Промышленные методы обессоливания и снижения жесткости воды
Единицы измерения жесткости воды — askepak — LiveJournal
upd к upd к посту http://askepak.livejournal.com/133531.htХм… В россыпи цифр важно разобраться не только в какой системе единиц они приводятся, но и понять, что подразумевается под этой системой. Ну, а поговорка (из предыдущего поста) оказалось требует продолжения,- дьявол кроется в мелочах, в которых сам черт ногу сломит.
Итак, — продолжение (даже не окончание…) темы Жесткость воды и единицы ее измерения.
Есть много разных единиц, в которых измеряется жесткость воды. Вот, например, — моль/м3. Казалось бы чего проще: 1 моль/м3 эквивалентен 40,08 г Ca2+ содержащегося в 1 м3 воды. Кальций взят потому, что соли кальция являются основным источником жесткости (можно и по магнию считать). А цифирь 40,08 взята из таблицы Менделеева и численно равна атомной массе элемента (кальция). Которая (по определению) и составляет 1 моль вещества.
В английской Википедии так прямо и написано: «mmol/L is equivalent to 100.09 mg/L CaCO3 or 40.08 mg/L Ca2+»
Есть там и табличка перевода в другие системы измерений. К примеру, 1 моль/м3 (1 ммоль/л) = 10,01 Французским градусам жесткости [1].
В Советском Союзе единицу жесткости воды определял ГОСТ 4151-72 [2]. Называлась единица также — моль/м3. В ГОСТе приводилась методика измерений. Но из этой методики (если в ней разбираться) следовало, что моль в ней совсем не моль, а — «полу-моль». Т.е. советский 1 моль/м3 соответствовал 20,04 г Ca2+ содержащегося в 1 м3 воды.
Для химиков, наверно, ничего странного в таком — двойственном — использовании (казалось бы, одной и той же) единицы измерения нет. Дело в том, что зарядов ионов кальция в единице объема раствора в два раза больше, чем самих ионов кальция: т.е., если молярная концентрация кальция в растворе равна, например, 1 моль/м3, то нормальная (эквивалентная) – 2 моль/м3.
Вот, и пойми, какие моли имел ввиду ГОСТ — молярные или эквивалентные? Не один я оказался таким непонятливым, вот, к примеру, один товарищ разбирается в этом вопросе [3].
А на Западе, похоже, никто и не пытался разбираться. Есть у меня посудомойка «Электролюкс», в инструкции к ней имеется табличка с градациями жесткости используемой воды (чтобы правильно задать режим работы). Жесткость там приводится в разных системах измерений. Возмем, к примеру, те же Французские градусы и сопоставим с молями. Из инструкции следует, что 1 ммоль/л = 10 Французским градусам. А должно быть равно 5-ти!
В России для измерения жесткости стали использовать мг-экв./л, что подчеркивало «полу-мольность» единицы, т.е. концентрация кальция — нормальная (эквивалентная). Затем и вовсе отказались, ввели Русский градус Жесткости.
По существу, все три единицы измерения — советские (и беларуские) «моль/м3» («ммоль/л»), российские «мг-экв./л» и «град.Ж» — равны между собой. Единственно, следует отличать «Западные» «моль/м3», за них двух «Наших» дают.
И это еще не все заморочки с единицами жесткости воды…
[1] http://en.wikipedia.org/wiki/Hard_water
[2] например, здесь: http://www.znaytovar.ru/gost/2/GOST_415172_Voda_pitevaya_Meto.html
[3] http://www.chemport.ru/forum/viewtopic.php?f=12&t=34027
Жесткость воды — это… Что такое Жесткость воды?
Жёсткость воды — совокупность химических и физических свойств воды, связанных с содержанием в ней растворённых солей щёлочноземельных металлов, главным образом, кальция и магния. Вода с большим содержанием таких солей называется жёсткой, с малым содержанием — мягкой. Различают временную жёсткость, образованную гидрокарбонатами и постоянную жёсткость, вызванную присутствием других солей. Временная жёсткость может быть устранена кипячением.
Жёсткая вода при умывании сушит кожу, в ней плохо образуется пена при использовании мыла. Использование жёсткой воды вызывает появление осадка (накипи) на стенках котлов, в трубах и т. п. В тоже время, использование слишком мягкой воды может приводить к коррозии труб, так как, в этом случае отсутствует кислотно-щелочная буферность, которую обеспечивает гидрокарбонатная (временная) жёсткость. Потребление жёсткой или мягкой воды обычно не является опасным для здоровья, хотя есть данные о том, что высокая жёсткость способствует образованию мочевых камней, а низкая — незначительно увеличивает риск сердечно-сосудистых заболеваний.
Жёсткость природных вод может варьироваться в довольно широких пределах и в течение года непостоянна. Увеличивается жёсткость из-за испарения воды, уменьшается в сезон дождей, а также в период таяния снега и льда.
Единицы измерения
Для численного выражения жёсткости воды указывают концентрацию в ней катионов кальция и магния. Рекомендованная единица СИ для измерения концентрации — моль на кубический метр (моль/м3), однако, на практике для измерения жёсткости чаще используется миллимоль на литр (ммоль/л).
В России для измерения жёсткости чаще используется нормальная концентрация ионов кальция и магния, выраженная в миллиграмм-эквивалентах на литр (мг-экв/л). Один мг-экв/л соответствует содержанию в литре воды 20,04 миллиграмм Ca2+ или 12,16 миллиграмм Mg2+ (атомная масса делённая на валентность).
Иногда указывают концентрацию, отнесённую к единице массы, а не объёма, особенно, если температура воды может изменяться или если вода может содержать пар, что приводит к существенным изменениям плотности.
В разных странах использовались (иногда используются до сих пор) различные внесистемные единицы — градусы жёсткости.
| Градус | Обозначение | Определение | Величина | |
|---|---|---|---|---|
| мг-экв/л | ммоль/л | |||
| Немецкий | °dH (dergees of hardness), °dGH (German (Deutsche) Hardness), °dKH (для карбонатной жёсткости) | 1 часть оксида кальция (СаО) или 0.719 частей оксида магния (MgO) на 100 000 частей воды | 0,357 | 0,179 |
| Английский | °e | 1 гран CaCO3 на 1 английский галлон воды | 0,285 | 0,142 |
| Французский | °TH | 1 часть CaCO3 на 100000 частей воды | 0,200 | 0,100 |
| Американский | 3 на 1 000 000 частей воды | 0,02 | 0,01 | |
В СССР до 1952 года использовали градусы жёсткости, совпадавшие с немецкими.
По величине общей жёсткости различают воду мягкую (до 2 мг-экв/л), средней жесткости (2-10 мг-экв/л) и жёсткую (более 10 мг-экв/л). Жёсткость воды поверхностных источников существенно колеблется в течение года; она максимальна в конце зимы, минимальна — в период паводка (например, жёсткость волжской воды в марте — 4,3 мг-экв/л, в мае — 0,5 мг-экв/л[1]). В подземных водах жёсткость обычно выше (до 80-100 мг-экв/л) и меньше изменяется в течение года.
Методы устранения
Обратный осмос. Метод основан на прохождении воды через полупроницаемые мембраны (как правило, полиамидные). Вместе с солями жёсткости удаляется и большинство других солей. Эффективность очистки может достигать 99,9 %. Этот метод нашёл наибольшее применение в бытовых системах подготовки питьевой воды. В качестве недостатка данного метода следует отметить необходимость предварительной подготвки воды, подаваемой на обратноосмотическую мембрану.
Электродиализ. Основан на удалении из воды солей под действием электрического поля. Удаление ионов растворенных веществ происходит за счёт специальных мембран. Так же как и при использовании технологии обратного осмоса, происходит удаление и других солей, помимо ионов жёсткости.
Термический способ. Основан на нагреве воды, устраняет только временную (карбонатную) жёсткость. Находит применение в быту. В промышленности применяется, например, на ТЭЦ.
Реагентное умягчение. Метод основан на добавлении в воду соды или гашеной извести. При этом соли кальция и магния переходят в нерастворимые соединения и, как следствие, выпадают в осадок. Этот метод оправдан при относительно больших расходах воды, поскольку связан с решением ряда специфических проблем: фильтрации осадка, точной дозировки реагента.
Катионирование. Метод основан на использовании ионообменной гранулированной загрузки (чаще всего ионообменные смолы). Такая загрузка при контакте с водой поглощает катионы солей жёсткости (кальций и магний). Взамен, в зависимости от ионной формы, отдавая ионы натрия или водорода. Эти методы соответственно называются Na-катионирование и Н-катионирование. Как правило, жёсткость воды снижается при одноступенчатом натрий-катионировании до 0,05-0,1 мг-экв/л, при двухступенчатом — до 0,01 мг-экв/л.
Ссылки
Примечания
- ↑ Химическая энциклопедия. — М.: Советская энциклопедия, 1990. Т. 2. С. 145.
Wikimedia Foundation. 2010.
жесткость воды — с русского на английский
См. также в других словарях:
ЖЕСТКОСТЬ ВОДЫ — ЖЕСТКОСТЬ ВОДЫ, зависит от присутствия в ней известковых и магнезиальных солей. Соли кальция и магния содержатся в воде гл. обр. в виде двууглекислых и отчасти в виде сернокислых соединений; в значительно меньших количествах и значительно реже… … Большая медицинская энциклопедия
ЖЕСТКОСТЬ ВОДЫ — совокупность свойств воды, обусловленная наличием в ней преимущественно солей кальция и магния. Использование жесткой воды приводит к осаждению твердого осадка (накипи) на стенках паровых котлов, теплообменников, затрудняет варку пищевых… … Большой Энциклопедический словарь
ЖЕСТКОСТЬ ВОДЫ — (Stiffness of Water) свойство воды, обусловливаемое содержанием растворенных в ней солей щелочноземельных металлов, гл. обр. кальция и магния (в виде двууглекислых солей бикарбонатов), и солей сильных минеральных кислот серной и соляной. Ж. В.… … Морской словарь
ЖЕСТКОСТЬ ВОДЫ — качество воды, обусловленное содержанием солей кальция и магния и выражаемое в градусах. В СССР принят немецкий градус, соответствующий содержанию 10 мг окиси кальция или 7,19 мг окиси магния в 1 л воды. Различают Ж. в. общую, постоянную и… … Технический железнодорожный словарь
ЖЕСТКОСТЬ ВОДЫ — свойство воды, обусловленное содер. в ней Са2+ и Mg2+. Ж. в. выражается в мг экв|л, реже в нем. град. 1 мг экв/л. Ж. в. отвечает содер. 20,04 мг/л Са2+ или 12,15 мг/л Mg2+. Различают Ж. в. общую (общее содер. в воде Ca и Mg, устранимую, или… … Геологическая энциклопедия
ЖЕСТКОСТЬ ВОДЫ — содержание в воде солей щелочноземельных металлов кальция и магния. Различают кальциевую и магниевую Ж. в., а суммарная концентрация этих солей называется общей Ж. Вода считается мягкой при жесткости (в нем. град.) от 0 до 4, жесткой от 12 до 20 … Прудовое рыбоводство
жесткость воды — Свойство воды, обусловленное присутствием в ней ионов кальция и магния. [ГОСТ 27065 86] жёсткость воды Свойство воды, обусловленное содержанием в ней солей кальция или магния, вызывающих образование твёрдого осадка [Терминологический словарь по… … Справочник технического переводчика
жесткость воды — – совокупность свойств воды, обусловленная наличием в ней катионов кальция, магния и железа (II), а также ее количественная мера, равная числу милимолей этих катионов в литре воды. Словарь по аналитической химии [3] … Химические термины
Жесткость воды — свойство воды (не мылиться, давать накипь в паровых котлах), связанное с содержанием растворимых в ней соединений кальция и магния … Геологические термины
ЖЕСТКОСТЬ ВОДЫ — ЖЕСТКОСТЬ ВОДЫ, неспособность воды образовывать пену с мылом из за растворенных в ней солей, в основном кальция и магния. Накипь в котлах и трубах образуется из за присутствия в воде (1) растворенного карбоната кальция (2), попадающего в воду при … Научно-технический энциклопедический словарь
ЖЕСТКОСТЬ ВОДЫ — Свойство воды, обусловленное присутствием в ней ионов кальция и магния (ГОСТ 27065 86) Словарь бизнес терминов. Академик.ру. 2001 … Словарь бизнес-терминов
единица жёсткости воды — с русского на английский
Жёсткость воды — Жёсткость воды совокупность химических и физических свойств воды, связанных с содержанием в ней растворённых солей щёлочноземельных металлов, главным образом, кальция и магния (так называемых «солей жёсткости»). Содержание 1 Жёсткая и… … Википедия
Жесткость воды — Жёсткость воды совокупность химических и физических свойств воды, связанных с содержанием в ней растворённых солей щёлочноземельных металлов, главным образом, кальция и магния. Вода с большим содержанием таких солей называется жёсткой, с малым… … Википедия
Жесткая вода — Жёсткость воды совокупность химических и физических свойств воды, связанных с содержанием в ней растворённых солей щёлочноземельных металлов, главным образом, кальция и магния. Вода с большим содержанием таких солей называется жёсткой, с малым… … Википедия
Жёсткая вода — Жёсткость воды совокупность химических и физических свойств воды, связанных с содержанием в ней растворённых солей щёлочноземельных металлов, главным образом, кальция и магния. Вода с большим содержанием таких солей называется жёсткой, с малым… … Википедия
Мягкая вода — Жёсткость воды совокупность химических и физических свойств воды, связанных с содержанием в ней растворённых солей щёлочноземельных металлов, главным образом, кальция и магния. Вода с большим содержанием таких солей называется жёсткой, с малым… … Википедия
градус — а; м. [от лат. gradus ступень] 1. Единица измерения угла или дуги, равная 1/360 окружности; соответствующее деление на шкале транспортира. Угол в тридцать градусов. Г. северной, южной широты (1/360 земного меридиана). Г. восточной, западной… … Энциклопедический словарь
Градус — I м. 1. Единица измерения плоского угла и дуги, равная 1/90 части прямого угла или 1/360 окружности. отт. Соответствующее деление на шкале транспортира. 2. Единица измерения температуры (воздуха, воды, человеческого тела и т.п.). отт.… … Современный толковый словарь русского языка Ефремовой
ГРАДУС — (лат. gradus шаг, ступень, степень), 1) общее наименование разл. единиц темп ры, соответствующих разным температурным шкалам. Различают Г. шкалы Кельвина, или кельвин (К), градус Цельсия СО, градусы Реомюра (°R), Фаренгейта (Т). Единицы деления… … Естествознание. Энциклопедический словарь
ГРАДУС — (1) внесистемная единица измерения плоского угла и дуг окружности, равная 1/360 окружности; угол в один градус обозначается: 1°; (2) единица температурного интервала, имеющая разное значение в разных температурных шкалах, напр. Г. Цельсия (°С),… … Большая политехническая энциклопедия
Морфология (лингвистика) — У этого термина существуют и другие значения, см. Морфология. … Википедия