1.3.1. Жесткость воды (dH), используемой для приготовления увлажняющего раствора
Наличие примесей и соответственно качество воды, использующейся типографиями, зависит от разных факторов типа почв в данном регионе, природно-климатических условий местности и т.д.
Природная вода содержит не только молекулы Н2О, но и другие компоненты:
кальций, магний, натрий;
бактерии, водоросли;
железо;
гидрокарбонаты;
хлориды, сульфиты, нитраты;
водород, кислород, двуокись углерода;
взвешенные вещества.
Поэтому, наряду с величиной рН увлажняющего раствора следует обращать внимание и на общую жесткость воды (dH — показатель жесткости, называемый градусом жесткости), используемой для приготовления увлажняющего раствора. Величины эти тесно связаны между собой (таблица 1).
Жёсткость воды —
совокупность химических и физических
свойств воды, связанных с содержанием
в ней растворённых солей щелочноземельных
металлов, главным образом, кальция и
магния. Вода с большим содержанием таких
солей называется жёсткой, с малым
содержанием — мягкой. Различают
временную жёсткость (карбонатную),
образованную гидрокарбанатами и
постоянную жёсткость (некарбонатную),
вызванную присутствием других солей.
Временная жёсткость обусловлена
присутствием в воде гидрокарбонатов
кальция и магния (Са(НСО3)2;
Mg(НСО3)2).
Постоянная жесткость воды обусловлена
присутствием в воде сульфатов, хлоридов
Са и Mg (CaSO
Этот параметр указывается в немецких градусах жесткости (в России — в мг-экв/л; 1мг-экв/л = 2,8° dH).
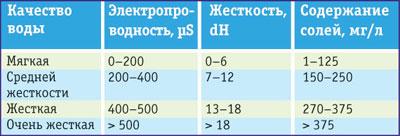
Таблица 1 Влияние примесей на качество воды

Существует несколько степеней жесткости воды (по dH) (таблица 2):
Таблица 2 Физико-химические свойства воды
Жесткая вода вызывает образование солевых отложений на красочных валиках, резинотканевом полотне, печатной форме, а также на увлажняющих валиках и в системе циркуляции увлажняющего раствора.
Большую часть жесткости образует гидрокарбонат кальция. Это вещество может различным образом отрицательно влиять на печатный процесс. Оно легко превращается в нерастворимую известь. Поскольку в процессе офсетной печати часть увлажняющего раствора с печатной формы попадает в красочный аппарат и там частично испаряется, известь может осаждаться в мелких порах резиновых валиков красочного аппарата. При спиртовом увлажняющем аппарате испарение происходит интенсивнее, и этот процесс протекает быстрее. Ввиду того, что карбонат кальция гидрофилен, поверхность валиков теряет свои олеофильные свойства. Вода удерживается на валике и препятствует тому, чтобы валик мог передать достаточное количество краски. Расщепление краски прерывается, она не достаточно прочно держится на валиках. Кальций реагирует с жирными кислотами краски. При этом образуется известковое мыло, которое способствует механическому истиранию поверхности валиков, что приводит к ухудшению передачи цвета и преждевременному износу валиков.
При повышенном содержании гидрокарбоната в воде увеличивается рН. Для поддержания значения рН в рекомендуемом для офсетной технологии печати диапазоне (от 4,8 до 5,5) используются буферные добавки к увлажняющему раствору. Для разных уровней жесткости водопроводной воды предлагаются специальные добавки к растворам с разной буферной мощностью и получаемыми значениями рН.
Отметим, что жесткость не понижается добавками: они лишь устраняют отрицательные воздействия жесткой воды на процесс печати. В таких концентратах содержатся специальные компоненты — комплексообразователи, которые, преобразуя соли кальция в хорошо растворимые соединения, компенсируют высокую жесткость воды и не дают солям кальция кристаллизоваться. В состав концентратов для увлажнения также входят ингибиторы коррозии — вещества, защищающие металлические части печатной машины от разрушающего воздействия воды.
Оптимальным диапазоном жесткости воды (Рисунок 16.) применяемой для изготовления увлажняющего раствора принято считать диапазон от 5 до 12° dH.
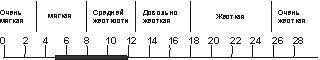 Рисунок
16 — Благоприятная величина dH для офсетной
печати
Рисунок
16 — Благоприятная величина dH для офсетной
печати
При dH не соответствующем указанным параметрам, в процессе печати тиража могут возникнуть следующие проблемы:
при показателе жесткости меньше 5° dH мягкая вода усиливает способность краски к эмульгированию, она быстрее, чем жесткая, окисляет печатные формы и вызывает коррозию механических частей печатной машины;
при показателе жесткости более 12° dH на валиках, офсетном полотне, печатной форме образуется нерастворимый известковый осадок, что приводит к нарушению печатного процесса. Кроме того, соли кальция и магния взаимодействуют с жирными кислотами, содержащимися в печатных красках (происходит «омыление») и жирный слой оседает на офсетной форме, накатных и увлажняющих валиках, вызывая тенение в процессе печати тиража.
Существует множество способов определения жесткости воды: от сложных, требующих проведения специальных тестов, основанных на титровании, до самых простых – использования индикаторных бумажек или приборов для измерения жесткости воды.
Существует несколько методов подготовки воды (таблица 3):
Обратный осмос.
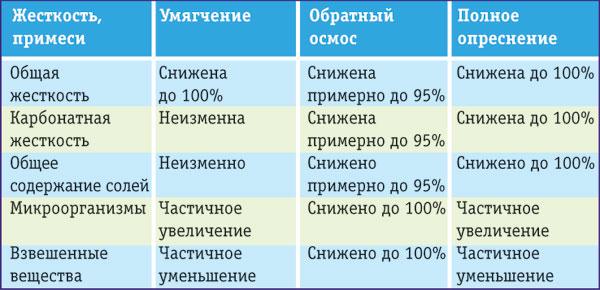
Таблица 3 Способы подготовки воды
Метод основан на прохождении воды через полупроницаемые мембраны (как правило, полиамидные). Вместе с солями жёсткости удаляется и большинство других солей (Рисунок 17). Эффективность очистки может достигать 99,9 %. Этот метод нашёл наибольшее применение в бытовых системах подготовки питьевой воды. В качестве недостатка данного метода следует отметить необходимость предварительной подготовки воды, подаваемой на обратноосмотическую мембрану.
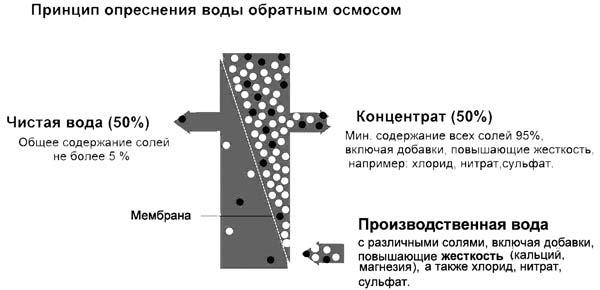
Рисунок 17 — Система обратного осмоса
Оптимальный результат печати достигается с водой общей жесткостью 7–10° dH, карбонатной 3–4° dH. Поэтому в обессоленную воду вводят специальные добавки (например, XtraMax Water Mineral F12), чтобы установить жесткость обессоленной воды на уровне 7–10°dH. XtraMax Water Mineral F12, используется в ситуациях, когда вода обработана обратным осмосом в связи с ее сильной жесткостью или неприемлемых отклонений качества, например, из-за сезонных факторов. Добавление XtraMax Water Mineral F12 к обработанной воде восстанавливает ее качество на оптимальный уровень печати. Добавление 0,5% XtraMax Water Mineral F12 делает жесткость воды 10 °dH. Твердость 8 – 12 °dH считается лучшей для офсетной печати. Данный реминерализатор совместим со всеми добавками для увлажняющих растворов.
Электродиализ.
Основан на удалении из воды солей под действием электрического поля. Удаление ионов растворенных веществ происходит за счёт специальных мембран. Так же как и при использовании технологии обратного осмоса, происходит удаление и других солей, помимо ионов жёсткости.
Термический способ.
Реагентное умягчение.
Метод основан на добавлении в воду содыилигашеной извести. При этом соли кальция и магния переходят в нерастворимые соединения и, как следствие, выпадают в осадок. Этот метод оправдан при относительно больших расходах воды, поскольку связан с решением ряда специфических проблем: фильтрации осадка, точной дозировки реагента.
Катионирование.
Метод основан на использовании ионообменной гранулированной загрузки (чаще всего ионообменные смолы). Такая загрузка при контакте с водой поглощает катионы солей жёсткости (кальций и магний, железо и марганец). Взамен, в зависимости от ионной формы, отдавая ионы натрияиливодорода. Эти методы соответственно называются Na-катионирование и Н-катионирование. При правильно подобранной ионообменной загрузке жёсткость воды снижается при одноступенчатом натрий-катионировании до 0,05-0,1 мг-экв/л, при двухступенчатом — до 0,01 мг-экв/л.
Лучшим реагентом для устранения общей жесткости воды является ортофосфат натрия Na3PO4:
3Ca(HCO3)2 + 2Na3PO4 → Ca3(PO4)2↓+ 6NaHCO3
3MgSO
Ортофосфаты кальция и магния очень плохо растворимы в воде, поэтому достигается лучшее умягчение воды. В промышленности с помощью ионообменных фильтров заменяют ионы кальция и магния на ионы натрия и калия, получая мягкую воду. Определенное умягчение воды происходит и в бытовых фильтрах для питьевой воды. Отфильтрованная вода дает меньше накипи. Полностью очистить воду можно методом перегонки(дистилляцией)
Важной характеристикой воды является карбонатная жесткость (сН) – уровень содержания гидрокарбонатов (НСО3). При повышенном содержании гидрокарбонатов в воде (свыше 250 мг/л) показатель рН нестабилен.
Содержание в воде хлоридов, сульфатов и нитратов не должны выходить за рамки рекомендованных для них значений, так как они могут вызвать коррозию. Наличие даже незначительных примесей хлора также сказывается — оказывает негативное воздействие на офсетную резину и валики.
Наличие и концентрация всех перечисленных примесей, а соответственно и качество воды, используемой типографиями, зависит от разных факторов: типа почвы в регионе, где расположено предприятие, природно-климатических условий местности и даже времени года. Точное содержание солей в воде (ее жесткость) определяется с помощью специальных тестов титрованием.
При использовании очень жесткой воды рекомендуется проводить профилактическую очистку красочных и увлажняющих (особенно накатных) валиков, офсетного резинотканевого полотна средствами для снятия глазури.
В некоторых типографиях проблему решают, устанавливая фильтры для очистки и снижения жесткости водопроводной воды и дополнительные фильтры в системе циркуляции увлажняющего раствора, поступающего из ванн увлажнения в бак. Или используют специальные способы подготовки воды для увлажняющего раствора.
Жесткая вода вызывает образование солевых отложений на красочных валиках, резинотканевом полотне, печатной форме, а также на увлажняющих валиках и в системе циркуляции увлажняющего раствора.
Еще одним фактором, влияющим на систему увлажнения (засоряющим ее) являются микроорганизмы. Они попадают в машину из окружающей среды: воды, воздуха, бумаги, пыли. К микроорганизмам относятся: водоросли, грибки (дрожжевые, плесневые и др.) и бактерии. Увлажняющий раствор — подходящая для них среда обитания. Находя в нем пищу, микроорганизмы изменяют рН увлажнения и нарушают процесс печати. Быстрому росту микроорганизмов подвергается система увлажнения, если она не очищается и на стенках бака увлажнения и периферии накапливаются отложения бумажных волокон, краски, гуммирующих средств и т. д. Наличие микроорганизмов в воде определяется с помощью специальных тестов.
Бактерии и водоросли вызывают коррозию металла. Они потребляют и разлагают кислоту, и рН растет. Рост микроорганизмов нарушает циркуляцию увлажнения в системе, снижается производительность и качество печати, появляется неприятный запах, возникает риск заболевания рабочих.
В течение года состав воды меняется. Особенно весной и осенью, когда талые воды и дожди несут в водопроводную систему массу примесей. Сама талая вода намного мягче артезианской. Жесткость воды в зависимости от времени года может быть разной. Нужно отслеживать эти изменения, и, при необходимости, иметь в запасе концентраты увлажнения для воды разной жесткости.
Жесткость воды
Что такое жесткость воды? Классификация воды по классу жесткости.
Различный суммарный уровень растворенных в воде солей кальция Са и магния Mg характеризует так называемую общую жесткость воды. Гидрокарбонаты магния и калия образуют карбонатную (временную) жесткость, которая полностью устраняется при длительном кипячении воды, но переходит в нерастворимый осадок с выделением углекислого газа.
Налет или накипь на поверхностях теплообмена, равно как и углекислый газ, ведущий к интенсивной коррозии металлов, являются факторами, существенно влияющими на эффективность парового оборудования, прежде всего мощных котлов. Поэтому умягчение воды требует последующего удаления образующегося углекислого газа и удаления нерастворимых солей.

Углекислый газ высвобождается при нагреве воды и удаляется воздухоотводчиками. Нерастворимые соли удаляются из систем периодической промывкой котлов.
Свойство воды омывать поверхности, не оставляя налета, хорошо известно в быту. Мягкая вода хорошо мылится, и после нее остается только естественный слой жира, выделяемый поверхностным слоем кожи. При жесткой воде остается остается ощущение некоторого дополнительного неестественного покрова.
Измеряется общая жесткость в разных странах в своих единицах:
— ppm (или мг/литр) CaCO3;
— dH (немецкий градус жесткости) — Германия;
— f (французский градус жесткости) — Франция;
— мг-экв/л.
При жесткости до 4 мг-экв/л вода считается мягкой;
от 4 до 8 мг-экв/л — средней жесткости,
от 8 до 12 мг-экв/л — жесткой;
свыше 12 мг-экв/л — особо жесткой.
ОЦЕНКА ЖЕСТКОСТИ ВОДЫ.
Для оценки жесткости воды, показания прибора преобразуйте в соответствии со следующим правилом:
1 dH (Немецкий градус) = 17.8 ppm
1 f (Французский градус) = 10 ppm
1 мг-экв/л = 50.05 ppm
Влияние воды и растворенных в ней веществ на организм человека.
Роль воды в организме человека. Человек состоит из воды на 70-80%; мозг человека — на 85%; эмбрион — на 95%; меньше всего воды в костях — 30%. Вода — основной растворитель в человеческом организме, в ней переносятся все вещества — соли, кислород, ферменты, гормоны. Поэтому все вещества, вырабатываемые нашим организмом, водорастворимы. При растворении веществ очень важен химический состав воды, ведь чем больше посторонних примесей в воде, тем хуже она растворяет вещества. (Например, водопроводная вода на 1/5 часть уже занята посторонними примесями и человеку остается только 4/5 от выпитого объема). Все органические соединения, находящиеся в воде, можно условно разделить на мелкие (размер молекулы — меньше 100 килодальтон) и крупные (размер молекулы — от 100 килодальтон). Наиболее опасны для человека крупные органические соединения, которые на 90% являются канцерогенами или мутагенами. Наиболее опасны хлорорганические соединения, образующиеся при кипячении хлорированной воды, т.к. они являются сильными канцерогенами, мутагенами и токсинами. Остальные 10% крупной органики в лучшем случае нейтральны в отношении организма. Полезных для человека крупных органических соединений, растворенных в воде, всего 2-3 (это ферменты, необходимые в очень малых дозах). Воздействие органики начинается непосредственно после питья. В зависимости от дозы это может быть 18-20 дней или, если доза большая, 8-12 месяцев.
Все органические соединения, находящиеся в воде, можно условно разделить на мелкие (размер молекулы — меньше 100 килодальтон) и крупные (размер молекулы — от 100 килодальтон). Наиболее опасны для человека крупные органические соединения, которые на 90% являются канцерогенами или мутагенами. Наиболее опасны хлорорганические соединения, образующиеся при кипячении хлорированной воды, т.к. они являются сильными канцерогенами, мутагенами и токсинами. Остальные 10% крупной органики в лучшем случае нейтральны в отношении организма. Полезных для человека крупных органических соединений, растворенных в воде, всего 2-3 (это ферменты, необходимые в очень малых дозах). Воздействие органики начинается непосредственно после питья. В зависимости от дозы это может быть 18-20 дней или, если доза большая, 8-12 месяцев.
Содержащиеся в воде ионы тяжелых металлов, попадая в наш организм, остаются там навсегда, вывести их можно только с помощью белков молока и белых грибов. Достигая определенной концентрации в организме, они начинают свое губительное воздействие — вызывают отравления, мутации. Кроме того, что сами они отравляют организм человека, они еще и чисто механически засоряют его — ионы тяжелых металлов оседают на стенках тончайших систем организма и засоряют почечные каналы, каналы печени, таким образом снижая фильтрационную способность этих органов. Соответственно, это приводит к накоплению токсинов и продуктов жизнедеятельности клеток нашего организма, т.е. самоотравление организма, т.к. именно печень отвечает за переработку ядовитых веществ, попадающих в наш организм, и продуктов жизнедеятельности организма, а почки — за их выведение наружу. К тяжелым металлам относятся Pb (свинец), Al (алюминий), Mn (марганец), Si (кремний), Fe (железо), Se (селен), Zn (цинк), Hg (ртуть), Cd (кадмий).
Марганец забивает канальцы нервных клеток. Снижается проводимость нервного импульса, как следствие повышается утомляемость, сонливость, снижается быстрота реакции, работоспособность, появляются головокружение, депрессивные, подавленные состояния. Особенно опасны отравления марганцем у детей и эмбрионов (когда женщина беременна) — приводит к идиотии. Из 100 детей, матери которых во время беременности подверглись отравлению марганцем, 96-98 рождаются идиотами. Есть также теория, что токсикозы на ранних и поздних сроках беременности вызываются марганцем. В водопроводной воде — избыток марганца. Кроме воды марганец содержится в воздухе из-за производственных выбросов. В природе марганец затем накапливается в грибах и растениях, попадая таким образом в пищу. Марганец почти невозможно вывести из организма; очень тяжело диагностировать отравление марганцем, т.к. симптомы очень общие и присущи многим заболеваниям, чаще же всего человек просто не обращает на них внимания.
Алюминий так же оказывает общее отравляющее и засоряющее действие на организм человека. В водопроводной воде его избыток связан с тем, что излишки железа на водозаборе удаляют сульфатом алюминия. Реагируя с ионами железа, сульфат алюминия дает нерастворимый осадок, в который выпадает, в принципе и железо, и алюминий, но в реальности в воде остается и железо, и алюминий.
Селен необходим человеку в очень малых дозах, при малейшем превышении дозы он превращается в канцероген, мутаген и токсин. Человеку можно безопасно восполнить недостаток селена с помощью специальных минеральных комплексов; селен также содержится в морской капусте.

Железо бывает в природе в трех состояниях — молекулярное железо F0(когда оно куском), Fe2+ — необходимо в организме человека как переносчик кислорода (в молекуле гемоглобина 4 иона F2+) и F3+ — вредное для человека — оно и есть ржавчина. Железо необходимо организму человека, но только в определенной пропорции и в виде иона F2+. В водопроводной воде большой избыток железа, т.к. в природной воде его много, плюс ржавые трубы, по которым течет вода к потребителям.
Кальций необходим в организме человека для строения костной ткани (зубы, кости), мышечной ткани (мышцы, мышца сердца), поддержания проводящей функции нервной ткани. При избытке кальций нейтрален по отношению к организму человека, однако, это снижает качество воды — соли кальция образуют накипь и мутность воды.
Магний необходим для нормальной деятельности нервных клеток. Однако, его количество в воде должно быть ограниченно, т.к.
при избытке он действует на подобие марганца — засоряет канальцы нервных клеток, только он менее активен и проще выводится из организма.
Калий также необходим для нормальной жизнедеятельности организма, т.к. является компонентом калий-натриевого насоса. Калий-натриевый насос — это структура на мембране каждой клетки, благодаря которой в клетку проникают вещества из межклеточной жидкости, а из клетки выводятся продукты ее жизнедеятельности. Кроме того, особенно важен калий для сердечно-сосудистой деятельности, т.к. он нормализует давление крови и работу сердца.
Жесткость воды.
Жесткость во
ды определяется концентрацией ионов щелочноземельных металлов. К ним относятся преимущественно хлориды, сульфаты, гидрокарбонаты и т. д. По жесткости вода дополнительно подразделяется на:
• мягкую (до 7 °dH),
• средней жесткости (до 14 °dH),
• жесткую (до 21 °dH) и очень жесткую (> 21 °dH).
Чем выше степень жесткости, тем больше ионов содержится в воде. В настоящее время обозначение °dH (“градус немецкой жесткости”) вышло из употребления и применяется ммоль/л.
Для численного выражения жёсткости воды указывают концентрацию в ней катионов кальция и магния. Рекомендованная единица системы СИ для измерения концентрации — моль на кубический метр (моль/м³), однако, на практике для измерения жёсткости чаще используется миллимоль на литр (ммоль/л). В России для измерения жёсткости чаще используется нормальная концентрация ионов кальция и магния, выраженная в миллиграмм-эквивалентах на литр (мг-экв/л). Один мг-экв/л соответствует содержанию в литре воды 20,04 миллиграмм Ca2+ или 12,16 миллиграмм Mg2+ (атомная масса делённая на валентность). Числовое значение жесткости, выраженное в молях на кубический метр равно числовому значению жесткости, выраженному в миллиграмм эквивалентах на литр (или кубический дециметр), т.е.: 1моль/м3=1ммоль/л=1мг-экв/л=1мг-экв/дм3. Иногда указывают концентрацию, отнесённую к единице массы, а не объёма, особенно, если температура воды может изменяться или если вода может содержать пар, что приводит к существенным изменениям плотности. В разных странах использовались (иногда используются до сих пор) различные внесистемные единицы — градусы жёсткости.
В СССР до 1952 года использовали градусы жёсткости, совпадавшие с немецкими.
кислотность (pH), жесткость (dH) и др показатели
Вода является жизненным пространством для рыб и растений, так же как и воздух для человека является жизненным пространством. В зависимости от свойств вода способствует развитию жизненных процессов или тормозит их. Вода содержит вещества, придающие ей такие свойства как, как цвет, прозрачность, запах, а также значения жесткости dH и водородного показателя pH.
Для аквариума пригодна чистая, прозрачная, содержащая все необходимые для растений микроэлементы водопроводная вода с dH 5-20%, KH 2-15 градусов, pH 6,5-7,5. Но такая вода содержит чрезмерное количество воздуха и хлора. Поэтому она должна отстаиваться 3-4 дня. Бывает встает вопрос, где достать воду людям, живущим без водопровода, например, в сельской местности. Ответ: воду в таких местностях можно брать из чистых ручьев, родников, колодцев. Кроме того, там не должно быть вредных соединений: серный водород, минеральные соли, оксид железа. После заливки новой воды в аквариум в воде происходят различные процессы. Из-за этого вода может стать беловато-мутной, но вскоре она опять становится прозрачной. Если наклониться над нормально функционирующим аквариумом, то чувствуется легкий запах растений. Всякий другой запах указывает на неблагополучие процессов, проходящих в аквариуме. В этом случае нужно провести основательную чистку грунта и части воды. Хорошая вода — это вода богатая кислородом, свободная от органических отходов, лишенная пузырьков газа и хлора, отфильтрованная от нечистот и мути.
Такой параметр как кислотность воды оказывает большое влияние на биохимические и биологические процессы и имеет важное значение в жизни рыб. В зависимости от кислотности вода классифицируется так: pH = 1-3 сильнокислотная вода 3-5 кислая вода 5-6 слабокислая вода 7 нейтральная вода 7-8 очень слабощелочная вода 8-9 слабощелочная вода 9-10 щелочная вода 10-14 сильнощелочная вода. Кислотность водопроводной воды примерно 7pH. Многие рыбы вполне безболезненно переносят отклонения от нейтрального показателя(7). Это объясняется тем, что организм имеет целый ряд систем, сглаживающих резкие колебания pH.
В процессах фотосинтеза, протекающих на свету, растения потребляют углекислый газ, что повышает уровень pH, а ночью понижается, что связано не только с отсутствием фотосинтеза, но и с выделением CO2 при дыхании растений. Вообще, в аквариумах биологические процессы окисления преобладают над процессами восстановления; в связи с этим кислотность воды со временем понижается.
Для содержания аквариумных рыб не годится сильнокислая, кислая, щелочная и сильнощелочная вода. Вода должна быть слабокислой, нейтральной, очень слабощелочной. Резкое изменение кислотности воды может стать причиной гибели рыб. Чтобы этого избежать, следует менять воду небольшими порциями и наливать воду нужно небольшими порциями. Переносить рыб из аквариума в аквариум надо тоже осторожно.
Повысить уровень pH (сделать более щелочной)
Повысить уровень можно с помощью питьевой воды, т.е. добавить в воду питьевой воды. Также можно добавить немного бикарбоната натрия или смешать ее со щелочной водопроводной водой. Чтобы повысить уровень pH до значения 7, т.е. сделать ее нейтральной, следует производить ее аэрацию или прокипятить.
Понизить уровень pH (сделать ее более кислой)
Можно добавить в воду немного торфа, взятый на возвышенностях или отфильтрованный экстракт, получившийся после кипячения торфа. Также можно подкислить воду с помощью бифосфата натрия. Измерить уровень pH. Измерить уровень в домашних условиях можно применением индикаторных бумаг. Определение сводится к опусканию полоски индикаторной бумаги в аквариумную воду и быстрому сравнению приобретенной окраски со стандартной шкалой. Существует индикаторная бумага как для грубых измерений pH от 1 до 10, так и для более точного определения pH в любом из узких диапазонов.
Жесткость является одним из важнейших параметров пресной воды, от которой зависит возможность содержания и разведение в ней рыб и культивировании растений. Пресная или соленая вода из естественных водоемов содержит определенное количество ионов кальция(Ca2+), который представляет собой один из самых необходимых элементов для водных ракообразных и моллюсков, использующих его для построения панциря или раковины, а также для рыб, у которых он входит в состав костей. Вода содержит также ионы магния(Mg2+). Содержащиеся в воде ионы Ca2+ и Mg2+ обусловливают жесткость воды. Вместе они показывают общую жесткость воды. В зависимости от жесткости вода подразделяется на очень мягкую до 1,5 мг-экв/л (согласно принятой у нас системе стандартизации жесткость воды выражают в ммоль-эквивалентах ионов кальция или магния, содержащихся в 1 л воды. 1 моль-экв соответствует содержанию в воде 20,04 мг Ca2+ или 12,16 мг Mg 2+.) на мягкую 1,5-4 на средне жесткую 4-8 на жесткую 8-12 и на очень жесткую свыше 12. Жесткость водопроводов не должна превышать 7. Чтобы содержать и разводить аквариумных рыб, нужно поддерживать определенную жесткость воды. В аквариуме, где содержатся рыбы и моллюски, жесткость воды постепенно снижается: кальций расходуется на построение раковин моллюсков, он усваивается рыбами и растениями. В пустом аквариуме жесткость воды повышается вследствие постоянного испарения воды, а также при переходе кальция в воду из грунта. Для смягчения воды можно использовать такие растения, как роголистник и элодея. Для увеличения жесткости можно добавить в воду небольшие кусочки известняка, мела, мраморную крошку, ракушки, хлорид магния и кальция. Общая жесткость (dH — от англ. выражения «Degrees of Hardeness» — «градусы жесткости»)
Измерить уровень dH
В продаже имеются препараты, позволяющие быстро определить общую и временную жесткость(KH) воды. Для этого в бюретку наливают определенное инструкцией количество воды и капают в нее по каплям препарат, слегка покачивая бюретку после каждой капли. Количество капель, пошедшее на получение окраски воды, цвет которой указан в инструкции, соответствует градусам жесткости.
Количество значений состава воды велико и мы не будем подробно описывать все характеристики водной среды, но вы можете ознакомиться с таблицей, в которой обобщены все характеристики водной среды, подходящие для содержания многих видов аквариумных рыб.
Показатель | Значение показателя |
| Углекислота(СО2) | до 8мг/л |
| Кислотность(pH) | 6-8 |
| Общая жесткость(dH) | 6-12 градусов |
| Содержание хлоридов | до 2 мг Cl/л |
| Окисляемость воды(O2) | 8-12 мг 02/л |
| Содержание азота | до 0,2 мг NH4 /л |
| Сожержание железа | 0 мг Fe/л |
| Содержание кислорода(O2) | 8-10 мг/л |
| Содержание сероводорода (H2S) | 0 мг/л |
| Содержание сульфатов | до 2мг SO4/л |
| Температура | 24оC ± 2 |
| Нитраты | 0,5 мг NO3/л |
| Нитриты | 0,2 мг NO2/л |
Видео
Аквариумная рыбка, Конго королевская тетра, Phenacogrammus interruptus
как определить, повысить или снизить
Жесткость воды в аквариуме — одно из важнейших условий создания и функционирования экосистемы аквариума. Без установления нужных показателей содержание живых организмов в резервуаре невозможно. Полученные знания, а также доля терпения позволят добиться в домашних условиях нужной концентрации солей Ca и Mg и любоваться здоровыми рыбками и густой зеленью растений.

Общие определения
Грязная и мутная жидкость портит общий вид, но кристально чистая также не всегда бывает полезной. После кислотности вторым по важности параметром является уровень жесткости. Его слишком высокие или низкие значения в первую очередь отразятся на растениях.
Наибольшее значение на уровень оказывают катионы кальция и в меньшей степени магния. Марганец, железо и стронций, представленные в небольшом количестве, при измерении не учитываются.
Жесткость разделяют на 3 вида:
- Общая (gH). Состоит двух значений приведенных ниже.
- Некарбонатная. Это постоянная величина уровня растворенных в жидкости хлоридов и сульфатов магния и кальция. Не изменяется при кипячении в домашних условиях. Однако может колебаться в течение 24 часов. Этому способствует наличие растений или время суток.
- Карбонатная (kH). Концентрация двууглекислых солей (Mg и Ca). При pH больше 8.3 и кипячении они образуют хлопьевидный осадок, оседают кристалликами на стенках емкости и пленку на поверхности воды.
Фото-галерея средств для измерения жесткости воды:
kH — наиболее важна для аквариумистов, это связано сразу с несколькими аспектами:
- Уровень углекислого газа, который образуется при дыхании рыбок. При высокой kH значение СО2 может достичь критической отметки свыше 30 мг/л, что приведет к гибели обитателей. Однако малая концентрация ниже 15 мг/л не позволит нормально развиваться растениям.
- Стабилизация pH. Между двумя значениями прямая зависимость.
- Вода для нереста некоторых видов рыб. Это жидкость с низкой kH и кислотностью в пределах 5.0-7.0.
Нормальные и критические показатели жесткости
От жесткости воды в аквариуме зависит срок жизни обитателей. Соли щелочноземельных металлов магния и кальция, например, влияют на уровень роста, формирование костей рыбьего скелета и ракушек у моллюсков. Также выступают в качестве минерального удобрения для развития растений. В слишком мягкой среде скручиваются листья и отмирают побеги.
За единицу измерения жесткости часто принимают содержание миллиграмм-эквивалентов ионов кальция и магния в литре воды (мг-экв/л). В аквариумистике для удобства используются немецкие и российские градусы (1 °= 0,36 мг-экв/л).
Степень | Значение | |
| Градусы | мг-экв/л | |
| Мягкая | 0-8 | 0,36- 2.88 |
| Средняя | 9-12 | 3.24-4.32 |
| Довольно жесткая | 13-18 | 4.68-6.48 |
| Жесткая | 19-30 | 6.84-10.8 |
Нормальная kH находится в интервале 4-8 °. В старых аквариумах показатель со временем опускается ниже этой отметки из-за окисления воды.
Для одних видов нужна мягкая среда, а другие, наоборот, предпочитают повышенные градусы. Это необходимо принимать во внимание в нескольких случаях:
- При первоначальном формировании аквариума: для улиток предпочтительнее более жесткая, для неоновых рыбок 6-8 °, для гуппи 5-10 °, скалярий 18 °, для папоротников 10-14 °.
- При полной замене жидкости и пересадке в нее рыбок.
- Подготовка воды для нереста. Некоторые виды размножаются в любых условиях, для других необходимо предварительно приготовить жидкость.
Для большей части аквариумных рыбок нормой будут значения от 3-15°. Показатель ниже трех говорит о недостатке жесткости.
Мистер Хвост рекомендует: методы определения жесткости
Чтобы узнать значение водопроводной воды, пользуются несколькими способами.
При помощи TDS-метра
Компактный прибор, измеряющий концентрацию солей. Для проверки опустить устройство в жидкость и подождать, результат будет показан в миллиграммах на литр. Срок службы 1-2 года. Однако измерение можно считать относительным, так как, помимо кальция и магния, итоговое число будет содержать и незначительное количество примесей других веществ.
Полоски с нанесенными на них реагентами
Их можно приобрести в магазине. Для определения жесткости нужно опустить лакмусовую бумажку в воду и дождаться изменения цвета. После соотнести полученный результат с предложенной в инструкции таблицей. Способ простой и доступный и может быть выполнен прямо в аквариуме. Но единицы измерения придется переводить из зарубежных в российские градусы.
Капельные тесты
Продаются в зоомагазинах. Для проверки: набрать 5 мл воды и добавить химический реактив из пузырька. Далее цвет жидкости изменится от красного до зеленого. После прохождения реакции количество капель реагента будет равно немецким градусам.
Химический реагент Трилон “Б”
Этот метод считается самым точным, минусами являются сложность и длительность проведения опыта. В воду, взятую из аквариума, добавляют буферную смесь, химический реагент и специальный индикатор. При прохождении реакции цвет раствора меняется от вишневого до сине-зеленого.
С помощью хозяйственного мыла
Считается самым доступным способом. Необходимы: 1 гр. измельченного мыла (60 или 72 %) и нагретая дистиллированная вода. Из них делается раствор и добавляется в банку, куда налито 0.5 л водопроводной воды. После появления шапки из пены — сигнала, что соли в жидкости связаны, — остаток мыльного раствора измеряется линейкой. Это значение отнимается от первоначального количества. Каждый сантиметр, полученный при вычитании, равен 2 градусам жесткости. Результат узнают из таблицы.
Иногда случается так, что раствор полностью вылит в банку, а образования пены не произошло, в этом случае принято считать, что жесткость выше 12°. жидкость нужно разбавить дистиллированной водой в 2 раза и повторить все действия, получившуюся в результате цифру умножить на два. Погрешность способа составляет 1-2 °.
Среднее значение воды из крана равно 20 °, это высший допустимый предел для многих видов рыб.
Как повысить жесткость воды в аквариуме
Если проведенные тесты выявили значения, не соответствующие требуемым, можно отрегулировать жесткость до нужного показателя. Однако не должно быть резкой смены значений, это может стать причиной стресса у рыб.
Если нужно повысить уровень жесткости, применяются следующие способы:
- Добавить нижний слой кипяченной жидкости богатый солями.
- Смешать воду с более жесткой.
- Засыпать коралловую или доломитовую крошку в аквариумный фильтр.
- Положить на дно мрамор, известняк, содержащие карбонат кальция или цветное стекло. Можно растворить кусочки мела, увеличив уровень на 2-4 °. Недостаток способа — сложность контроля над жесткостью. Лучше пропускать жидкость через фильтр с добавлением мраморной крошки.
- Декорировать дно аквариума раковинами.
- Внести карбонат кальция 2 ч. л. на 50 л.
- Использовать растворенную соду, 1 ч. л. на 50 л, или 0.2-5 г на литр. Этот способ подходит для воды с показателем не менее 8 °.
- Добавить 10 % раствор хлористого кальция и сульфат магния: развести 50 г, получив объем 750 мл. Использовать каждый по 1 мг на литр.
- Влить 1 мл 25 % магнезии на 1 л воды.
Практически все перечисленные способы изменяют показатель жесткости на 4 °.
Как снизить жесткость воды в аквариуме
Когда уровень жесткости высокий, он нуждается в понижении. Это сделать несколько сложнее, для смягчения помогут следующие действия:
- Добавить дистиллированной жидкости. После смешения нужно дополнительное обогащение аквариума кислородом и реминерализирующими солями.
- Влить талой или дождевой воды, которые снижают число градусов жесткости. Однако нужна осторожность из-за возможного наличия вредных примесей. Для обеззараживания среды следует добавлять специальный кондиционер.
- Довести воду до кипячения, остудить, отстоять в течение 24 часов. Влить в резервуар только верхнюю часть.
- Для уменьшения жесткости использовать торф, всыпав его в фильтр, предварительно обеззаразив кипячением или прокаливанием. Жидкость отстаивают и вне аквариума, поместив в нее торфяную таблетку в мешочке на 4-5 дней.
- Вымораживать в мелкой емкости. После замерзания растопить лед и добавить в аквариум.
- Еще один способ понижения — фильтрация, например, через обратный осмос.
- Высадить такие растения, как эгропила, роголистник, наяс или элодея.
Выбирая растения, улиток, ракообразных или рыбок для своего аквариума новичок и даже любитель не должны забывать о параметрах жесткости. И суметь измерить и скорректировать, в домашних условиях, показатели водопроводной воды.
Жесткость воды
Жесткость воды
Жесткость воды – содержание в ней растворенных солей кальция и магния.
Суммарное содержание этих солей называют общей жесткостью.
Гидрокарбонаты магния и калия образуют карбонатную (временную) жесткость, которая полностью устраняется при длительном кипячении воды, но переходит в нерастворимый осадок с выделением углекислого газа.
Остающаяся после кипячения жесткость называется постоянной.
Результаты определения жесткости воды выражают в мг-экв/л. Временная или карбонатная жесткость может доходить до 70-80% общей жесткости воды.
• известковые отложения на нагревательных элементах уменьшает их теплопроводность и выводит оборудование из строя.
• уменьшает площадь рабочего сечения труб, что ведёт к повышению гидравлического сопротивления.
• образует белые отложения на поверхности сантехники.
•увеличивает сумму счетов за электроэнергию, так как слой накипи толщиной 1 мм повышает расход электроэнергии на 10%!
• увеличивает изнашиваемость всех клапанов, терморегуляторов, изоляционного слоя, фильтров и т.д. Из-за накипи датчики и измерительные приборы могут давать неверные показания.
• содержит высокую концентрацию минералов, которые не смываются, покрывая кожу и волосы невидимой пленкой, создающей чувство дискомфорта (сушит кожу рук, делает волосы тусклыми и слабыми).• увеличивается расход моющих средств, а желаемого результата нет.
• снижает эффективность стирки белья. Мыло остается на поверхности, а грязь внутри волокон ткани. Требуется больше стирального порошка, чтобы удалить трудно выводимые загрязнения. После стирки в жесткой воде одежда тоже становится жесткой на ощупь, а качество стирки неудовлетворительно.•употребление жесткой воды в качестве питья сказывается не в лучшую сторону на нашем здоровье.
Таблица пересчета градусов жёсткости
| Градус | Обозначение | Определение | Величина мг-экв/л |
| Немецкий | °dH (degrees of hardness),°dGH German (Deutsche) Hardness)°dKH (для карбонатной жёсткости) | 1 часть оксида кальция (СаО) или 0.719 частей оксида магния (MgO) на 100 000 частей воды |
0,36 |
| Английский | °e | 1 гран CaCO3 на 1 английский галлон воды | 0,28 |
| Французский | °TH | 1 часть CaCO3 на 100000 частей воды | 0,2 |
| Американский | ppm | 1 часть CaCO3 на 1 000 000 частей воды | 0,02 |
Классификаций воды по степени ее жесткости
| Жёсткость воды, мг-экв/л |
Жёсткость воды в пересчёте на немецкий градус жёсткости, °dH |
в России | в Германии |
| 0-1,6 | 0-4,5 | Мягкая | Мягкая |
| 1,6-2,4 | 4,5-6,7 | Средней жесткости | |
| 2,4-3,0 | 6,7-8,4 | Достаточно жесткая | |
| 3,0-3,6 | 8,4-10,0 | ||
| 3,6-4,0 | 10,0-11,2 | Жесткая | |
| 4,0-6,0 | 11,2-16,8 | Средней жесткости | |
| 6,0-8,0 | 16,8-22,4 | Очень жесткая | |
| 8,0-9,0 | 22,4-25,2 | Жесткая | |
| 9,0-12,0 | 25,2-33,6 | ||
| св. 12,0 | св.33,6 | Очень жесткая | |
| Источники: | Справочник «Гидрохимические показатели состояния окружающей среды», Эколайн, 2000 Нормы жесткости немецкого института стандартизации (DIN 19643) |
||
Жёсткость воды — это… Что такое Жёсткость воды?
Жёсткость воды — совокупность химических и физических свойств воды, связанных с содержанием в ней растворённых солей щёлочноземельных металлов, главным образом, кальция и магния (так называемых «солей жёсткости»).
Жёсткая и мягкая вода
Вода с большим содержанием таких солей называется жёсткой, с малым содержанием — мягкой. Различают временную (карбонатную) жёсткость, обусловленную гидрокарбонатами кальция и магния (Са(НСО3)2; Mg(НСО3)2), и постоянную (некарбонатную) жёсткость, вызванную присутствием других солей, не выделяющихся при кипячении воды: в основном, сульфатов и хлоридов Са и Mg (CaSO4, CaCl2, MgSO4, MgCl2).
Жёсткая вода при умывании сушит кожу, в ней плохо образуется пена при использовании мыла. Использование жёсткой воды вызывает появление осадка (накипи) на стенках котлов, в трубах и т. п. В то же время, использование слишком мягкой воды может приводить к коррозии труб, так как, в этом случае отсутствует кислотно-щелочная буферность, которую обеспечивает гидрокарбонатная (временная) жёсткость. Потребление жёсткой или мягкой воды обычно не является опасным для здоровья,есть данные о том, что высокая жёсткость способствует образованию мочевых камней, а низкая — незначительно увеличивает риск сердечно-сосудистых заболеваний. Вкус природной питьевой воды, например, воды родников, обусловлен именно присутствием солей жёсткости.
Жёсткость природных вод может варьироваться в довольно широких пределах и в течение года непостоянна. Увеличивается жёсткость из-за испарения воды, уменьшается в сезон дождей, а также в период таяния снега и льда.
Единицы измерения
Для численного выражения жёсткости воды указывают концентрацию в ней катионов кальция и магния. Рекомендованная единица СИ для измерения концентрации — моль на кубический метр (моль/м³), однако, на практике для измерения жёсткости используются градусы жёсткости и миллиграммы эквивалента на литр (мг-экв/л).
В СССР до 1952 года использовали градусы жёсткости, совпадавшие с немецкими. В России для измерения жёсткости иногда использовалась нормальная концентрация ионов кальция и магния, выраженная в миллиграммах эквивалента на литр (мг-экв/л). Один мг-экв/л соответствует содержанию в литре воды 20,04 миллиграмм Ca2+ или 12,16 миллиграмм Mg2+ (атомная масса делённая на валентность).
С 1 января 2005 года в России введен новый Национальный стандарт Российской Федерации ГОСТ Р 52029-2003 «Вода. Единица жесткости»[1]. По новому ГОСТу жесткость выражается в градусах жесткости (°Ж). 1 °Ж соответствует концентрации щелочноземельного элемента, численно равной 1/2 его моля на литр (1 °Ж = 1 мг-экв/л).
Иногда указывают концентрацию, отнесённую к единице массы, а не объёма, особенно, если температура воды может изменяться или если вода может содержать пар, что приводит к существенным изменениям плотности.
В разных странах использовались (иногда используются до сих пор) различные внесистемные единицы — градусы жёсткости.
| Градус | Обозначение | Определение | Величина | |
|---|---|---|---|---|
| °Ж | ммоль/л | |||
| Немецкий | °dH (degrees of hardness), °dGH (German (Deutsche) Hardness), °dKH (для карбонатной жёсткости) | 1 часть оксида кальция (СаО) или 0.719 частей оксида магния (MgO) на 100 000 частей воды | 0,3566 | 0,1783 |
| Английский | °e | 1 гран CaCO3 на 1 английский галлон воды | 0,2848 | 0.1424 |
| Французский | °TH | 1 часть CaCO3 на 100000 частей воды | 0,1998 | 0,0999 |
| Американский | ppm | 1 часть CaCO3 на 1 000 000 частей воды | 0,0200 | 0,0100 |
По величине общей жёсткости различают воду мягкую (до 2 °Ж), средней жёсткости (2-10 °Ж) и жёсткую (более 10 °Ж).
Жёсткость воды поверхностных источников существенно колеблется в течение года; она максимальна в конце зимы, минимальна — в период паводка (например, жёсткость волжской воды в марте — 4,3 °Ж, в мае — 0,5 °Ж [2]). В подземных водах жёсткость обычно выше (до 80-100 °Ж) и меньше изменяется в течение года.
Методы устранения
Термоумягчение. Основан на кипячении воды, в результате термически нестойкие гидрокарбонаты кальция и магния разлагаются с образованием накипи:
- Ca(HCO3)2 → CaCO3↓ + CO2 + H2O.
Кипячение устраняет только временную (карбонатную) жёсткость. Находит применение в быту.
Реагентное умягчение. Метод основан на добавлении в воду кальцинированной соды Na2CO3 или гашёной извести Ca(OH)2. При этом соли кальция и магния переходят в нерастворимые соединения и, как следствие, выпадают в осадок. Например, добавление гашёной извести приводит к переводу солей кальция в нерастворимый карбонат:
- Ca(HCO3)2 + Ca(OH)2 → 2CaCO3↓ + 2H2O
Лучшим реагентом для устранения общей жесткости воды является ортофосфат натрия Na3PO4, входящий в состав большинства препаратов бытового и промышленного назначения:
- 3Ca(HCO3)2 + 2Na3PO4 → Ca3(PO4)2↓ + 6NaHCO3
- 3MgSO4 + 2Na3PO4 → Mg3(PO4)2↓ + 3Na2SO4
Ортофосфаты кальция и магния очень плохо растворимы в воде, поэтому легко отделяются механическим фильтрованием. Этот метод оправдан при относительно больших расходах воды, поскольку связан с решением ряда специфических проблем: фильтрации осадка, точной дозировки реагента.
Катионирование. Метод основан на использовании ионообменной гранулированной загрузки (чаще всего ионообменные смолы). Такая загрузка при контакте с водой поглощает катионы солей жёсткости (кальций и магний, железо и марганец). Взамен, в зависимости от ионной формы, отдавая ионы натрия или водорода. Эти методы соответственно называются Na-катионирование и Н-катионирование. При правильно подобранной ионообменной загрузке жёсткость воды снижается при одноступенчатом натрий-катионировании до 0,05-0,1 °Ж, при двухступенчатом — до 0,01 °Ж. В промышленности с помощью ионообменных фильтров заменяют ионы кальция и магния на ионы натрия и калия, получая мягкую воду.
Обратный осмос. Метод основан на прохождении воды через полупроницаемые мембраны (как правило, полиамидные). Вместе с солями жёсткости удаляется и большинство других солей. Эффективность очистки может достигать 99,9 %. Этот метод нашёл наибольшее применение в бытовых системах подготовки питьевой воды. В качестве недостатка данного метода следует отметить необходимость предварительной подготовки воды, подаваемой на обратноосмотическую мембрану.
Электродиализ. Основан на удалении из воды солей под действием электрического поля. Удаление ионов растворенных веществ происходит за счёт специальных мембран. Так же как и при использовании технологии обратного осмоса, происходит удаление и других солей, помимо ионов жёсткости.
Полностью очистить воду от солей жёсткости можно дистилляцией.
См. также
- Кислые соли
- Щелочи
- Сульфаты
- Хлораты
Ссылки
Примечания
Показатель pH воды, жёсткость воды аквариума
Вода из любого источника, будь то озеро или река, это своеобразный природный бульон, в котором намешано/растворено огромное количество элементов (различные соли, минералы, газы). Из уроков химии вспоминаем, что растворённое вещество не присутствует в воде в чистом виде. Например, если в воде размешать обычную поваренную соль — хлорид натрия (NaCl), то она диссоциирует, т. е. распадётся на ионы: катион Na+ и анион Cl-.
Диссоциация хлорида натрия (NaCl)
 Поваренная соль распадётся на ионы: катион Na+ и анион Cl-
Поваренная соль распадётся на ионы: катион Na+ и анион Cl-Подобным образом происходит с большинством веществ, именно количество этих положительно и отрицательно заряженных частиц определяют гидрохимический состав воды, напрямую влияющий на самочувствие ваших аквариумных питомцев.
Аквариумисту важно знать минимум о двух важных взаимосвязанных параметрах воды: жёсткость и водородный показатель (показатель pH). Они в обязательном порядке указываются в условиях содержания того или иного вида рыб.
Жёсткость воды
 Жёсткость воды определяется количеством растворённых в ней минеральных солей кальция (катионов Са+) и магния (катионов Mg+). Если их растворено много, значит вода жёсткая, если мало — мягкая. Исторически сложилось, что в России жёсткость обозначают в немецких градусах dGH. В других странах используют свои обозначения, например, американские градусы (usH), единица жёсткости определяется в ppm (part per million — одна часть на миллион). Именно в ppm меряют большинство продаваемых у нас электронных измерителей жёсткости воды.
Жёсткость воды определяется количеством растворённых в ней минеральных солей кальция (катионов Са+) и магния (катионов Mg+). Если их растворено много, значит вода жёсткая, если мало — мягкая. Исторически сложилось, что в России жёсткость обозначают в немецких градусах dGH. В других странах используют свои обозначения, например, американские градусы (usH), единица жёсткости определяется в ppm (part per million — одна часть на миллион). Именно в ppm меряют большинство продаваемых у нас электронных измерителей жёсткости воды.
По уровню жёсткости воду определяют следующим образом:
- от 0 до 4 dGH — очень мягкая,
- от 5 до 10 dGH — мягкая,
- от 10 до 20 dGH — средней жесткости,
- от 20 до 30 dGH — жёсткая
- свыше 30 dGH — очень жесткая.
Оптимальный диапазон для большинства видов рыб располагается между 0.2 и 20 градусами dGH.
Не стоит путать Жёсткость с Минерализацией, в последнем случае в воде бывает растворено множество других солей, порой вовсе не содержащих кальций и магний. Так, растворив в воде всё ту же поваренную соль, мы увеличим её минерализацию, но при этом жёсткость останется на прежнем уровне.
Выделяют постоянную и временную (карбонатную) жёсткость, последняя удаляется простым кипячением, поэтому и временная. Сложение обоих даёт общую жёсткость dGH.
временная + постоянная = общая жёсткость
Постоянная жёсткость обусловлена растворением хлоридов, сульфатов и других солей, в результате вода насыщается ионами Mg+ и Ca+ и их напарниками SO4 и Cl. В быту постоянная жёсткость себя никак не проявляет в отличие от временной.
Постоянная жёсткость воды
 Содержание ионов Mg+,Ca+, SO4-, Cl- в воде с постоянной жёсткостью
Содержание ионов Mg+,Ca+, SO4-, Cl- в воде с постоянной жёсткостьюВременная жёсткость помимо знакомых ионов (Mg+,Ca+, SO4- , Cl-) имеет дополнительно гидрокарбонатные анионы — HCO3, которые при нагреве выпадают в осадок, известный как накипь, остающаяся на стенках чайников и прочей посуды при кипячении.
Временная или карбонатная жёсткость воды
 Содержание в воде с временной жёсткостью дополнительных гидрокарбонатов HCO3
Содержание в воде с временной жёсткостью дополнительных гидрокарбонатов HCO3Как определить и изменить жёсткость воды
Водородный показатель (показатель pH)
 Водородный показатель или показатель pH воды указывает на количество свободных ионов водорода (H+), а точнее на соотношение H+ и OH- (вместе как раз и дают знакомую формулу h3O). Вода сама по себе практически не диссоциирует на H+ и OH-, но поскольку в ней присутствует большое количество примесей, некоторые из них дают химическую реакцию, смещая водородный показатель в ту или иную сторону. Если ионов водорода в воде много, она кислая, если мало — щелочная.
Водородный показатель или показатель pH воды указывает на количество свободных ионов водорода (H+), а точнее на соотношение H+ и OH- (вместе как раз и дают знакомую формулу h3O). Вода сама по себе практически не диссоциирует на H+ и OH-, но поскольку в ней присутствует большое количество примесей, некоторые из них дают химическую реакцию, смещая водородный показатель в ту или иную сторону. Если ионов водорода в воде много, она кислая, если мало — щелочная.
Ионный состав нейтрального значения pH
 Количество ионов водорода (H+) равно ионам гидроксида (OH−)
Количество ионов водорода (H+) равно ионам гидроксида (OH−)Ионный состав кислого значения pH
 Количество ионов водорода (H+) больше ионов гидроксида (OH−)
Количество ионов водорода (H+) больше ионов гидроксида (OH−)Ионный состав щелочного значения pH
.svg) Количество ионов водорода (H+) меньше ионов гидроксида (OH−)
Количество ионов водорода (H+) меньше ионов гидроксида (OH−)Показатель pH измеряется по шкале от 0 (очень кислая вода) до 14 (очень щелочная вода). В отличие от жёсткости воды обозначение водородного показателя одинакового во всех странах, поэтому путаницы не происходит. Рыбы могут жить в пределах от 5 до 9 pH. Середина шкалы под номером 7 (pH7) означает нейтральную воду — наиболее предпочтительная для большинства видов аквариумных рыб и растений.
Воду разделяют на следующие типы:
- pH <5 — сильно кислая,
- pH 5–6 — кислая,
- pH 6–6,8 слабо кислая,
- pH 6,8–7,2 — нейтральная,
- pH 7,2–8,0 слабо щелочная,
- pH 8,0–9,0 — щелочная,
- pH>9 — сильно щелочная.
В аквариуме показатель pH очень не стабилен, особенно в мягкой воде, и может изменяться в течение дня в ту или иную сторону, обычно колеблется в пределах 6,5–8,5. Наибольшее влияние на него оказывает углекислый газ, производимый рыбами и растениями (в ночное время), и различные органические отходы (экскременты, не съеденные остатки пищи), которые активно участвуют в окислении воды.
Существует взаимосвязь между жёсткостью воды и уровнем pH. Жёсткая вода, насыщенная минеральными веществами, как правило, щелочная, а мягкая вода — кислая. Растворённые минеральные вещества действуют как буфер, препятствуют окислению, поэтому в жёсткой воде показатель pH уравновешивается и не опускается ниже 7.0
Как определить и изменить водородный показатель pH