ГОСТ 6055-86 Вода. Единица жесткости, ГОСТ от 20 марта 1986 года №6055-86
ГОСТ 6055-86
Группа Н09
ВОДА
Единица жесткости
Water. Unit of hardness
ОКСТУ 9109
Срок действия с 01.01.88
до 01.01.98*
____________
Ограничение срока действия снято по протоколу № 7-95
Межгосударственного Совета по стандартизации,
метрологии и сертификации
(ИУС № 11 1995 г.).
Примечание «КОДЕКС»
УТВЕРЖДЕН И ВВЕДЕН В ДЕЙСТВИЕ постановлением Государственного комитета СССР по стандартам от 20 марта 1986 г. № 584
ВЗАМЕН ГОСТ 6055-51
ПЕРЕИЗДАНИЕ. Октябрь 1994 г.
1. Настоящий стандарт устанавливает единицу жесткости воды.
2. Жесткостью воды называется свойство воды, обусловленное содержанием в ней ионов кальция (1/2 Са) и магния (1/2 Мg).
3. Единицей жесткости воды является моль на кубический метр (моль/м).
Примечания:
1. Числовое значение жесткости, выраженное в молях на кубический метр (моль/м), равно числовому значению жесткости, выраженному в миллиграмм-эквивалентах на литр (мг-экв/л).
2. Один моль на кубический метр соответствует массовой концентрации эквивалентов ионов кальция (1/2 Са) 20,04 г/м и ионов магния (1/2 Мg) 12,153 г/м.
4. Виды жесткости воды и соответствующие им пояснения приведены в приложении 1.
5. Термины, применяемые и настоящем стандарте, и их пояснения приведены в приложении 2.
6. Соотношение единиц жесткости воды, принятых в других странах, и моль на кубический метр приведено в приложении 3.
ПРИЛОЖЕНИЕ 1 (обязательное). ВИДЫ ЖЕСТКОСТИ ВОДЫ
ПРИЛОЖЕНИЕ 1
Обязательное
Термин | Пояснения |
Общая жесткость воды | Сумма молярных концентраций эквивалентов ионов кальция (1/2 Са) и магния (1/2 Мg) в воде. |
Карбонатная жесткость воды | Сумма молярных концентраций эквивалентов карбонатных (СО) и гидрокарбонатных (НСО) ионов в воде. |
Некарбонатная жесткость воды | Разность между общей и карбонатной жесткостью воды. |
Устранимая жесткость воды | Жесткость воды, обусловленная наличием в воде карбонатных (СО) и гидрокарбонатных (НСО) ионов солей кальция и магния, удаляемая при кипячении и определяемая экспериментально. |
Неустранимая жесткость воды | Разность между общей и устранимой жесткостью воды. |
ПРИЛОЖЕНИЕ 2 (справочное). ТЕРМИНЫ, ПРИМЕНЯЕМЫЕ В НАСТОЯЩЕМ СТАНДАРТЕ, И ИХ ПОЯСНЕНИЯ
ПРИЛОЖЕНИЕ 2
Справочное
Термин | Пояснения |
1. Эквивалент | Реальная или условная частица вещества, которая в данной кислотно-основной реакции эквивалентна одному иону водорода или в данной окислительно-восстановительной реакции одному электрону. |
2. Молярная концентрация эквивалента | Отношение количества вещества эквивалента в системе (например, в растворе) к объему этой системы. |
ПРИЛОЖЕНИЕ 3 (справочное). СООТНОШЕНИЕ ЕДИНИЦ ЖЕСТКОСТИ ВОДЫ, ПРИНЯТЫХ В ДРУГИХ СТРАНАХ, С ЕДИНИЦЕЙ МОЛЬ НА КУБИЧЕСКИЙ МЕТР
ПРИЛОЖЕНИЕ 3
Справочное
Единицы жесткости воды | |||
моль/м | Немецкий | Французский | Американский градус |
1,000 | 2,804 | 5,005 | |
Примечания:
1. Один немецкий градус соответствует 10 мг/л СаО в воде.
2. Один французский градус соответствует 10 мг/л СаСО в воде.
3. Один американский градус соответствует 1 мг/л СаСО в воде.
Текст документа сверен по:
официальное издание
М.: Издательство стандартов, 1995
Умягчение воды
«Жесткая» вода — одна из самых распространенных проблем, причем как в загородных домах с автономным водоснабжением, так и в городских квартирах с централизованным водопроводом. Степень жесткости зависит от наличия в воде солей кальция и магния (соли жесткости) и измеряется в миллиграмм — эквиваленте на литр (мг-экв/л). По американской классификации (для питьевой воды) при содержании солей жесткости менее 2 мг-экв/л вода считается «мягкой», от 2 до 4 мг-экв/л — нормальной (повторяем, для пищевых целей!), от 4 до 6 мг-экв/л — жесткой, а свыше 6 мг-экв/л — очень жесткой.
Для многих применений жесткость воды не играет существенной роли (например, для тушения пожаров, полива огорода, уборки улиц и тротуаров). Но в ряде случаев жесткость может создать проблемы. При принятии ванны, мытье посуды, стирке, мытье машины жесткая вода гораздо менее эффективна, чем мягкая. И вот почему:
При использовании мягкой воды расходуется в 2 раза меньше моющих средств;
Жесткая вода, взаимодействуя с мылом, образует «мыльные шлаки», которые не смываются водой и оставляют малосимпатичные разводы на посуде и поверхности сантехники; «Мыльные шлаки» также не смываются с поверхности человеческой кожи, забивая поры и покрывая каждый волос на теле, что может стать причиной появления сыпи, раздражения, зуда;
При нагревании воды, содержащиеся в ней соли жесткости кристаллизуются, выпадая в виде накипи. Накипь является причиной 90% отказов водонагревательного оборудования. Поэтому к воде, подвергаемой нагреву в котлах, бойлерах и т.п., предъявляются на порядок более строгие требования по жесткости;
Во многих промышленных процессах соли жесткости могут вступить в химическую реакцию, образовав нежелательные промежуточные продукты.
Понятие жесткости
Жесткость воды принято связывать с катионами кальция (Са2+) и в меньшей степени магния (Mg2+). В действительности, все двухвалентные катионы в той или иной степени влияют на жесткость. Они взаимодействуют с анионами, образуя соединения (соли жесткости) способные выпадать в осадок. Одновалентные катионы (например, натрий Na+) таким свойством не обладают.
В данной таблице приведены основные катионы металлов, вызывающие жесткость, и главные анионы, с которыми они ассоциируются
Катионы | Анионы |
Кальций (Ca2+) | Гидрокарбонат (HCO3-) |
Магний (Mg2+) | Сульфат (SO42-) |
Стронций (Sr2+) | Хлорид (Cl-) |
Железо (Fe2+) | Нитрат (NO3-) |
Марганец (Mn2+) | Силикат (SiO32-) |
На практике стронций, железо и марганец оказывают на жесткость столь небольшое влияние, что ими, как правило, пренебрегают. Алюминий (Al3+) и трехвалентное железо (Fe3+) также влияют на жесткость, но при уровнях рН, встречающихся в природных водах, их растворимость и, соответственно, «вклад» в жесткость ничтожно малы. Аналогично, не учитывается и незначительное влияние бария (Ва2+).
Виды жесткости
Общая жесткость. Определяется суммарной концентрацией ионов кальция и магния. Представляет собой сумму карбонатной (временной) и некарбонатной (постоянной) жесткости.
Карбонатная жесткость. Обусловлена наличием в воде гидрокарбонатов и карбонатов (при рН>8.3) кальция и магния. Данный тип жесткости почти полностью устраняется при кипячении воды и поэтому называется временной жесткостью. При нагреве воды гидрокарбонаты распадаются с образованием угольной кислоты и выпадением в осадок карбоната кальция и гидроксида магния.
Некарбонатная жесткость. Обусловлена присутствием кальциевых и магниевых солей сильных кислот (серной, азотной, соляной) и при кипячении не устраняется (постоянная жесткость).
Единицы измерения
В мировой практике используется несколько единиц измерения жесткости, все они определенным образом соотносятся друг с другом. В России Госстандартом в качестве единицы жесткости воды установлен моль на кубический метр (моль/м3).
Один моль на кубический метр соответствует массовой концентрации эквивалентов ионов кальция (1/2 Ca2+) 20.04 г/м3 и ионов магния (1/2Mg2+) 12.153 г/м3. Числовое значение жесткости, выраженное в молях на кубический метр равно числовому значению жесткости, выраженному в миллиграмм-эквивалентах на литр (или кубический дециметр), т.е. 1моль/м3=1ммоль/л=1мг-экв/л=1мг-экв/дм3.
Кроме этого в зарубежных странах широко используются такие единицы жесткости, как немецкий градус (do, dH), французский градус (fo), американский градус, ppm CaCO3.
Соотношение этих единиц жесткости представлено в следующей таблице:
Единицы жесткости воды | ||||
Моль/м3(мг-экв/л) | Немецкий градус, do | Французский градус, fo | Американский градус | ppm мг/дм3 СаСО3 |
1.000 | 2.804 | 5.005 | 50.050 | 50.050 |
Примечание: Один немецкий градус соответствует 10 мг/дм3 СаО или 17.86 мг/дм3 СаСО3 в воде. Один французский градус соответствует 10 мг/дм3 СаСО3 в воде. Один американский градус соответствует 1 мг/дм3 СаСО3 в воде.
Происхождение жесткости
Ионы кальция (Ca2+) и магния (Mg2+), а также других щелочноземельных металлов, обуславливающих жесткость, присутствуют во всех минерализованных водах. Их источником являются природные залежи известняков, гипса и доломитов. Ионы кальция и магния поступают в воду в результате взаимодействия растворенного диоксида углерода с минералами и при других процессах растворения и химического выветривания горных пород. Источником этих ионов могут служить также микробиологические процессы, протекающие в почвах на площади водосбора, в донных отложениях, а также сточные воды различных предприятий.
Жесткость воды колеблется в широких пределах и существует множество типов классификаций воды по степени ее жесткости.
Обычно в маломинерализованных водах преобладает (до 70%-80%) жесткость, обусловленная ионами кальция (хотя в отдельных редких случаях магниевая жесткость может достигать 50—60%). С увеличением степени минерализации воды содержание ионов кальция (Са2+) быстро падает и редко превышает 1 г/л. Содержание же ионов магния (Mg2+) в высокоминерализованных водах может достигать нескольких граммов, а в соленых озерах — десятков граммов на один литр воды
В целом, жесткость поверхностных вод, как правило, меньше жесткости вод подземных. Жесткость поверхностных вод подвержена заметным сезонным колебаниям, достигая обычно наибольшего значения в конце зимы и наименьшего в период половодья, когда обильно разбавляется мягкой дождевой и талой водой. Морская и океанская вода имеют очень высокую жесткость (десятки и сотни мг-экв/дм3)
Влияние жесткости
С точки зрения применения воды для питьевых нужд, ее приемлемость по степени жесткости может существенно варьироваться в зависимости от местных условий. Порог вкуса для иона кальция лежит (в пересчете на мг-эквивалент) в диапазоне 2—6 мг-экв/л, в зависимости от соответствующего аниона, а порог вкуса для магния и того ниже. В некоторых случаях для потребителей приемлема вода с жесткостью выше 10 мг-экв/л. Высокая жесткость ухудшает органолептические свойства воды, придавая ей горьковатый вкус и оказывая отрицательное действие на органы пищеварения
Всемирная Организация Здравоохранения не предлагает какой-либо рекомендуемой величины жесткости по показаниям влияния на здоровье. В материалах ВОЗ говорится о том, что хотя ряд исследований и выявил статистически обратную зависимость между жесткостью питьевой воды и сердечно-сосудистыми заболеваниями, имеющиеся данные не достаточны для вывода о причинном характере этой связи. Аналогичным образом, однозначно не доказано, что мягкая вода оказывает отрицательный эффект на баланс минеральных веществ в организме человека
В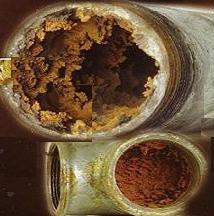 месте
с тем, в зависимости от рН и щелочности,
вода с жесткостью выше 4 мг-экв/л
может вызвать в распределительной
системе отложение шлаков и накипи
(карбоната кальция), особенно при
нагревании. Именно поэтому нормами
Котлонадзора вводятся очень жесткие
требования к величине жесткости
воды, используемой для питания котлов
(0.05—0.1 мг-экв/л).
месте
с тем, в зависимости от рН и щелочности,
вода с жесткостью выше 4 мг-экв/л
может вызвать в распределительной
системе отложение шлаков и накипи
(карбоната кальция), особенно при
нагревании. Именно поэтому нормами
Котлонадзора вводятся очень жесткие
требования к величине жесткости
воды, используемой для питания котлов
(0.05—0.1 мг-экв/л).
Кроме того, при взаимодействии солей жесткости с моющими веществами (мыло, стиральные порошки, шампуни) происходит образование «мыльных шлаков» в виде пены. Это приводит не только к значительному перерасходу моющих средств. Такая пена после высыхания остается в виде налета на сантехнике, белье, человеческой коже, на волосах (неприятное чувство «жестких» волос хорошо известное многим). Главным отрицательным воздействием этих шлаков на человека является то, что они разрушают естественную жировую пленку, которой всегда покрыта нормальная кожа и забивают ее поры. Признаком такого негативного воздействия является характерный «скрип» чисто вымытой кожи или волос. Оказывается, что вызывающее у некоторых раздражение чувство «мылкости» после пользования мягкой водой является признаком того, что защитная жировая пленка на коже цела и невредима. Именно она и скользит. В противном случае, приходится тратиться на лосьоны, умягчающие и увлажняющие кремы и прочие хитрости для восстановления той защиты кожи, которой нас и так снабдила матушка Природа.
Вместе с тем, необходимо упомянуть и о другой стороне медали. Мягкая вода с жесткостью менее 2 мг-экв/л имеет низкую буферную емкость (щелочность) и может, в зависимости от уровня рН и ряда других факторов, оказывать повышенное коррозионное воздействие на водопроводные трубы. Поэтому, в ряде применений (особенно в теплотехнике) иногда приходится проводить специальную обработку воды с целью достижения оптимального соотношения между жесткостью воды и ее коррозионной активностью.
Под жесткостью воды понимают свойство, обусловленное присутствием в воде растворенных солей, в основном кальция и магния. Жесткость воды подразделяется па карбонатную (присутствие в ней гидрокарбонатов магния и кальция) и некарбонатную (наличие солей сильных кислот — хлоридов или сульфатов кальция и магния). Сумма карбонатной и некарбонатной жесткости определяет общую жесткость.
Карбонатную жесткость называют временной, так как при длительном кипячении подобной воды гидрокарбонаты разлагаются с образованием осадка карбоната кальция и выделением углекислого газа:
Ca(HCO3)2 = СаСО3+СO2↑ + Н2O
Mg(НСО3)2 = Mg(ОН)2↓ + 2СO2↑
Жесткость воды, обусловленная наличием сульфатов магния и кальция, называется постоянной. Она может быть устранена лишь химическим путем:
CaSO4+Na2CO3=CaCO3↓+Na2SO4.
В настоящее время для устранения жесткости используют также ионообменные смолы.
Способы устранения жесткости воды
В природной воде растворены соли кальция и магния. Это гидрокарбонаты и сульфаты. Покажем два способа осаждения гидрокарбонатов для уменьшения жесткости воды. Первый способ – кипячение. При кипячении* растворимые гидрокарбонаты переходят в нерастворимые карбонаты, и жесткость воды уменьшается.
Сa(HCO3)2 = CaCO3 ↓ + H2O + CO2↑
Второй способ – добавление известковой воды. При добавлении известковой воды гидрокарбонаты переходят в карбонаты и вода становится более мягкой.
Сa(HCO3)2+ Ca(OH)2 = CaCO3 ↓ +2 H2O
Но жесткость воды зависит еще и от сульфатов кальция и магния. Сульфаты кальция и магния можно удалить с помощью карбоната натрия. При добавлении карбоната натрия сульфаты переходят в нерастворимые карбонаты кальция и магния.
CaSO4 + Na2CO3= CaCO3 ↓+ Na2SO4
Устранение из воды солей жесткости, т. е. умягчение её, необходимо производить для питания котельных установок, причем жесткость воды для котлов среднего и низкого давления должна быть не более 0,3 мг-экв/л. Умягчать воду требуется также для таких производств, как текстильное, бумажное, химическое, где вода должна иметь жесткость не более 0,7 -1,0 мг-экв/л. Умягчение воды для хозяйственно-питьевых целей также целесообразно, особенно в случае, если она превышает 7мг-экв/л. Применяют следующие основные методы умягчения воды:
реагентный метод — путем введения реагентов, способствующих образованию малорастворимых соединений кальция и магния и выпадению их в осадок;
катионовый метод, при котором умягчаемая вода фильтруется через вещества, обладающие способностью обменивать содержащиеся в них катионы (натрия или водорода) на катионы кальция и магния, растворенный в воде солей. А результате обмена задерживаются ионы кальция и магния и образуются натриевые соли, не придающие воде жесткость;
термический метод, заключающийся в нагревании воды до температуры выше 100°, при этом почти полностью удаляются соли карбонатной жесткости.
Часто методы умягчения применяют комбинированно. Например, часть солей жесткости удаляют реагентным способом, а оставшуюся часть с помощью катионного обмена. Из реагентных методов содово-известковый способ умягчения является наиболее распространенным. Сущность его сводится к получению вместо растворенных в воде солей Са Mg нерастворимых солей СаСО3 и Mg(OH)2, выпадающих в осадок. Оба реагента — соду Na2CO3 и известь Са(ОН)2 — вводят в умягчаемую воду одновременно или поочередно. Соли карбонатной, временной жесткости удаляют известью, не карбонатной, постоянной жесткости — содой. Химические реакции при удалении карбонатной жесткости протекают следующим образом:
Са(НСО3)2 + Са(ОН)2 = 2СаСО3 + 2Н2О
Гидрат окиси магния Mg(OH)2 коагулирует и выпадает в осадок. Для устранения некарбонатной жесткости в умягчаемую воду вводят Na2CO3. Химические реакции при удалении некарбонатной жесткости следующие:
Na2CO3 + CaSO4 = CaCO3 + Na2SO4;
Na2CO3 + СаС12 = СаСО3 + 2NaCl.
В результате реакции получается углекислый кальций, который выпадает в осадок. Реагенты, применяемые при обработке воды, вводят в воду в следующих местах:
а) хлор (при предварительном хлорировании) — во всасывающие трубопроводы насосной станции первого подъема или в водоводы, подающие воду на станцию очистки;
б) коагулянт — в трубопровод перед смесителем или в смеситель;
в) известь для подщелачивания при коагулировании — одновременно с коагулянтом;
г) активированный уголь для удаления запахов и привкусов в воде до 5 мг/л — перед фильтрами. При больших дозах уголь следует вводить на насосной станции первого подъема или одновременно с коагулянтом в смеситель водоочистной станции, но не ранее чем через 10 мин после введения хлора;
д) хлор и аммиак для обеззараживания воды вводят до очистных сооружений и в фильтрованную воду. При наличии в воде фенолов аммиак следует вводить как при предварительном, так и при окончательном хлорировании.
К специальным видам очистки и обработки воды относятся опреснение, обессоливание, обезжелезивание, удаление из воды растворенных газов и стабилизация.
Как определить жесткость воды – домашние методы и приборы
Жёсткость – одна из важнейших характеристик воды. Это свойство воде придают соли магния и кальция (Mg и Ca), которые называют солями жёсткости. Чем меньше их концентрация, тем мягче вода.
Единицы измерения. Единой единицы измерения жёсткости воды в мире не существует. Этот показатель измеряют в градусах, наиболее часто используют немецкие, французские и американские единицы.
В соответствии с ГОСТом 31865-2012 за единицу измерения жёсткости в России принят градус (ºЖ), величина которого равна 1 мг-экв/л (в числовом выражении это соответствует концентрации Ca или Mg, эквивалентной 1/2 миллимоля на литр).
Для определения соотношения градусов разных стран используют условную единицу ppm (part per million, или пропромилле), то есть миллионную долю базовой массы: 1 ppm = 0,0001 % (1 мг на килограмм).
Показания бытовых приборов обычно выражены в единицах страны-производителя. Чтобы сравнить их с указанными в нормативных документах, полученные значения переводят в принятые в стране единицы измерения.
Значения градусов жёсткости, приведенных к ppm:
- 1 dH (немецкий градус) = 17,8 ppm;
- 1 f (французский градус) = 10 ppm;
- 1 (английский градус, Clark) = 14,3 ppm;
- 1 A (американский градус) = 1 ppm;
- 1 мг-экв/л (1ºЖ) = 50,05 ppm.
Калькулятор перерасчета единиц жесткости воды
Исходная единица измерения:
°Ж (Россия)°DH (Германия)°Clark (Великобритания)°F (Франция)ppm (США)
Необходимая единица измерения:
°Ж (Россия)°DH (Германия)°Clark (Великобритания)°F (Франция)ppm (США)
Виды жёсткости воды
Выделяют три вида жёсткости:
- временная (карбонатная), обусловленная содержанием гидрокарбонатов кальция и магния – солей слабой угольной кислоты. При кипячении соли распадаются, в результате образуется нерастворимый осадок из карбоната кальция (СаСО3) и гидроокиси магния (Мg(OH)2;
- постоянная (некарбонатная), от которой невозможно избавиться кипячением. В воде находят соли двухвалентных металлов (кальция, магния, бария и стронция), образованных сильными кислотами: соляной (HCl), серной (h3 SO4), азотной (HNO3). Соли бария и стронция для расчета степени жёсткости воды не учитывают, поскольку их количества незначительны;
- общая – определяется как суммарная концентрация ионов кальция и магния в воде.
В России воду классифицируют в зависимости от величины показателя общей жёсткости:
- до 2°Ж – мягкая;
- от 2 до 10°Ж – средней жёсткости;
- более 10°Ж – жёсткая.

Жёсткость воды Википедия
У этого термина существуют и другие значения, см. Жёсткость.Жёсткость воды — совокупность химических и физических свойств воды, связанных с содержанием в ней растворённых солей щёлочноземельных металлов, главным образом, кальция и магния (так называемых солей жёсткости).
Жесткая и мягкая вода[ | ]
Вода с большим содержанием солей называется жёсткой, с малым содержанием — мягкой. Термин «жёсткая» по отношению к воде исторически сложился из-за свойств тканей после их стирки с использованием мыла на основе жирных кислот — ткань, постиранная в жёсткой воде, более жёсткая на ощупь. Этот феномен объясняется, с одной стороны, сорбцией тканью кальциевых и магниевых солей жирных кислот, образующихся в процессе стирки на макроуровне. С другой стороны, волокна ткани обладают ионообменными свойствами, и, как следствие, свойством сорбировать многовалентные катионы — на молекулярном уровне. Различают временную (карбонатную) жёсткость, обусловленную гидрокарбонатами кальция и магния Са(НСО3)2; Mg(НСО3)2, и постоянную (некарбонатную) жёсткость, вызванную присутствием других солей, не выделяющихся при кипячении воды: в основном, сульфатов и хлоридов Са и Mg (CaSO4, CaCl2, MgSO4, MgCl2).
Жёсткая вода при умывании сушит кожу, в ней плохо образуется пена при использовании мыла. Использование жёсткой воды вызывает появление осадка (накипи) на стенках котлов, в трубах и т. п. В то же время, использование слишком мягкой воды может приводить к коррозии труб, так как, в этом случае отсутствует кислотно-щелочная буферность, которую обеспечивает гидрокарбонатная (временная) жёсткость. Потребление жёсткой или мягкой воды обычно не является опасным для здоровья, однако есть данные о том, что высокая жёсткость способствует образованию мочевых камней, а низкая — незначительно увеличивает риск сердечно-сосудистых заболеваний.[источник не указан 379 дней] Вкус природной питьевой воды, например, воды родников, обусловлен именно присутствием солей жёсткости.
Жёсткость природных вод может варьироваться в довольно широких пределах и в течение года непостоянна. Увеличивается жёсткость из-за испарения воды, уменьшается в сезон дождей, а также в период таяния снега и льда.
Единицы измерения[ | ]
Для численного выражения жёсткости воды указывают концентрацию в ней катионов кальция и магния. Рекомендованная единица СИ для измерения концентрации — моль на кубический метр (моль/м³), однако, на практике для измерения жёсткости используются градусы жёсткости и миллиграмм-эквиваленты на литр (мг-экв/л).
В СССР до 1952 года использовали градусы жёсткости, совпадавшие с немецкими. В России для измерения жёсткости иногда использовалась нормальная концентрация ионов кальция и магния, выраженная в миллиграмм-эквивалентах на литр (мг-экв/л). Один мг-экв/л соответствует содержанию в литре воды 20,04 миллиграмм Ca2+ или 12,16 миллиграмм Mg2+ (атомная масса делённая на валентность).
С 1 января 2014 года в России введён межгосударственный стандарт ГОСТ 31865-2012 «Вода. Единица жёсткости»[1]. По новому ГОСТу жёсткость выражается в градусах жесткости (°Ж). 1 °Ж соответствует концентрации щелочноземельного элемента, численно равной 1/2 его миллимоля на литр (1 °Ж = 1 мг-экв/л).
Иногда указывают концентрацию, отнесённую к единице массы, а не объёма, особенно, если
Рассказываем о жесткости воды. — VodaLab

Жесткая вода чаще всего ассоциируется с накипью на дне чайника или ощущением мыла на руках после мытья рук, некоторые испытывают ощущение «жестких волос». По этому критерию люди обычно оценивают качество воды. В этой статье мы рассмотрим жесткость со стороны физики и химии, изучим ее свойства, разновидности, влияние на здоровье человека и способы ее устранения жесткости воды.
Соли жесткостиЭффект жесткой воды
Жесткость воды — это концентрация растворённых в ней солей магния (Mg) и кальция (Ca): гидрокарбонатов, хлоридов и сульфатов. Проще говоря, жесткой называется вода, содержащая в себе большое количество солей. Почему воду назвали «жесткой»? Женщины в старину стирали вещи на берегу рек и озер, в воде которых содержат кальций, отчего ткань становилась жесткой на ощупь.
Жесткость воды делится на 3 вида:
- Карбонатная, т.е. временная. Она ликвидируется с помощью обычного кипячения воды и обусловлена гидрокарбонатами кальция и магния Са(НСО3)2; Mg(НСО3)2.
- Некарбонатная, т.е. постоянная. Возникает из-за присутствия других солей, например CaSO4, Ca(Cl)2, MgSO4, Mg(Cl)2. При кипячении воды не устраняется.
- Общая. Представляет собой суммарную концентрацию ионов кальция и магния. Представляет собой сумму карбонатной и некарбонатной жесткости.
Единицы измерения жесткости:
Не существует единой единицы измерения жесткости. В России, в соответствии с Госстандартом, в качестве единицы жесткости воды установлен моль на кубический метр (моль/м3). В Германии — 2.8DH°; во Франции — 5F°; в Америке — 50.05 ppm CaCO3.
Классификация воды по жесткости:
| Характеристика | Жесткость, мг-экв/л |
| очень мягкая вода | до 1,5 мг-экв/л |
| мягкая вода | от 1,5 до 4 мг-экв/л |
| вода средней жесткости | от 4 до 8 мг-экв/л |
| жесткая вода | от 8 до 12 мг-экв/л |
| очень жесткая вода | более 12 мг-экв/л |
Согласно требованиям СанПиН 2.1.4.1074-01 жесткость питьевой воды должна быть не выше 7 мг-экв/л.
Влияние на здоровье человека:
Как же влияет жесткая вода на наш организм? Медики связывают появление мочекаменной болезни именно с этой особенностью воды. Но на данный момент официального подтверждения этой гипотезе нет. Но мы знаем, что слишком жесткая вода неблагоприятно влияет на органолептические свойства воды, придавая ей горьковатый вкус. Также жесткая вода сушит нашу кожу и волосы. Однако, полностью переходить на мягкую воду не рекомендуется. Наш организм нуждается в солях кальция и магния для укрепления сердечно-сосудистой системы. А вот комнатные растения лучше поливать мягкой или талой водой.
Способы борьбы с жесткой водой:
Для смягчения жесткости воды специалисты рекомендуют приобрести умягчители, которые являются самыми эффективными в борьбе с солями жидкости. Также существует несколько способов смягчения воды в домашних условиях, самым простым и привычным из которых является кипячение воды.
Для борьбы с постоянной жёсткостью воды используют такой метод, как вымораживание льда. Необходимо просто постепенно замораживать воду. Когда примерно 90% жидкости превратится в лед, нужно разморозить его обратно, а соли останутся в оставшейся незамороженной жидкости.
При выборе степени жесткости воды лучше придерживаться середины. Самым оптимальным является использование воды средней жесткости для приготовления пищи и мягкой воды для гигиенических процедур. А чтобы ваша бытовая техника не страдала от повышенной жесткости, лучше приобрести умягчитель.
Заказать анализ воды на жесткость вы можете на нашем сайте vodalab.ru. Каждый из представленных на сайте анализов содержит исследование воды на жесткость.
О других загрязнителях воды, таких как железо, мутность и марганец, вы также можете узнать подробнее в нашем блоге.
ГОСТ 6055-86 Вода. Единица жесткости
Текст ГОСТ 6055-86 Вода. Единица жесткости
ГОСУДАРСТВЕННЫЙ СТАНДАРТ
СОЮЗА ССР
ВОДА
ЕДИНИЦА ЖЕСТКОСТИ
ГОСТ 6055—86
Издание официальное
ГОСУДАРСТВЕННЫЙ КОМИТЕТ СССР ПО СТАНДАРТАМ
Москва
РАЗРАБОТАН Министерством геологии СССР ИСПОЛНИТЕЛИ
В. Т. Дубинчук, канд техн наук, И. Ю. Соколов, канд хим наук, Е. Н. Дубровина, С. В. Коновалов
ВНЕСЕН Министерством геологии СССР
Начальник Технического управления С. И. Голиков
УТВЕРЖДЕН И ВВЕДЕН В ДЕЙСТВИЕ Постановлением Государственного комитета СССР по стандартам от 20 марта 1986 г. № 584
УДК 543.3:53.081:006.354
Группа Н09
ГОСУДАРСТВЕННЫЙ СТАНДАРТ СОЮЗА ССР
ВОДА
Единица жесткости
Water. Unit of hardness
ОКСТУ 9109
ГОСТ
6055-86
Взамен
ГОСТ 6055—51
Постановлением Государственного комитета СССР по стандартам от 30 марта 1986 г. № 584 срок действия установлен
с 01.01.88 до 01.01.98
Несоблюдение стандарта преследуется по закону
1. Настоящий стандарт устанавливает единицу жесткости воды.
2. Жесткостью воды называется свойство воды, обусловленное содержанием в ней ионов кальция (1/2 Са 2+) и магния (У2 Mg2+).
3. Единицей жесткости воды является моль на кубический метр {моль/м3).
Примечания
1 Числовое значение XyCctkocth, выраженное в молях на кубический метр (моль/м3) равно числовому значению жесткости, выраженному в миллиграмм-эквиватентах на литр (м1-эквул)
2 Один моль на кубический метр соответствует массовой концентрации эквивалентов ионов кальция (У2 Са2+) 20,04 г/м3 и ионов магния (У2 Мg2+) 12,153 г/м3
4. Виды жесткости воды и соответствующие им пояснения приведены в обязательном приложении 1.
5. Термины, применяемые в настоящем стандарте и их пояснения приведены в справочном приложении 2.
6. Соотношение единиц жесткости воды, принятых в других странах, и моль на кубический метр приведено в справочном приложении 3.
Издание официальное
Перепечатка воспрещена
(С) Издательство стандартов, 1986
ПРИЛОЖЕНИЕ Г Обязательное
ВИДЫ ЖЕСТКОСТИ воды
|
Термин |
Пояснения | |
|
Общая жесткость воды |
Сумма молярных концентраций эквивалентов ионов кальция (‘/г Са2+) магния (V2 Mg2+) в воде. | |
|
Карбонатная |
жесткость |
Сумма молярных концентраций эквивалентов |
|
воды |
карбонатных (СОд~) и гидрокарбонатных (HCOj~) ионов в воде. Примечание. Если значение карбонатной жесткости воды больше значения общей жесткости, то значение карбонатной жесткости принимают равным значению общей жесткости воды. | |
|
Некарбонатная |
жесткость |
Разность между общей и карбонатной жест |
|
воды |
костью воды. | |
|
Устранимая |
жесткость |
Жесткость воды, обусловленная наличием в |
|
воды |
воде карбонатных (СО |~*) и гидрокарбонатных (НСО3) ионов солей кальция и магния, удаляемая при кипячении и определяемая экспериментально. Разность между общей и устранимой | |
|
Неустранимая воды |
жесткость |
жесткостью воды. |
ПРИЛОЖЕНИЕ 2
Справочное
ТЕРМИНЫ, ПРИМЕНЯЕМЫЕ В НАСТОЯЩЕМ СТАНДАРТЕ,
И ИХ ПОЯСНЕНИЯ
Т ермин
Пояснения
1. Эквивалент
2. Молярная концентрация эквивалента
Реальная или условная частица вещества, ко* торая в данной кислотно-основной реакции эквивалентна одному иону водорода или в данной окислительно-восстановительной реакции одному электрону.
Форма записи:
Льв(Са2+)Са2+=4-Са2+,
где Лкв(Са2+)=
фактор эквивалентности.
/ KB(Mg2+)Mg2+=—Mg2+,
,, 1
где , фактор
эквивалентности.
Примечание Фактор эквивалентности — число, обозначающее, какая доля реальной частицы вещества эквивалентна одному иону водорода в данной кислотно-основной реакции или одному электрону в данной окислительновосстановительной реакции
Отношение количества вещества эквивалента в системе (например, в растворе) к объему этой системы
Примечание Количество вещества экви* валента —- количество вещества (в молях), в котором частицами являются эквиваленты.
ПРИЛОЖЕНИЕ 3 Справочное
СООТНОШЕНИЕ ЕДИНИЦ ЖЕСТКОСТИ ВОДЫ, ПРИНЯТЫХ В ДРУГИХ СТРАНАХ С ЕДИНИЦЕЙ МОЛЬ НА КУБИЧЕСКИЙ МЕТР (моль/м3]
Единицы жесткости воды
|
моль/м3 |
Немецкий |
Французский |
Американский |
|
градус |
градус |
градус | |
|
1,000 |
2,804 |
5,005 |
50,050 |
Примечания*
1. Один немецкий градус соответствует 10 мг/л СаО в воде.
2. Один французский градус соответствует 10 мг/л СаСОэ в воде.
3. Один американский градус соответствует 1 мг/л СаСОз в воде.
Сдано в наб Тир 20 000
Ордена «Знак
Редактор Т. И. Василенко Технический редактор Н. В. Белякова Корректор Е. И. Морозова
09 04 86 Подп в печ 20 06 86 0,5 уел п л 0,5 уел кр отт 0,22 уч изд л.
Цена 3 коп.
Почета» Издательство стандартов, 123840, Москва, ГСП, Новопресненскнй лер,, 3 Тип. «Московский печатник», Москва, Лялин пер., 6. За к. 2063
Цена 3 коп.
|
Велн ^ина |
Едн» то | ||
|
Наименование |
Обозначение | ||
|
междунае сдное |
русское | ||
|
0 С Н 0 В н ы |
Е ЕД И НИ L |
1 Ы СИ | |
|
метр |
ш |
м | |
|
Масса |
килограмм |
кг | |
|
Время |
секунда |
S |
с |
|
Сила электрического тока |
ампер |
А |
А |
|
Термодинамическая температура |
кельвин |
К |
К |
|
Количество вещества |
моль |
то] |
моль |
|
С *ла света |
кандела |
cd |
кд |
|
ДОПОЛНИТЕЛЬНЫЕ ЕД |
, И Н И ЦЫ СИ | ||
|
ТПлоский угол |
радиан |
rad |
рад |
|
клееный угол |
стерадиан |
sr |
СР |
ПРОИЗВОДНЫЕ ЕДИНИЦЫ СИ, ИМЕЮЩИЕ СПЕЦИАЛЬНЫЕ НАИМЕНОВАНИЯ
|
Единица |
Выражение через основные и до- | |||
|
Величина |
Обозначение | |||
|
Наименова ние |
междунэ родное |
русское |
полннтельные единицы СИ | |
|
Частота |
герц |
Н 7 |
Гц |
с-‘ |
|
Сила |
ньютон |
N |
Н |
м кг с~г |
|
некие |
паскаль |
Pi |
Па |
М“1 • кг с-2 |
|
О* оргия |
джоуль |
J |
Дж |
М2 КГ С—2 |
|
Мощность |
ватт |
W |
Вт |
м2 кг с-3 |
|
Количество электричества |
кулон |
С |
Кл |
с А |
|
Электрическое напряжение |
вольт |
V |
В |
м2 кг с“э • А~* |
|
Электрическая емкость |
фарад |
F |
Ф |
м~2кг—1 — с 4 А2 |
|
Электрическое сопротивление |
ом |
( у |
Ом |
м2 кг с—‘5 А-2 |
|
-Электрическая проводимость |
сименс |
S |
См |
м 2Ki 1 с3 А2 |
|
Поток тдагнитной индукции |
вебер |
Wh |
Вб |
м2 * кг- с-2 А’1 |
|
Магнитная индукция |
гесла |
Т |
Тл |
кг с-2 А-1 |
|
Индуктивность |
генри |
Н |
Гн |
м2 кг с-2-А”2 |
|
Световой поток |
люмен |
1т |
лм |
КД * ср |
|
Освещенность |
люкс |
1х |
лк |
м ~2 • кд * ср |
|
Активность радионуклида |
беккерель |
Bq |
Бк |
С-1 |
|
Поглощенная доза ионизирую* |
грэй |
Gy |
Гр |
м2 * с“2 |
|
щего излучения Эквивалентная доза излучения |
зивеот |
Sv |
Зв |
м2 * с”2 |
(единица+жесткости+воды) — со всех языков на русский
См. также в других словарях:
ГОСТ 6055-86: Вода. Единица жесткости — Терминология ГОСТ 6055 86: Вода. Единица жесткости оригинал документа: Карбонатная жесткость воды Сумма молярных концентраций эквивалентов карбонатных (СО3 ) и гидрокарбонатных (НСОр) ионов в воде. Определения термина из разных документов:… … Словарь-справочник терминов нормативно-технической документации
ГРАДУС ЖЕСТКОСТИ — устаревшее единица жесткости воды. Градус жесткости заменен новой единицей жесткости, равной молярной концентрации ммоль/кг. Смотри также Жесткость воды … Металлургический словарь
градус жесткости — Единица измерения жесткости воды, равная содержанию в воде соединений кальция и магния, эквивалентному 10 мг/л окиси кальция (СаО) … Политехнический терминологический толковый словарь
Жёсткость воды — Жёсткость воды совокупность химических и физических свойств воды, связанных с содержанием в ней растворённых солей щёлочноземельных металлов, главным образом, кальция и магния (так называемых «солей жёсткости»). Содержание 1 Жёсткая и… … Википедия
Некарбонатная жесткость воды — Устранимая жесткость воды Примечание. Если значение карбонатной жесткости воды больше значения общей жесткости, то значение карбонатной жесткости принимают равным значению общей жесткости воды. Разность между общей и карбонатной жесткостью воды.… … Словарь-справочник терминов нормативно-технической документации
Жесткость воды — Жёсткость воды совокупность химических и физических свойств воды, связанных с содержанием в ней растворённых солей щёлочноземельных металлов, главным образом, кальция и магния. Вода с большим содержанием таких солей называется жёсткой, с малым… … Википедия
Неустранимая жесткость воды — мая при кипячении и определяемая экспериментально. Разность между общей и устранимой жесткостью воды. Источник: ГОСТ 6055 86: Вода. Единица жесткости оригинал документа … Словарь-справочник терминов нормативно-технической документации
Карбонатная жесткость воды — Сумма молярных концентраций эквивалентов карбонатных (СО3 ) и гидрокарбонатных (НСОр) ионов в воде. Источник: ГОСТ 6055 86: Вода. Единица жесткости оригинал документа … Словарь-справочник терминов нормативно-технической документации
Общая жесткость воды — Сумма молярных концентраций эквивалентов ионов кальция ( /г Са2+) магния (У2 Mg2+) в воде. Источник: ГОСТ 6055 86: Вода. Единица жесткости оригинал документа … Словарь-справочник терминов нормативно-технической документации
Правила: Правила устройства и безопасной эксплуатации паровых котлов с давлением пара не более 0,07 МПа (0,7 кГс/см2), водогрейных котлов и водоподогревателей с температурой нагрева воды не выше 388 К (115 град. Цельсия) — Терминология Правила: Правила устройства и безопасной эксплуатации паровых котлов с давлением пара не более 0,07 МПа (0,7 кГс/см2), водогрейных котлов и водоподогревателей с температурой нагрева воды не выше 388 К (115 град. Цельсия): Автономный… … Словарь-справочник терминов нормативно-технической документации
Градус — Единица плоских углов, дуг окружности, температуры, плотности, вязкости, жесткости воды и т.д … Словарь мер