4. Расчет показателей жесткости воды
4.1. Теоретическая часть
Жесткость воды обусловлена присутствием в ней растворенных солей кальция и магния. Различают общую, карбонатную и некарбонатную жесткость.
Общей жесткостью (Жо) называется суммарная концентрация ионов Ca2+ и Mg2+ в воде, выраженная в моль/м3 или ммоль/дм3. Общая жесткость воды (ЖО) равна сумме карбонатной и некарбонатной жесткости.
ЖО = [Са2+] + [Mg2+] = ЖК + ЖНК; (ммоль/дм3)
Количественно
жесткость воды определяется суммой
молярных концентраций эквивалентов
ионов кальция и магния, содержащихся в
1 дм
Карбонатная (временная) жесткость (ЖК) обусловлена содержанием в воде преимущественно гидрокарбонатов (и карбонатов при рН > 8,3) солей кальция и магния: Ca(НСО3)2, Мg(НСО3)2, (МgСО3).
Некарбонатная жесткость воды (ЖНК) обусловлена присутствием в воде сульфатов и хлоридов солей кальция и магния: СаSO4, MgSO4, СаС12, MgС12
Жнк = Жо – Жк
По величине жесткости природную воду делят на: очень мягкую — до 1,5 ммоль/дм3; мягкую — от 1,5 до 4 ммоль/дм3; средней жесткости — от 4 до 8 ммоль/дм3; жесткую — от 8 до 12 ммоль/дм3; очень жесткую — свыше 12 ммоль/дм3.
В зависимости от конкретных требований производства допускаемая жесткость воды может быть различной. Жесткость воды хозяйственно-питьевых водопроводов не должна превышать 7 ммоль/дм3 (мг-экв/дм3).
4.2. Пример решения индивидуального задания
Условие задания: Рассчитать карбонатную, некарбонатную и общую жесткость воды, если в 1м3 исследуемой воды содержится 80 г Ca2+; 55 г Mg2+; 415 г HCO3—.
Дано:
m (Са2+) = 80 г = 80 000 мг
m (Mg2+) = 55 г = 55 000 мг
m (HCO3—) = 415 г = 415 000 мг
V(Н2О) = 1 м3 = 1000 дм3
Жо -? Жк — ? Жнк — ?
Решение
Жо
=[Са2+]
+ [Mg2+] = 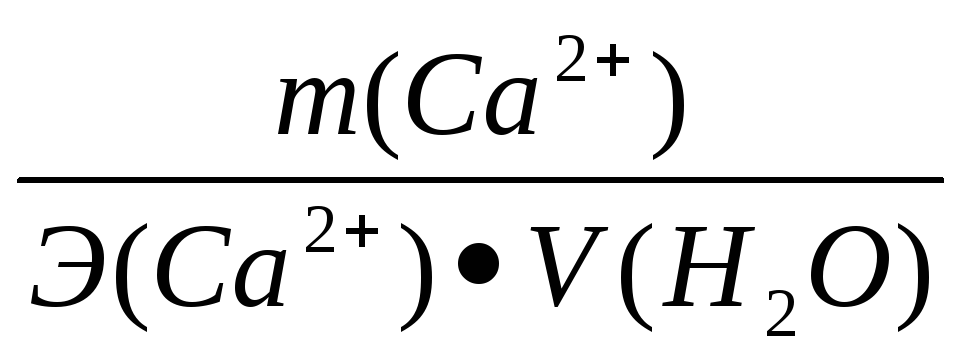 +
+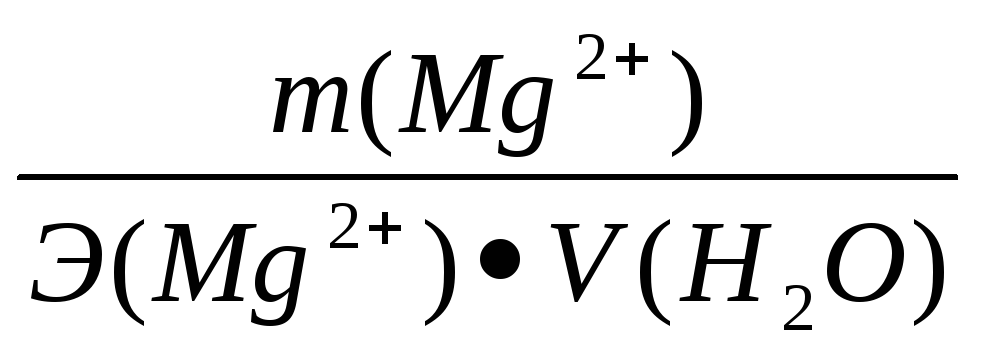 ;
мг – экв/дм3
;
мг – экв/дм3
где: [Са2+], [Mg2+] – концентрация ионов в мг-экв/дм3;
m (Са2+), m (Mg2+) – содержание ионов Са2+ и Mg2+ в мг;
V(Н2О) – объем воды, дм3;
Э
(Са
Э
(Са2+) = 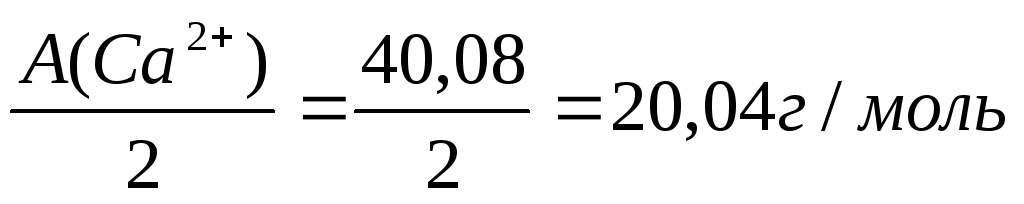
Э(Mg2+) = 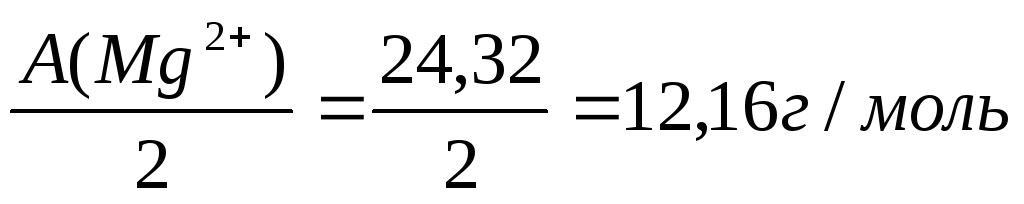
Тогда:
Жо
= [Са2+] + [Mg2+]
= 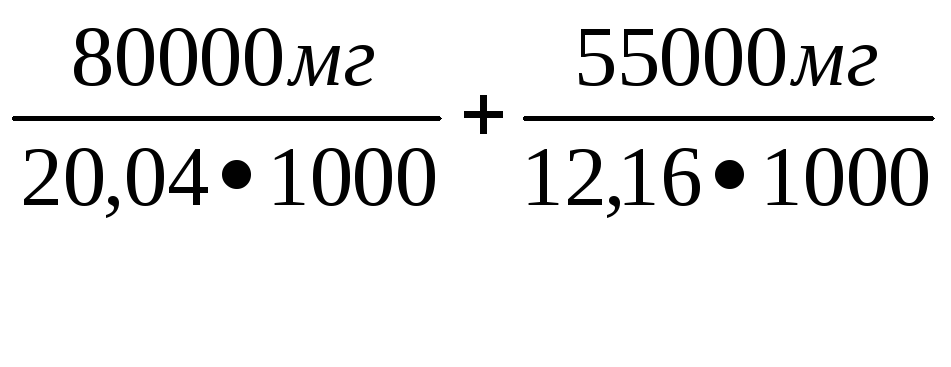 =3,99 + 4,52 = 8,5 мг-экв/дм3
=3,99 + 4,52 = 8,5 мг-экв/дм3
2). Рассчитываем жесткость карбонатную (Жк) по формуле:
Жк
= [НСО3—] = 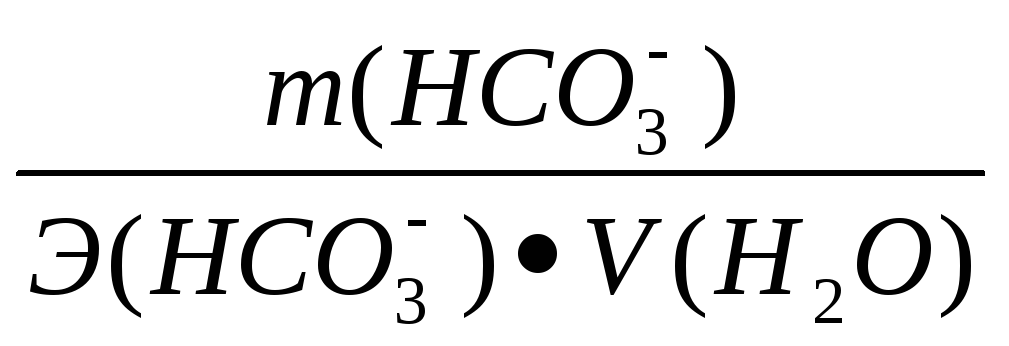
где: [НСО3—] — концентрация в мг-экв/дм3; m (НСО3—) – содержание иона НСО3— в мг; V(Н2О) – объем воды, дм3; Э (НСО3—) – эквивалентная масса иона НСО3—, которая равна:
Э
(НСО3—) = 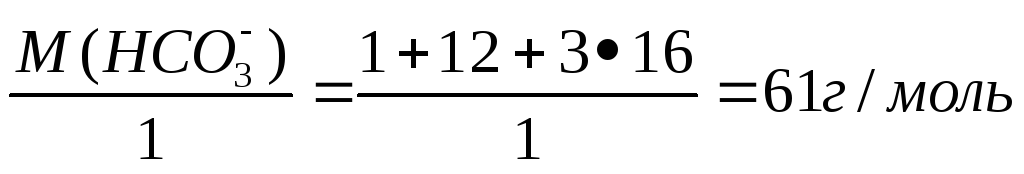
Тогда:
Жк
= [НСО3—]
=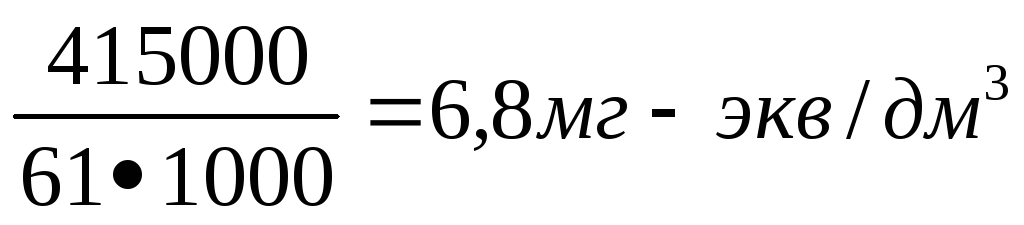
3). Рассчитываем жесткость некарбонатную (Жнк), как разность между жесткостью общей и карбонатной:
Жнк = Жо – Жк = 8,5 – 6,8 = 1,7 мг-экв/дм3
4). Результаты расчетов приведены в табл. 4.6.
Таблица 4.6
Показатели жесткости исследуемой воды
Наименование показателя: | Содержание в: | |
мг-экв/дм3 | мг/дм3 | |
Са2+ | 3,99 | 3,99 • 20,04 = 80 |
Mg2+ | 4,52 | 4,52 • 12,16 = 55 |
Жесткость общая, Жо | 8,5 | |
Жесткость карбонатная, Жк | 6,8 | — |
Жесткость некарбонатная, Жнк | 1,7 | — |
Понятие жесткости воды, формула расчета, единицы измерения, нормы в России
О том, что водопроводная вода слишком жесткая, приходиться слышать постоянно. Чем же измеряется «твердость» жидкости? И как рассчитывается жесткость воды.
На фото: «пострадавший» от солей жесткости нагревательный элемент
Если свести к минимуму научные рассуждения о совокупности свойств жидкости, то жесткостью воды можно считать суммарное количество растворенных солей щелочноземельных металлов (преимущественно кальция и магния). С химической точки зрения все двухвалентные катионы в той или иной степени способны связываться с анионами, образуя соли, способные выпадать в осадок. Однако на практике количество растворенного в воде стронция, бария и марганца сведено к минимуму, а алюминий и железо переходят в солевые комплексы только при определенном уровне кислотности среды (рН меньше 7), который в природе практически не встречается. Мы уже писали про то, как определить жесткость в домашних условиях.
Таблица 1. Катионы и анионы, обуславливающие жесткость
|
Катионы жесткости |
Анионы жесткости |
|
Кальций (Ca2+) |
Гидрокарбонат (НСО3—) |
|
Магний (Mg2+) |
Сульфат (SO42-) |
|
Стронций (Sr2-) |
Хлорид (Cl—) |
|
Железо (Fe2+) |
Нитрат (No3—) |
|
Марганец (Mn2+) |
Силикат (Sio32-) |
Формула жесткости воды
Формула позволяет рассчитать суммарное количество ионов кальция и магния в воде, используется для лабораторных исследований. В настоящее время выделяют несколько типов жесткости:
Карбонатная жесткость – количественное содержание в воде гидрокарбонатов и карбонатов магния и кальция (MgHCO3, CaHCO3). Данный тип загрязнителей легко устраняется при кипячении с образование угольной кислоты и осадка:
Ca2+ + 2HCO3— (при нагревании)= CaCO3↓ + H2O + CO2↑
Некарбонатная (постоянная) жесткость обусловлена присутствием магниевых и кальциевых соединений сильных кислот (азотной, соляной, серной). При кипячении соли такого типа не распадаются.
Формула для расчета общей жесткости воды: Hобщ=Нкарб+Ннекарб
Единицы измерения
Единицы измерения в России – градусы (°Ж), может быть выражена в объемной или массовой доле. 1 градус жесткости численно равен 0,5 мольной концентрации щелочноземельного элемента, выраженной в мг/куб. дм. (1°Ж=1 мг-экв/л.)
Единицы измерения в системе СИ – моль/куб.метр. Однако на практике чаще всего используют мг-экв./л. Концентрация, отнесенная к единице массы, оправдывает себя в тех случаях, когда необходим анализ воды в ином агрегатном состоянии (с измененной плотностью).
Для тех, кому химия на уроках давалась нелегко, следует повторить:
Один мг-экв/л соответствует 20,04 миллиграммам ионов Ca2+ или 12,16 миллиграммам ионов Mg2+ (отношение атомной массы и валентности элемента).
Нормы жесткости
По величине жесткости воду можно разделить на три категории:
— мягкая (до 2 °Ж),
— средней жесткости (2-10 °Ж),
— очень жесткая (более 10 °Ж).
Нормы жесткости в России не позволяют превышать 7 мг-экв/л. Согласно стандартам Евросоюза, ПДК общей жесткости воды не может быть больше 1,2 мг-экв/л. Путем несложных расчетов можно сделать вывод о том, что в Европе вода почти в 6 раз мягче, чем в России.
Таким образом, численно подтвержденная необходимость установки систем очистки в России уже не вызывает сомнений. Кроме того, согласно принятым во всем мире нормативам, употребляемая нашими соотечественниками вода, нуждается в многоступенчатом умягчении и глубокой фильтрации.
Теперь разберемся, как устранить чрезмерное содержание солей в воде:
— Обзорная статья про то, как уменьшить жесткость воды: способы;
— Умягчители воды
Виды;
— Магнитные
— Ионообменные
Используемая литература:
- ГОСТ 2874—82
- ГОСТ Р 52029-2003 | НАЦИОНАЛЬНЫЕ СТАНДАРТЫ
- Химическая энциклопедия. — М.: Советская энциклопедия, 1990. Т. 2. С. 145.
15
82
8 Лабораторная работа №16
Жесткость воды, методы ее определения
Цель работы: познакомиться с понятием жесткости воды; овладеть методиками определения общей, временной (карбонатной) и постоянной (некарбонатной) жесткости воды методами потенциометрического и кислотно-основного титрования.
Оборудование и реактивы: 0,1н. соляная кислота; 0,1н. раствор трилона Б; индикаторы: эриохром черный кристаллический, фенолфталеин, метиловый оранжевый; аммиачный буфер; рН-метр; магнитная мешалка; бюретки; пипетки на 100 мл или мерные цилиндры; колбы на 250 мл и 500 мл; стаканы на 200 – 250 мл; мерные колбы на 200 мл; бумажные фильтры.
8.1 Теоретические пояснения
Природная вода в своем составе всегда содержит различные примеси: соли и газы, механические примеси, находящиеся во взвешенном состоянии, эмульсии, гидрозоли и другие образования. Некоторые соли, присутствующие в воде, вызывают ее жесткость.
Жесткость воды – это совокупность свойств воды, обусловленных присутствием в ней катионов Ca2+ и Mg2+, реже Fe2+.
Содержание в воде большого количества примесей растворимых солей кальция и магния делает ее непригодной для технических целей. Повышенная жесткость воды приводит к образованию накипи в паровых котлах и бытовой посуде. Это ухудшает теплообмен, а, следовательно, приводит к перерасходу топлива, электроэнергии, перегреву металлических поверхностей.
В жесткой воде ухудшается пенообразование и увеличивается расход мыла при стирке, так как часть содержащихся в нем растворимых солей жирных кислот переходит в нерастворимое состояние:
2C17H35COONa + CaSO4 = (C17H35COO)2Ca + Na2SO4.
При этом также ухудшается качество тканей вследствие осаждения на них нерастворимых кальциевых и магниевых солей высших жирных кислот.
В воде с повышенной жесткостью плохо развариваются овощи и мясо, так как катионы кальция образуют с белками нерастворимые соединения. Большая магниевая жесткость придает воде горький вкус.
Суммарное содержание Ca2+ и Mg2+ в воде называется общей жесткостью. Жесткость воды оценивается по-разному. В нашей стране ее чаще всего выражают количеством вещества эквивалентов кальция и магния (в ммоль) в одном литре воды.
Жесткость воды хозяйственно-питьевых водопроводов не должна превышать 7 ммоль экв./л. По величине жесткости воду условно подразделяют на мягкую (до 4 ммоль экв./л), средней жесткости (4 – 8 ммоль экв./л), жесткую (8 – 12 ммоль экв./л) и очень жесткую (более 12 ммоль экв./л).
Общая жесткость складывается из карбонатной (временной) и некарбонатной (постоянной). Карбонатная жесткость обусловлена присутствием в воде гидрокарбонатов кальция, магния, а иногда также и гидрокарбоната железа (II). Этот вид жесткости можно устранить кипячением:
Ca(HCO3)2 CaCO3 + H2O + CO2
CaCO3 + H2O + CO2
Mg(HCO3)2 MgCO3 + H2O
+ CO2;
MgCO3 + H2O
+ CO2;
2MgCO3 + H2O (MgOH)2CO3 + CO2
(MgOH)2CO3 + CO2
(MgOH)2CO3+H2O 2Mg(OH)2 +CO2
2Mg(OH)2 +CO2
Fe(HCO3)2 Fe(OH)2 + 2CO2;
Fe(OH)2 + 2CO2;
4Fe(OH)2 + O2 + 2 H2O 4Fe(OH)3.
При кипячении воды растворенные в ней гидрокарбонаты разлагаются, и карбонатная жесткость сильно снижается, однако полного устранения карбонатной жесткости не происходит вследствие того, что карбонаты кальция и магния несколько растворим в воде.
Наряду с понятием карбонатная жесткость, используется термин устранимая жесткость. Это та величина, на которую понижается жесткость при десятиминутном кипячении воды. Жесткость, оставшаяся после кипячения воды, называется постоянной жесткостью.
Для уменьшения карбонатной жесткости применяют также метод известкования:
Ca(HCO3)2 + Ca(OH)2 2CaCO3 + 2H2O
Mg(HCO3)2 + 2Ca(OH)2 Mg(OH)2 + 2CaCO3 + 2H2O.
Некарбонатная жесткость обусловлена присутствием в воде растворимых, устойчивых к нагреванию солей кальция и магния. Чаще всего это сульфаты и хлориды.
Некарбонатную жесткость можно устранить обработкой воды карбонатом или фосфатом натрия:
MeSO4 + Na2CO3 MeCO3 + Na2SO4.
Для устранения жесткости применяют также катиониты. Это ионообменные смолы и алюмосиликаты, содержащие в своем составе подвижные катионы, например, Na+, H+, способные обмениваться на катионы среды. Если пропускать воду через слои катионита, то его подвижные катионы будут обмениваться на катионы кальция и магния, при этом катионы жесткости остаются в катионите, а подвижные ионы катионита переходят в раствор. При помощи Н+-катионирования умягчают воду с преобладанием карбонатной жесткости, а при помощи Na+-катионирования – с преобладанием некарбонатной жесткости.
Для умягчения воды можно также использовать и физические методы: электродиализ, ультразвуковую, магнитную и магнитно-ионизационную обработку воды.
Жесткость воды определяется аналитически.
Карбонатную (устранимую или временную) жесткость воды определяют титрованием воды соляной кислотой:
Са(НСО3)2 + 2НС1 = CaCI2 + 2H2O + 2СO2
Mg(HCO3)2 + 2НС1 = MgCl2 + 2Н2О + 2СО2
Точку эквивалентности можно определить либо потенциометрическим титрованием с помощью рН-метра (определение объема раствора соляной кислоты в точке скачка рН), либо титрованием в присутствии кислотно-основных индикаторов (чаще всего метилового оранжевого).
Для выбора соответствующего кислотно-основного индикатора необходимо построить интегральную кривую титрования на основании данных потенциометрического титрования, а затем выбрать такой индикатор, интервал перехода окраски которого попадает в область скачка рН на кривой титрования. В таблице 8.1 приводятся интервалы перехода окраски для некоторых индикаторов.
Таблица 8.1 – Характеристики наиболее часто применяемых кислотно-основных индикаторов
№ | Индикатор | Интервал перехода окраски, единицы рН | Изменение окраски раствора при возрастании рН |
1 | О-крезоловый синий | 0,2 — 1,9 | красная ® желтая |
2 | Тимоловый синий | 1,2 – 2,8 | красная ® желтая |
3 | Метиловый оранжевый | 3,1 – 4,4 | красная ® оранжевая |
4 | Бромкрезоловый зеленый | 3,8 – 5,4 | желтая ® синяя |
5 | Бромметиловый зеленый | 5,0 – 8,0 | желтая ® синяя |
6 | Лакмус | 6,0 –8,0 | красна ® синяя |
7 | Бромтимоловый синий | 6,0 – 7,6 | желтая ® синяя |
8 | Феноловый красный | 6,8 – 8,4 | желтая ® красная |
9 | Фенолфталеин | 8,2 – 10 | бесцветная ® малиновая |
10 | Ализариновый желтый | 10,0 – 12,0 | бледно-лимонная ® желтая |
Некарбонатную (постоянную) жесткость воды определяют методом обратного титрования. К отмеренному объему исследуемой воды добавляют определенный объем раствора карбоната натрия известной концентрации и выпаривают раствор досуха. При этом образуются нерастворимые в воде карбонаты кальция и магния.
Са2+ + Mg2+ + 2Na2CO3 = CaCO3 + MgCO3 + 2Na+
Сухой остаток, представляющий из себя смесь карбонатов кальция, магния, натрия и других солей натрия, растворяют в не содержащей СО2 воде, отфильтровывают нерастворимые в воде карбонаты кальция и магния и титриметрическим способом определяют в растворе количество избыточного Na2CO3, не вошедшего в реакцию осаждения карбонатов. Специальными опытами показано, что при этом Na2CO3 не реагирует с гидрокарбонатами кальция и магния. Именно поэтому, рассмотренный метод позволяет определять постоянную жесткость воды.
Современным методом определения общей жесткости воды является титрование воды раствором трилона Б в присутствии специальных индикаторов-хромогенов, чаще всего эриохрома черного. Титрование проводится в аммиачной среде при значении рН раствора в пределах 9-10.
Трилон Б (комплексон III) – это динатриевая соль этилендиамминтетрауксусной кислоты (NaO2CCH2)2N(CH2)2N(CH2CO2H)2, сокращенно – Na2H2ЭДТА.
Na2H2ЭДТА + Са2+ (или Mg2+) ® Na2CaЭДТА + 2H+.
Хромоген образует с ионами магния и другими ионами относительно непрочные комплексные соединения, окрашенные в красно-фиолетовый цвет. При титровании трилоном Б содержащиеся в воде ионы Са2+ и Mg2+, а также ионы Cu2+, Zn2+, Mn2+, Cd2+, Ni2+, Al3+, Fе2+, Fe3+ реагируют с ним и образуют мало диссоциированные бесцветные прочные комплексные соединения. В конце титрования ионы магния, кальция и другие переходят от комплексного соединения с хромогеном к трилону Б, с образованием прочных бесцветных комплексов.
Поэтому в точке эквивалентности красно-фиолетовая окраска раствора исчезает. Однако раствор не обесцвечивается, а окрашивается в сине-фиолетовый цвет – цвет самого хромогена эриохрома черного при рН = 9-10 (аммиачный буфер). Это указывает на окончание титрования.
Так как трилон Б образует прочные комплексы со всеми катионами кальция и магния вне зависимости от характера аниона, то комплексонометрическим методом определяют именно общую жесткость воды.
Проба воды должна характеризовать действительный ее состав, поэтому при отборе пробы из водопровода воду спускают в течение 10-15 минут. Когда склянка наполнится, воду некоторое время переливают через край.
Из рек и ручьев отбирают пробы воды на глубине 0,75 м в нескольких местах, около берегов и в середине реки. Отдельные пробы смешивают вместе. Анализ воды проводят сразу же после взятия пробы или, в крайнем случае, при соответствующем хранении спустя несколько часов.
8.2 Методика проведения опытов
8.2.1 Опыт №1. Определение карбонатной жесткости воды
Мерным цилиндром отбирают в две конические колбы по 100 мл исследуемой воды из-под крана. Оттитровывают воду в первой колбе 0,1н. раствором НСl. Для этого с помощью рН-метра фиксируют значения рН воды после каждого прибавления очередной порции HCl из бюретки. Объем каждой порции HCl составляет 0,5 мл.
По полученным значениям рН и объема прилитой кислоты строят интегральную и дифференциальную кривые титрования. Из кривых титрования определяют точку эквивалентности. Пользуясь данными таблицы 8.1 выбирают индикатор для экспресс-анализа. Интервал перехода окраски выбранного индикатора должен находиться в пределах скачка рН на интегральной кривой титрования.
Карбонатную жесткость воды Жкарб., выраженную в ммоль экв./л, определяют по формуле (8.1):
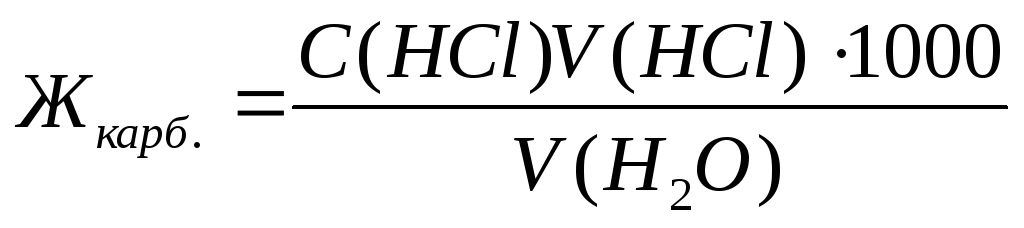 , (8.1)
, (8.1)
где V(HCl) – объем раствора 0,1н. НСl, израсходованного до достижения точки эквивалентности, мл;
С(HCl) – концентрация раствора HCl, моль экв./л;
V(Н2О) – объем исследуемой воды, мл;
1000 – коэффициент пересчета от моль к ммоль.
Затем проводят титрование воды во второй колбе 0,1н. раствором НСl. Только на этот раз за ходом титрования следят визуально, по изменению окраски выбранного индикатора. Вблизи точки эквивалентности последняя капля титранта вызывает резкое изменение окраски раствора, содержащего индикатор. Фиксируют объем прибавленной кислоты к моменту достижения точки эквивалентности. Проводят расчет карбонатной жесткости воды по формуле (8.1)
8.2.2 Опыт №2. Определение общей жесткости воды
В коническую колбу отмеряют пипеткой 100 – 150 мл исследуемой воды, добавляют 5 мл аммиачного буфера и несколько кристаллов эриохрома черного до образования заметной вишнево-красной окраски. При слабой окраске раствора проверяют его рН универсальной индикаторной бумагой. Значение рН должно находиться в интервале 8-11. При необходимости корректируют рН добавлением в раствор буферной смеси.
Раствор оттитровывают стандартным раствором трилона Б до точки резкого перехода вишнево-красной окраски в синюю. Окраска раствора от избытка трилона Б остается неизменной, поэтому в конце титрования рабочий раствор трилона Б прибавляют осторожно, по каплям, энергично перемешивая.
Титрование повторить два раза и взять среднее значение объема израсходованного раствора трилона Б.
Общую жесткость воды Жобщ., выраженную в ммоль экв./л, определяют по формуле (8.2):
 , (8.2)
, (8.2)
где V1 – объем рабочего раствора трилона Б, израсходованного на титрование пробы воды, мл;
N – молярная концентрация эквивалента рабочего раствора трилона Б, моль экв./л;
V2 – объем исследуемой воды, мл;
1000 – коэффициент пересчета от моль к ммоль.
По разности значений общей и карбонатной жёсткости определить постоянную жесткость. Сделать вывод о характере и степени жесткости исследуемой воды.
8.3 Примеры решения задач
Пример 1
Рассчитайте общую жесткость воды (ммоль экв./л), если в 0,15 л воды содержится 16,2 мг гидрокарбоната кальция, 2,92 мг гидрокарбоната магния, 11,10 мг хлорида кальция и 9,50 мг хлорида магния.
Решение
Выразим общую жесткость воды как сумму миллимолярных концентраций эквивалентов двухзарядных катионов металлов (или соответствующих им солей) в воде:
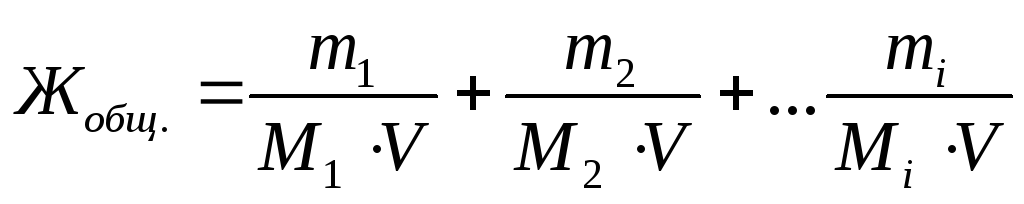 ,
,
где m1, m2, mi – массы двухзарядных катионов металлов, либо массы соответствующих им солей, либо массы веществ, пошедших на устранение жесткости воды, мг;
M1, M2, Mi – молярные массы эквивалентов двухзарядных катионовметаллов, либо массы соответствующих им солей, либо массы веществ, пошедших на устранение жесткости воды, г/моль;
V – объем воды, л.
Молярные массы эквивалентов солей, перечисленных в условии задачи, рассчитываются по формуле:
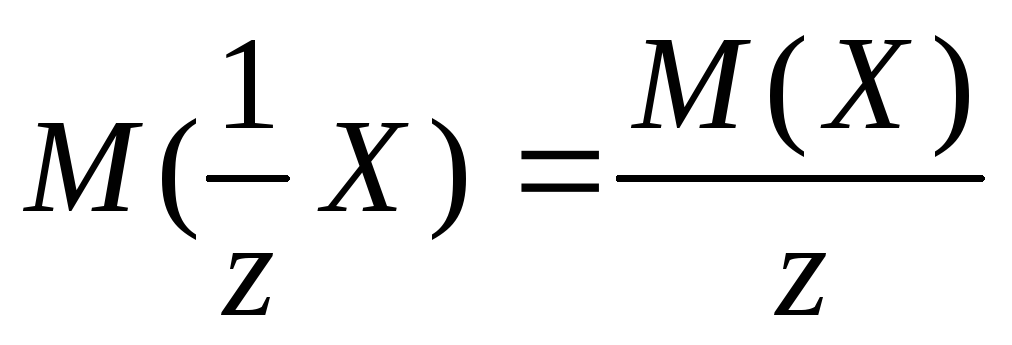 ,
,
где z – эквивалентное число, для солей жесткости оно равно 2;
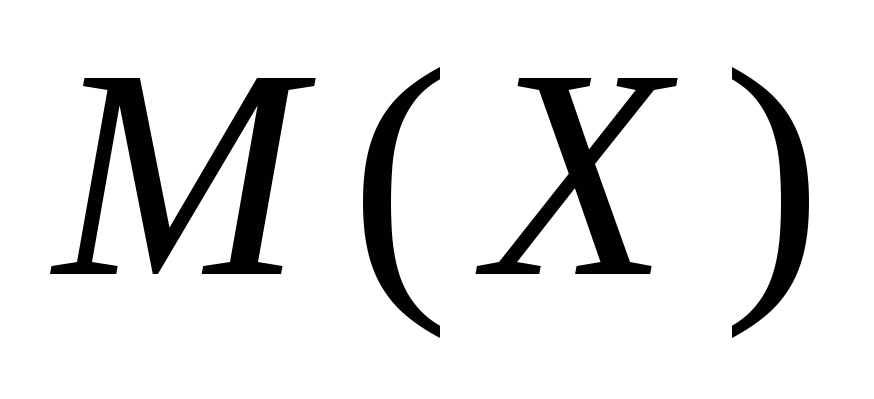 – молярная масса
соли Х.
– молярная масса
соли Х.
Формула соли | Са(HCО3)2 | Mg(HCО3)2 | СаCl2 | MgCl2 |
| 81 | 73 | 55.5 | 48 |
Общая жесткость данного образца воды равна сумме временной и постоянной жесткости:
 =
=
=2,56 ммоль экв./л
Пример 2
Определите временную жесткость воды, если на титрование 0,1 л воды, содержащей гидрокарбонат магния, израсходовано 7,2∙10-3л 0,14н. раствора HCl.
Решение
При титровании воды соляной кислотой происходит реакция:
Mg(HCO3)2 + 2НС1 = MgCl2 + 2Н2О + 2СО2
Временную жесткость воды рассчитаем по формуле (8.1):
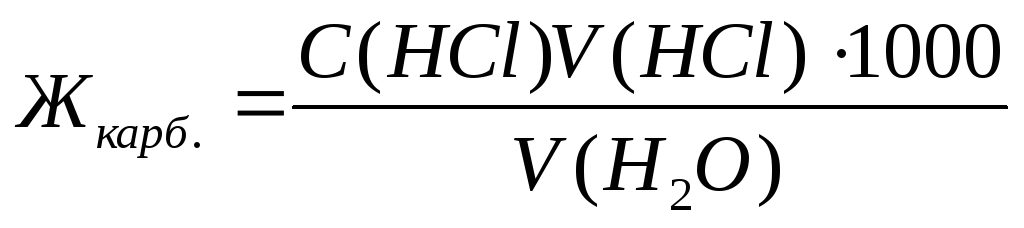
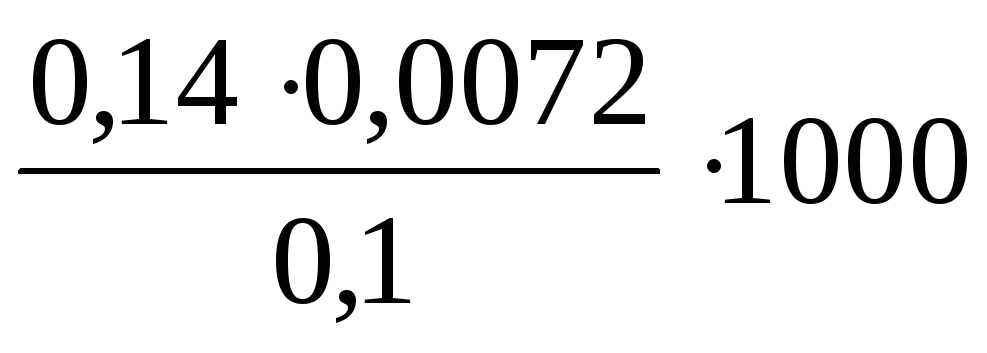 =10,08 ммоль
экв./л
=10,08 ммоль
экв./л
Пример 3
Для устранения общей жесткости по известково-содовому методу добавлено 7,4 г Са(ОН)2 и 5,3 г Na2CO3. Рассчитать временную и постоянную жесткость воды.
Решение
Добавление к воде Са(ОН)2 может устранить временную жесткость, а добавление Na2CO3 – постоянную жесткость. При добавлении этих реагентов к воде происходят следующие реакции:
Ca(HCO3)2 + Ca(OH)2 2CaCO3 + 2H2O
Mg(HCO3)2 + 2Ca(OH)2 Mg(OH)2 + 2CaCO3 + 2H2O.
Ca(NО3)2 + Na2CO3 = MeCO3 + 2NaNO3
Mg(NО3)2 + Na2CO3 = MeCO3 + 2NaNO3
Временную жесткость воды Жвр измеряют количеством вещества эквивалентов гидроксида кальция, участвующего в реакции, а постоянную жесткость Жпост– количеством вещества эквивалентов карбоната натрия.
M(1/2Са(ОН)2) = 74/2=37 г/моль;
M(1/2Na2CO3) = 106/2=53 г/моль;
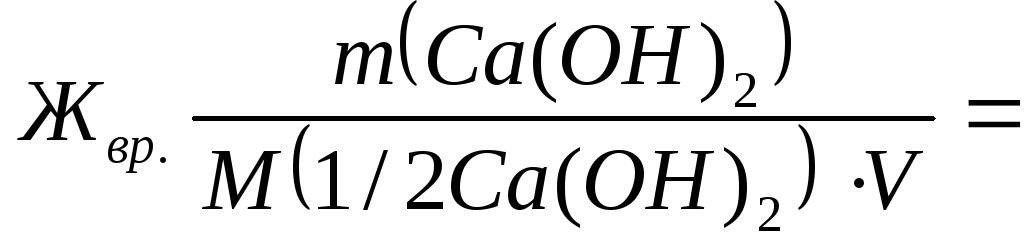 7400/(37∙50) = 4 ммоль
экв./л;
7400/(37∙50) = 4 ммоль
экв./л;
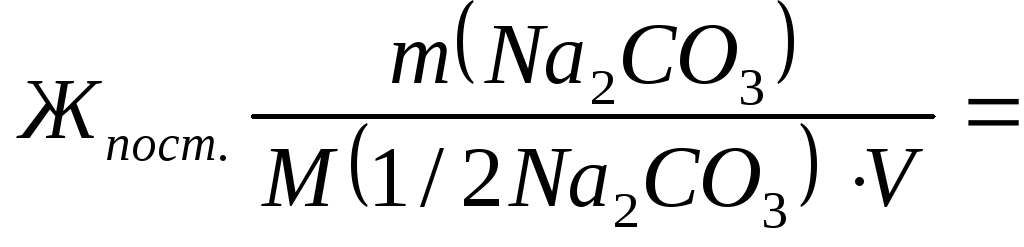 5300/(53∙50)
= 2 ммоль
экв./л
5300/(53∙50)
= 2 ммоль
экв./л
Общая жесткость воды равна:
Жобщ = Жвр + Жпост = 4 + 2 = 6 ммоль экв./л
8.4 Требования к уровню подготовки студентов
Знать понятия: общая, временная (карбонатная) и постоянная (некарбонатная) жесткость воды.
Понимать для чего необходимо умягчение воды.
Иметь представление о методах устранения временной и постоянной жесткости.
Уметь производить расчеты жесткости воды, а также количеств реактивов, необходимых для ее устранения.
8.5 Задания для самоконтроля
При определении карбонатной жесткости воды используют индикатор метиловый оранжевый. Почему нельзя использовать фенолфталеин?
Почему при кипячении воды ее временная (устранимая) жесткость уменьшается?
Почему комплексонометрическим методом определяют только общую жесткость?
Какие соли вызывают постоянную жесткость? Почему она так называется?
Что происходит при кипячении жесткой воды с гидроксидом натрия? Почему израсходованное количество NaOH эквивалентно суммарному количеству растворенных солей некарбонатного происхождения?
Что такое обратное титрование и как его осуществляют? Какие преимущества имеет этот метод?
Какой вид жесткости воды определяют при помощи титрования раствором кислоты? Какая реакция при этом происходит?
Какая характеристика раствора изменяется при кислотно-основном титровании? Какими методами можно фиксировать точку эквивалентности?
Благодаря каким свойствам трилон Б (комплексон III) можно использовать в качестве титранта при определении общей жесткости воды?
Для чего используется аммиачный буферный раствор при определении общей жесткости?
Почему при определении общей жесткости воды прибавление кристаллов эриохрома черного вызывает покраснение раствора, а в точке эквивалентности раствор синеет?
На титрование 100 мл воды пошло 2 мл 0,1н. раствора трилона Б. Рассчитайте жесткость воды.
Вода содержит в 10 л 0,95 г хлорида магния и 1,62 г гидрокарбоната кальция. Определить карбонатную, некарбонатную (постоянную) и общую жесткость этого образца воды.
Чему равна жесткость воды, выраженная в ммоль экв./л, если концентрация СаCl2 составляет 0,005 моль/л?
Растворимость СаSO4 в воде 0,202%. Вычислите жесткость насыщенного раствора этой соли, принимая его плотность за 1,0 г/мл.
Для умягчения 100 л воды потребовалось 12,72 г Na2CO3. Чему равна жесткость образца воды в ммоль экв./л?
На титрование 0,05 л образца воды израсходовано 4,8∙10-3 л 0,1н. раствора HCl. Чему равна карбонатная жесткость воды?
Какую массу гашеной извести надо прибавить к 2,5 л воды, чтобы устранить ее временную жесткость, равную 4,43 ммоль экв./л?
При определении временной жесткости на титрование 0,1 л воды израсходовано 5,25∙10-3 л 0,101н. раствора HCl. Какова величина жесткость этой воды?
Образец воды объемом 1 литр содержит 48,6 мг гидрокарбоната кальция и 29,6 мг сульфата магния. Какое количество Са2+ и Mg2+ содержится в литре этой воды? Чему равна общая, постоянная и карбонатная жесткость воды?
Некарбонатная жесткость воды равна 3,18 ммоль экв./л. Какую массу Na3РO4надо взять, чтобы умягчить 1м3 воды?
8.6 Список рекомендуемой литературы
8.6.1 Глинка Н.Л. Общая химия: Учебное пособие для вузов/ Под ред. А.И.Ермакова. – М.: Интеграл-Пресс, 2010. – 728 с.
8.6.2 Романцева Л.М. Сборник задач и упражнений по общей химии/ Л.М.Романцева, З.Л.Лещинская, В.А.Суханова. – М.: Высш. шк., 1991. – С.146 – 149.
ЖЁСТКОСТЬ ВОДЫ И МЕТОДЫ ЕЁ УСТРАНЕНИЯ — Мегаобучалка
14.1. Жёсткость воды
Жёсткость воды — совокупность химических и физических свойств воды, связанных с содержанием в ней растворённых солей металлов, главным образом, кальция Са2+ и магния Mg2+ (так называемых «солей жёсткости»). Различают временную (карбонатную) жёсткость, обусловленную гидрокарбонатами кальция и магния (Са(НСО3)2; Mg(НСО3)2), и постоянную (некарбонатную) жёсткость, вызванную присутствием других солей, не выделяющихся при кипячении воды: в основном, сульфатов и хлоридов Са и Mg (CaSO4, CaCl2, MgSO4, MgCl2).Общая жёсткость воды равна сумме временной (карбонатной) и постоянной (некарбонатной) жёсткости.
В системе СИ жёсткость измеряется в моль/м3. На практике пользуются градусами жёсткости, выражают жёсткость в миллиграммах эквивалентов на литр, а также в миллимоль эквивалентов на литр. 1°Ж соответствует концентрации щелочноземельного элемента, численно равной 1/2 его моля на литр (1°Ж = 1 мг-экв/л = 1/2 ммоль-экв/л). По величине общей жёсткости различают воду мягкую (до 2°Ж), средней жёсткости (2-10°Ж) и жёсткую (более 10°Ж).
В данном пособии за размерность жёсткости воды принят 1 мг-экв/л (часто эквивалент пропускают и выражают жёсткость воды в ммоль/л), который выражают суммой миллимоль (ммоль) эквивалентов ионов Са2+ и Mg2+содержащихся в 1 литре воды. Один миллимоль жёсткости отвечает содержанию 20,04 мг/л Са2+ и 12,16 мг/л Mg2+.
Жёсткость воды может быть рассчитана по формуле, представленной в общем виде:
, (1)
где Ж – жёсткость воды, ммоль-экв/л; mi – масса катионов (или соответствующих солей), мг; Мэк i – молярная масса эквивалентов катионов (или соответствующих им солей), мг/ммоль; V – объём воды, л.
1. Определение жёсткостиводы по массе содержащихся в ней солей.
Пример 1.Рассчитайте общую жёсткость воды (ммоль/л}, если в 0,20 л воды содержится 32,42 мг гидрокарбоната кальция Са(НСО3)2; 1,46 мг гидрокарбоната магния Mg(HCО3)2; 22,20 мг хлорида кальция CaCl2 и 4,75 мг хлорида магния MgCl2.
Решение. Общая жёсткость воды может быть рассчитана по формуле (1)
.
Массы солей и объём воды известны по условию задачи. Находим молярные массы эквивалентов солей. Молярная масса эквивалентов соли равна молярной массе соли, деленной на эквивалентное число Z. Для всех солей Z равно 2.
Поэтому:
Mэк Са(НСО3)2= М Са(НСО3)2/2 = 162,11/2 — 81,05 мг/ммоль;
Mэк Mg(HCO3)2 = M Mg(HCO3)2/2 = 146,34/2 = 73,17 мг/ммоль;
Mэк СаСl2 = М СаС12/2 = 110,99/2 = 55,49 мг/ммоль;
Mэк MgCl2 =M MgCl2/2 — 95,21/2 = 47,60 мг/ммоль.
Подставляя в формулу массы, молярные массы эквивалентов солей и объём воды, рассчитываем общую жёсткость воды:
=2,0 + 0,1 + 2,0 + 0,5 = 4,6 ммоль/л.
Пример 2. Вычислите временную жёсткость воды, зная, что в 500 л её содержится 162,1 г Са(НСО3)2.
Решение. Временную жёсткость воды можно найти по формуле (1), подставив в неё массу, молярную массу эквивалентов Са(НСО3) 2 и объём воды. Молярная масса эквивалентов Са(НСОз)2 равна 81,05 мг/ммоль (см. пример 1), масса этой соли равна 162100 мг, объем воды 500 л. Следовательно,
.
2. Определение содержания солей в воде по жёсткости воды
Пример 3. Сколько граммов СаСl2 содержится в 100 л воды, если жесткость воды, вызванная этой солью, равна 2,5 ммоль/л?
Решение. Массу соли СаСl2 можно найти по формуле (1). А именно:
.
Подставляя в формулу жёсткость воды, молярную массу эквивалентов CaCl2 (см. пример 1) и объем воды, получаем:
M CaCl2 = 2,5 · 55,49 · 100 = 13872,5мг или 13,8725 г.
3.Определение временной (карбонатной) жёсткости воды по объёму соляной кислоты, пошедшей на её титрование
Самым простым методом определения жёсткости воды является метод титрования. Для определения временной жёсткости воды используют стандартный раствор соляной кислоты. При этом происходит следующая реакция:
Ме(НСО3) 2 + 2 НС1 = МеС12 + 2 Н2О + 2СО2,
где Me – Са2+, Mg2+, Fe2+.
Согласно закону эквивалентов, количество эквивалентов всех участвующих в химической реакции веществ должно быть одинаково. Отсюда:
, (2)
где Сэк1 и V1 – соответственно молярная концентрация эквивалентов вещества(моль/л) и объём (л) первого раствора; Cэк2 и V2 – молярная концентрация эквивалентов вещества (моль/л) и объём (л) второго раствора.
Пример 4. Определите временную жёсткость воды, если на титрование 5 · 10–2 л воды, содержащей гидрокарбонат кальция, израсходовано 1,44 · 10–3 л 1,15н раствора HCl.
Решение. По условию задачи молярная концентрация эквивалентов Сa(HCO3)2 неизвестна. Обозначим её через х.Подставляя значения в формулу (2), получаем:
х · 5· 10–2 = 1,44 · 10–3 · 0,15.
Отсюда:
н.
Таким образом, молярная концентрация эквивалентов Сa(HCO3)2 равна 0,004н, что соответствует содержанию Сa(HCO3)2 0,004 моль/л или 4 ммоль/л. Следовательно, временная жёсткость воды составляет 4 ммоль/л.
Пример 5. Чему равна временная жесткость воды, если на титрование 100 мл этой воды, содержащей гидрокарбонат железа (II), израсходовано 5,75 мл 0,07 н раствора HCl.
Решение. Данная задача решается аналогично тому, как это показано в примере 5, предварительно переведя объёмы растворов в литры, т.е. V1 = 0,1 л H2O; V2 = 5,75 · 10–3 л HCl. Подставляя значения в формулу (2), получаем:
х · 0,1 = 5,75 · 10–3 · 0,07.
Отсюда:
н.
Молярной концентрации эквивалентов Fe(HCO3)2 соответствует содержание этой соли, равной 4 · 10–3 моль/л или 4 ммоль/л.
Следовательно, жёсткость воды 4 ммоль/л.
14.2. Методы умягчения воды
Для умягчения воды применяют методы осаждения и ионного обмена. Путем осаждения катионы Са2+ и Mg2+ переводят в малорастворимые соединения выпадающие в осадок. Это можно достичь кипячением или химическим путем – введением в воду, например, соды Nа2СО3, гашёной извести Са(ОН)2 и т.д. При кипячении устраняется только временная (карбонатная) жёсткость по реакции:
Сa(HCO3)2 CaCO3¯ + CO2 + H2O.
Mg(HCO3)2 Mg(OH)2¯ + CO2.
При разложении Mg(HCO3)2 образуется Mg(OH)2, а не MgCO3 так как
Метод химического умягчения основан на добавлении в воду кальцинированной соды Na2CO3 или гашёной извести Ca(OH)2. При этом соли кальция и магния переходят в нерастворимые соединения и, как следствие, выпадают в осадок. Например, добавление гашёной извести приводит к переводу солей кальция в нерастворимый карбонат:
Ca(HCO3)2 + Ca(OH)2 → 2CaCO3↓ + 2H2O
Лучшим реагентом для устранения общей жесткости воды является ортофосфат натрия Na3PO4:
3Ca(HCO3)2 + 2Na3PO4 → Ca3(PO4)2↓ + 6NaHCO3
3MgSO4 + 2Na3PO4 → Mg3(PO4)2↓ + 3Na2SO4
Ортофосфаты кальция и магния очень плохо растворимы в воде, поэтому легко отделяются механическим фильтрованием.
Метод ионного обмена основан на использовании ионообменной гранулированной смолы, которая поглощает катионы солей жёсткости (кальций и магний, железо и марганец). Взамен, в зависимости от ионной формы, смола отдаёт ионы натрия или водорода. Эти методы соответственно называются Na-катионирование и Н-катионирование.
4.Определение массы реагента, необходимого для устранения жёсткости воды.
Пример 6. Сколько граммов соды Nа2СО3 надо прибавить к 150 л воды, чтобы устранить жёсткость, равную 5 ммоль/л?
Решение. В 150 л воды содержится 150 · 5 = 750 ммоль/л солей, вызывающих жёсткость воды. По закону эквивалентов для устранения этой жёсткости необходимо добавить такое же количество вещества эквивалентов, умягчающих воду, т.е. 750 ммоль Na2CО3.
Для нахождения вещества в граммах количество вещества эквивалентов умножают на молярную массу эквивалентов этого вещества. В данном случае эквивалентное число Na2CO3 равно двум, и молярная масса эквивалентов Na2CО3 будет
МэкNа2СО3 = М Nа2СО3/2 = 106/2 = 53 мг/ммоль.
Находим массу Na2CO3:
m Na2CO3 = nэк Na2CO3 Мэк Na2CO3 = 750 · 53 = 39750 мг или 39,75 г.
Эту же задачу можно решить, используя формулу (1). Для этого необходимо помнить, что по закону эквивалентов массы реагирующих веществ пропорциональны их молярным массам эквивалентов. Поэтому в формулу (1) вместо молярной массы эквивалентов солей, вызывающих жёсткость, можно подставить молярную массу эквивалентов веществ, необходимых для устранения этой жёсткости, чтобы найти их массу. В данном случае:
m Na2CO3 = Ж · МэкNa2СО3 · V.
Подставляя значения Ж, МэкNa2CO3 и V, получаем:
m Na2CO3 = 5 ·53 · 150 = 39750 мг или 39,75 г.
КОНТРОЛЬНЫЕ ЗАДАНИЯ
261. Что понимается под жёсткостью воды? В чём измеряется жёсткость воды? Вода объемом 1 л содержит 38,0 мг гидрокарбоната кальция и 19,6 мг сульфата магния. Чему равна общая жёсткость воды? К какой группе жёсткости относится такая вода?
Ответ: 0,8 ммоль/л.
262. Почему необходимо устранять избыточную жёсткость воды? Чем опасна такая вода? Приведите примеры. Чему равна жёсткость воды, содержащая 0,01 моль/л хлорида кальция? К какой группе жёсткости относится такая вода?
Ответ: 20 ммоль/л.
263. Чем обусловлена постоянная жёсткость воды? Какие существуют химические способы устранения постоянной жёсткости воды? Напишите уравнения соответствующих реакций. Чему равна постоянная жесткость воды, если в 2,5 л ее содержится 40 мг сульфата кальция? К какой группе жёсткости относится такая вода?
Ответ: 0,23 ммоль/л.
264. Из чего складывается общая жёсткость воды? Ответ поясните. Чему равна общая жёсткость воды, если в 3,4 л ее находится 57 мг гидрокарбоната магния и 33 мг сульфата кальция? К какой группе жёсткости относится такая вода?
Ответ: 0,37 ммоль/л.
265. Чем обусловлена временная жёсткость воды? Какими методами можно устранить избыточную временную жёсткость воды? Напишите необходимые уравнения химических реакций. При кипячении 0,25 л воды, содержащей только гидрокарбонат кальция, в осадок выпадает 4мг карбоната кальция. Чему равна временная жёсткость воды? К какой группе жёсткости относится такая вода?
Ответ: 0,32 ммоль/л.
266. Чем обусловлена постоянная жёсткость воды? Какие существуют химические способы устранения постоянной жёсткости воды? Напишите уравнения соответствующих реакций. Сколько граммов сульфата магния содержится в 150 л воды, если жёсткость воды, вызванная этой солью равна 4,7 ммоль/л? К какой группе жёсткости относится такая вода?
Ответ: 42,441 г.
267. Чем обусловлена временная жёсткость воды? Какими методами можно устранить избыточную временную жёсткость воды? Напишите необходимые уравнения химических реакций. При кипячении 0,5 л воды, содержащей только гидрокарбонат железа (II). В осадок выпадает 8 мг карбоната железа (II). Чему равна временная жёсткость воды? К какой группе жёсткости относится такая вода?
Ответ: 0,28 ммоль/л.
268. Что такое титрование? На каком законе основан метод титрования? Дайте формулировку этого закона. На титрование 25 мг воды израсходовано 2,4 мл 0,1н раствора НС1. Чему равна карбонатная жёсткость воды? К какой группе жёсткости относится такая вода? К какой группе жёсткости относится такая вода?
Ответ: 9,6 ммоль/л.
269. Из чего складывается общая жёсткость воды? Ответ поясните. Какими методами можно устранить избыточную общую жёсткость воды? Напишите соответствующие уравнения реакций. Для умягчения 200 л воды потребовалось 12,72 г карбоната натрия. Чему равна жёсткость воды? К какой группе жёсткости относится такая вода?
Ответ: 1,2ммоль/л.
270. Чем обусловлена временная жёсткость воды? Какими методами можно устранить избыточную временную жёсткость воды? Напишите необходимые уравнения химических реакций. Временная жёсткость воды равна 6,64 ммоль/л. Какую массу гидроксида кальция необходимо взять, чтобы устранить жёсткость 10 л воды.
Ответ: 2,459г.
271. Какие химические методы существуют для устранения избыточной жёсткости воды? Напишите соответствующие уравнения реакций, протекающих при умягчении воды. Сколько граммов ортофосфата натрия надо прибавить к 250 л воды, чтобы устранить ее карбонатную жёсткость, равную 2,5 ммоль/л? К какой группе жёсткости относится такая вода?
Ответ: 34,162 г.
272. Что такое титрование? На каком законе основан метод титрования? Дайте формулировку этого закона. На титрование 40 мл воды израсходовано 5,7 мл 0,12н. раствора НС1. Чему равна карбонатная жёсткость воды? К какой группе жёсткости относится такая вода?
Ответ: 20 ммоль/л.
273. Чем обусловлена постоянная жёсткость воды? Какие существуют химические способы устранения постоянной жёсткости воды? Напишите уравнения соответствующих реакций. В 500 л воды содержится 70 г сульфата кальция. Чему равна постоянная жёсткость этой воды? К какой группе жёсткости относится такая вода?
Ответ: 2,1 ммоль/л.
274. Из чего складывается общая жёсткость воды? Ответ поясните. Какими методами можно устранить избыточную общую жёсткость воды? Напишите соответствующие уравнения реакций. Чему равна общая жёсткость воды, если в 300 л ее содержится 32,85 г гидрокарбоната кальция и 30,6 г сульфата магния? К какой группе жёсткости относится такая вода?
Ответ: 3,1 ммоль/л.
275. Чем обусловлена временная жёсткость воды? Какими методами можно устранить избыточную временную жёсткость воды? Напишите необходимые уравнения химических реакций. Вода, содержащая только гидрокарбонат кальция, имеет жёсткость 4,2 ммоль/л. К какой группе жёсткости относится такая вода? Сколько граммов гидрокарбоната кальция содержится в 250 л воды?
Ответ: 85,102 г.
276. Почему необходимо устранять избыточную жёсткость воды? Чем опасна такая вода? Приведите примеры. К 280 л жесткой воды прибавили 62,5 г карбоната натрия. Напишите уравнения возможных при этом реакций. Рассчитайте на сколько ммоль/л понизилась жесткость воды?
Ответ: 4 ммоль/л.
277. Чем обусловлена временная жёсткость воды? Какими методами можно устранить избыточную временную жёсткость воды? Напишите необходимые уравнения химических реакций. Вода, содержащая только гидрокарбонат магния, имеет жёсткость 7,8 ммоль/л. К какой группе жёсткости относится такая вода? Какая масса гидрокарбоната магния содержится в 350 л воды?
Ответ: 221,266 г.
278. Что понимается под жёсткостью воды? В чём измеряется жёсткость воды? Какую массу гидроксида кальция надо прибавить к 150 л воды, чтобы устранить временную жёсткость воды, равную 2,5 ммоль/л? К какой группе жёсткости относится такая вода?
Ответ: 13,89 г.
279. Что такое титрование? На каком законе основан метод титрования? Дайте формулировку этого закона. На титрование 40 мл воды потребовалось 3,85 мл 0,15 к раствора НС1. Чему равна карбонатная жёсткость воды? К какой группе жёсткости относится такая вода?
Ответ: 14,4 ммоль/л.
280. Чем обусловлена постоянная жёсткость воды? Какие существуют химические способы устранения постоянной жёсткости воды? Напишите уравнения соответствующих реакций. Чему равна жёсткость воды, в 10 л которой содержится 0,025 моль сульфата магния? К какой группе жёсткости относится такая вода?
Ответ: 5 ммоль/л.
Тема 11. Жесткость воды
Присутствие в воде ионов Ca2+ иMg2+ обусловливает так называемую жесткость воды. Различают временную и постоянную жесткость.
Временная (карбонатная) жесткость обусловлена присутствием в воде только гидрокарбонатов кальцияCa(HCO3)2и магнияMg(HCO3)2. Временную жесткость можно устранить, если воду подвергнуть кипячению.
Постоянная (некарбонатная)жесткость обусловлена присутствием в воде сульфатов и хлоридов кальция и магния:CaSO4,MgSO4,CaCl2,MgCl2.
Временная и постоянная жесткости вместе составляют общую жесткость.
Классификация воды по уровню жесткости
Класс воды | Общая жесткость, ммоль/л |
Очень мягкая | до 1,5 |
Мягкая | 1,5 – 3,0 |
Умеренно жесткая | 3 – 6 |
Жесткая | 6 – 9 |
Очень жесткая | более 9 |
Жесткость выражается количеством миллимолей эквивалентов ионов кальция, магния или их солей в одном литре воды. Расчет жесткости можно произвести по следующей формуле:

где Ж – жесткость воды, ммоль/л; m– масса ионов кальция или магния (или их солей), г;MЭ – эквивалентная масса кальция или магния (или их солей), г/моль;V– объем воды, л.
По указанной формуле жесткость рассчитывается отдельно по кальцию и магнию, а затем суммируется.
Пример 1.
Вычислить жесткость воды, зная, что в 1500 л ее содержится 607,5 г Ca(HCO3)2.
Решение.
Эквивалентная масса Ca(HCO3)2равна 81 г/моль. Рассчитываем жесткость воды по формуле
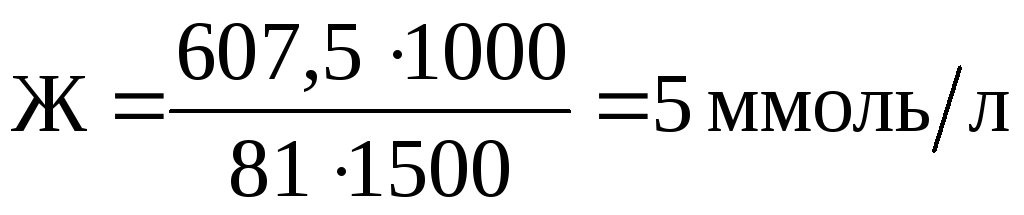 .
.
Класс воды – умеренно жесткая.
Пример 2.
Сколько граммов СaSO4содержится в 2 м3 воды, если жесткость, обусловленная присутствием этой соли, равна 4 ммоль/л?
Решение.
Эквивалентная масса CaSO4равна 136,14/2 = 68,07 г/моль.
Выражаем массу соли через формулу определения жесткости:

подставляя значения,
получаем: 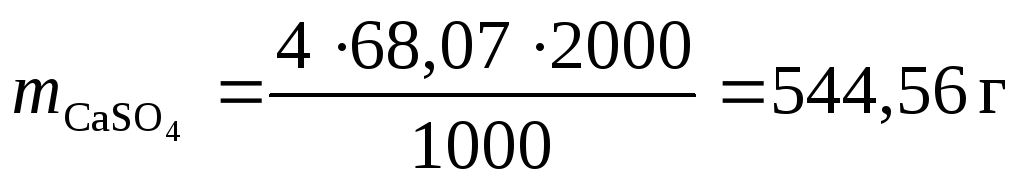 .
.
Пример 3.
Сколько граммов соды надо прибавить к 750 л воды, чтобы устранить ее жесткость, равную 6 ммоль/л?
Решение.
В 750 л воды содержится 750 6 = 4500 ммоль/л солей, обусловливающих жесткость воды. Эквивалентная масса соды Na2CO3 – 53 г/моль. Для устранения жесткости следует прибавить: 4500 53 10–3 = 238,5 г соды.
Пример 4.
Вычислить карбонатную жесткость воды, зная, что на титрование 100см3 этой воды, содержащей гидрокарбонат кальция, потребовалось 6,25 см30,08 н. раствораHCl.
Решение.
Вычисляем количество миллимолей соляной кислоты, пошедшей на титрование: 6,25 0,08 = 0,5 ммоль.
Такое же количество гидрокарбоната будет содержаться в 100 см3 воды.
В литре воды будет
присутствовать 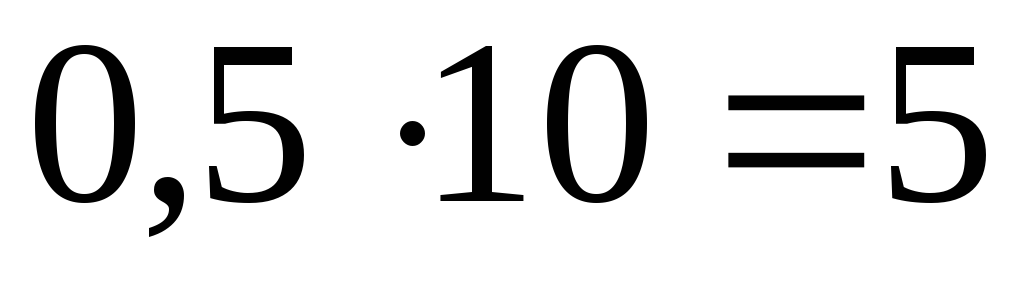 ммоль/л
гидрокарбоната кальция.
ммоль/л
гидрокарбоната кальция.
Следовательно, карбонатная жесткость воды равна 5 ммоль/л.
Контрольные вопросы и задачи
201. | Cколько граммов карбоната натрия надо прибавить к 400 л воды, чтобы устранить жесткость, равную 3 ммоль/л? |
202. | Вода, содержащая только сульфат магния, имеет жесткость 7 мэкв. Сколько граммов сульфата магния содержится в 300 л этой воды? |
203. | Вычислите жесткость воды, зная, что в 600 л ее содержится 65,7 г гидрокарбоната магния и 61,2 г сульфата кальция. |
204. | Жесткость воды, в которой растворен только гидрокарбонат кальция, равна 4 ммоль/л. Сколько 0,1 н. раствора НСl потребуется для реакции с гидрокарбонатом кальция, содержащимся в 75 см3 этой воды? |
205. | В 1 м3 воды содержится 140 г сульфата магния. Вычислите жесткость этой воды. |
206. | Вода, содержащая только гидрокарбонат магния, имеет жесткость 3,5 ммоль/л. Сколько граммов гидрокарбоната магния содержится в 200 л этой воды? |
207. | К 1 м3 жесткой воды прибавили 132,5 г карбоната натрия. На сколько миллимоль на литр понизилась жесткость? |
208. | Чему равна жесткость воды, если для ее устранения к 50 л воды потребовалось прибавить 21,2 г карбоната натрия? |
209. | Сколько граммов CaSO4 содержится в 200 л воды, если жесткость, обусловливаемая этой солью, равна 8 ммоль/л? |
210. | Сколько граммов карбоната натрия надо прибавить к 0,1 м3 воды, чтобы устранить жесткость, равную 4 ммоль/л? |
211. | К 100 л жесткой воды прибавили 12,95 г гидроксида кальция. На сколько миллимоль на литр понизилась карбонатная жесткость? |
212. | Чему равна карбонатная жесткость воды, если в 1 л ее содержится 0,292 г гидрокарбоната магния и 0,2025 г гидрокарбоната кальция? |
213. | Сколько граммов гидроксида кальция надо прибавить к 275 л воды, чтобы устранить ее карбонатную жесткость, равную 5,5 ммоль/л? |
214. | Скольким миллимолям — эквивалентам равняется жесткость воды, если для устранения ее к 100 л воды потребовалось прибавить 15,9 г соды? |
215. | Сколько граммов гашеной извести надо прибавить к 1000 л воды, чтобы устранить ее временную жесткость, равную 2,86 ммоль/л? |
216. | Вычислите временную жесткость воды, зная, что на реакцию с гидрокарбонатом, содержащимся в 100 мл этой воды, израсходовано 5 миллилитров 0,1 н. раствора соляной кислоты. |
217. | Жесткость воды, содержащей только гидрокарбонат кальция, равна 1,785 ммоль/л. Определите количество гидрокарбоната в литре этой воды. |
218. | Какова временная жесткость воды, в литре которой содержится 0,146 г гидрокарбоната магния? |
219. | Вычислите постоянную жесткость воды, зная, что для удаления ионов кальция, содержащихся в 50 л этой воды, потребовалось прибавить к воде 10,8 г безводной буры. |
220. | Путем анализа было установлено, что в одном литре исследуемой воды содержится 42 мг ионов магния и 112 мг ионов кальция. Вычислите общую жесткость воды. |
Лабораторки по химии / 15
82
8 Лабораторная работа №16
Жесткость воды, методы ее определения
Цель работы: познакомиться с понятием жесткости воды; овладеть методиками определения общей, временной (карбонатной) и постоянной (некарбонатной) жесткости воды методами потенциометрического и кислотно-основного титрования.
Оборудование и реактивы: 0,1н. соляная кислота; 0,1н. раствор трилона Б; индикаторы: эриохром черный кристаллический, фенолфталеин, метиловый оранжевый; аммиачный буфер; рН-метр; магнитная мешалка; бюретки; пипетки на 100 мл или мерные цилиндры; колбы на 250 мл и 500 мл; стаканы на 200 – 250 мл; мерные колбы на 200 мл; бумажные фильтры.
8.1 Теоретические пояснения
Природная вода в своем составе всегда содержит различные примеси: соли и газы, механические примеси, находящиеся во взвешенном состоянии, эмульсии, гидрозоли и другие образования. Некоторые соли, присутствующие в воде, вызывают ее жесткость.
Жесткость воды – это совокупность свойств воды, обусловленных присутствием в ней катионов Ca2+ и Mg2+, реже Fe2+.
Содержание в воде большого количества примесей растворимых солей кальция и магния делает ее непригодной для технических целей. Повышенная жесткость воды приводит к образованию накипи в паровых котлах и бытовой посуде. Это ухудшает теплообмен, а, следовательно, приводит к перерасходу топлива, электроэнергии, перегреву металлических поверхностей.
В жесткой воде ухудшается пенообразование и увеличивается расход мыла при стирке, так как часть содержащихся в нем растворимых солей жирных кислот переходит в нерастворимое состояние:
2C17H35COONa + CaSO4 = (C17H35COO)2Ca + Na2SO4.
При этом также ухудшается качество тканей вследствие осаждения на них нерастворимых кальциевых и магниевых солей высших жирных кислот.
В воде с повышенной жесткостью плохо развариваются овощи и мясо, так как катионы кальция образуют с белками нерастворимые соединения. Большая магниевая жесткость придает воде горький вкус.
Суммарное содержание Ca2+ и Mg2+ в воде называется общей жесткостью. Жесткость воды оценивается по-разному. В нашей стране ее чаще всего выражают количеством вещества эквивалентов кальция и магния (в ммоль) в одном литре воды.
Жесткость воды хозяйственно-питьевых водопроводов не должна превышать 7 ммоль экв./л. По величине жесткости воду условно подразделяют на мягкую (до 4 ммоль экв./л), средней жесткости (4 – 8 ммоль экв./л), жесткую (8 – 12 ммоль экв./л) и очень жесткую (более 12 ммоль экв./л).
Общая жесткость складывается из карбонатной (временной) и некарбонатной (постоянной). Карбонатная жесткость обусловлена присутствием в воде гидрокарбонатов кальция, магния, а иногда также и гидрокарбоната железа (II). Этот вид жесткости можно устранить кипячением:
Ca(HCO3)2 CaCO3 + H2O + CO2
CaCO3 + H2O + CO2
Mg(HCO3)2 MgCO3 + H2O
+ CO2;
MgCO3 + H2O
+ CO2;
2MgCO3 + H2O (MgOH)2CO3 + CO2
(MgOH)2CO3 + CO2
(MgOH)2CO3+H2O 2Mg(OH)2 +CO2
2Mg(OH)2 +CO2
Fe(HCO3)2 Fe(OH)2 + 2CO2;
Fe(OH)2 + 2CO2;
4Fe(OH)2 + O2 + 2 H2O 4Fe(OH)3.
При кипячении воды растворенные в ней гидрокарбонаты разлагаются, и карбонатная жесткость сильно снижается, однако полного устранения карбонатной жесткости не происходит вследствие того, что карбонаты кальция и магния несколько растворим в воде.
Наряду с понятием карбонатная жесткость, используется термин устранимая жесткость. Это та величина, на которую понижается жесткость при десятиминутном кипячении воды. Жесткость, оставшаяся после кипячения воды, называется постоянной жесткостью.
Для уменьшения карбонатной жесткости применяют также метод известкования:
Ca(HCO3)2 + Ca(OH)2 2CaCO3 + 2H2O
Mg(HCO3)2 + 2Ca(OH)2 Mg(OH)2 + 2CaCO3 + 2H2O.
Некарбонатная жесткость обусловлена присутствием в воде растворимых, устойчивых к нагреванию солей кальция и магния. Чаще всего это сульфаты и хлориды.
Некарбонатную жесткость можно устранить обработкой воды карбонатом или фосфатом натрия:
MeSO4 + Na2CO3 MeCO3 + Na2SO4.
Для устранения жесткости применяют также катиониты. Это ионообменные смолы и алюмосиликаты, содержащие в своем составе подвижные катионы, например, Na+, H+, способные обмениваться на катионы среды. Если пропускать воду через слои катионита, то его подвижные катионы будут обмениваться на катионы кальция и магния, при этом катионы жесткости остаются в катионите, а подвижные ионы катионита переходят в раствор. При помощи Н+-катионирования умягчают воду с преобладанием карбонатной жесткости, а при помощи Na+-катионирования – с преобладанием некарбонатной жесткости.
Для умягчения воды можно также использовать и физические методы: электродиализ, ультразвуковую, магнитную и магнитно-ионизационную обработку воды.
Жесткость воды определяется аналитически.
Карбонатную (устранимую или временную) жесткость воды определяют титрованием воды соляной кислотой:
Са(НСО3)2 + 2НС1 = CaCI2 + 2H2O + 2СO2
Mg(HCO3)2 + 2НС1 = MgCl2 + 2Н2О + 2СО2
Точку эквивалентности можно определить либо потенциометрическим титрованием с помощью рН-метра (определение объема раствора соляной кислоты в точке скачка рН), либо титрованием в присутствии кислотно-основных индикаторов (чаще всего метилового оранжевого).
Для выбора соответствующего кислотно-основного индикатора необходимо построить интегральную кривую титрования на основании данных потенциометрического титрования, а затем выбрать такой индикатор, интервал перехода окраски которого попадает в область скачка рН на кривой титрования. В таблице 8.1 приводятся интервалы перехода окраски для некоторых индикаторов.
Таблица 8.1 – Характеристики наиболее часто применяемых кислотно-основных индикаторов
№ | Индикатор | Интервал перехода окраски, единицы рН | Изменение окраски раствора при возрастании рН |
1 | О-крезоловый синий | 0,2 — 1,9 | красная ® желтая |
2 | Тимоловый синий | 1,2 – 2,8 | красная ® желтая |
3 | Метиловый оранжевый | 3,1 – 4,4 | красная ® оранжевая |
4 | Бромкрезоловый зеленый | 3,8 – 5,4 | желтая ® синяя |
5 | Бромметиловый зеленый | 5,0 – 8,0 | желтая ® синяя |
6 | Лакмус | 6,0 –8,0 | красна ® синяя |
7 | Бромтимоловый синий | 6,0 – 7,6 | желтая ® синяя |
8 | Феноловый красный | 6,8 – 8,4 | желтая ® красная |
9 | Фенолфталеин | 8,2 – 10 | бесцветная ® малиновая |
10 | Ализариновый желтый | 10,0 – 12,0 | бледно-лимонная ® желтая |
Некарбонатную (постоянную) жесткость воды определяют методом обратного титрования. К отмеренному объему исследуемой воды добавляют определенный объем раствора карбоната натрия известной концентрации и выпаривают раствор досуха. При этом образуются нерастворимые в воде карбонаты кальция и магния.
Са2+ + Mg2+ + 2Na2CO3 = CaCO3 + MgCO3 + 2Na+
Сухой остаток, представляющий из себя смесь карбонатов кальция, магния, натрия и других солей натрия, растворяют в не содержащей СО2 воде, отфильтровывают нерастворимые в воде карбонаты кальция и магния и титриметрическим способом определяют в растворе количество избыточного Na2CO3, не вошедшего в реакцию осаждения карбонатов. Специальными опытами показано, что при этом Na2CO3 не реагирует с гидрокарбонатами кальция и магния. Именно поэтому, рассмотренный метод позволяет определять постоянную жесткость воды.
Современным методом определения общей жесткости воды является титрование воды раствором трилона Б в присутствии специальных индикаторов-хромогенов, чаще всего эриохрома черного. Титрование проводится в аммиачной среде при значении рН раствора в пределах 9-10.
Трилон Б (комплексон III) – это динатриевая соль этилендиамминтетрауксусной кислоты (NaO2CCH2)2N(CH2)2N(CH2CO2H)2, сокращенно – Na2H2ЭДТА.
Na2H2ЭДТА + Са2+ (или Mg2+) ® Na2CaЭДТА + 2H+.
Хромоген образует с ионами магния и другими ионами относительно непрочные комплексные соединения, окрашенные в красно-фиолетовый цвет. При титровании трилоном Б содержащиеся в воде ионы Са2+ и Mg2+, а также ионы Cu2+, Zn2+, Mn2+, Cd2+, Ni2+, Al3+, Fе2+, Fe3+ реагируют с ним и образуют мало диссоциированные бесцветные прочные комплексные соединения. В конце титрования ионы магния, кальция и другие переходят от комплексного соединения с хромогеном к трилону Б, с образованием прочных бесцветных комплексов.
Поэтому в точке эквивалентности красно-фиолетовая окраска раствора исчезает. Однако раствор не обесцвечивается, а окрашивается в сине-фиолетовый цвет – цвет самого хромогена эриохрома черного при рН = 9-10 (аммиачный буфер). Это указывает на окончание титрования.
Так как трилон Б образует прочные комплексы со всеми катионами кальция и магния вне зависимости от характера аниона, то комплексонометрическим методом определяют именно общую жесткость воды.
Проба воды должна характеризовать действительный ее состав, поэтому при отборе пробы из водопровода воду спускают в течение 10-15 минут. Когда склянка наполнится, воду некоторое время переливают через край.
Из рек и ручьев отбирают пробы воды на глубине 0,75 м в нескольких местах, около берегов и в середине реки. Отдельные пробы смешивают вместе. Анализ воды проводят сразу же после взятия пробы или, в крайнем случае, при соответствующем хранении спустя несколько часов.
8.2 Методика проведения опытов
8.2.1 Опыт №1. Определение карбонатной жесткости воды
Мерным цилиндром отбирают в две конические колбы по 100 мл исследуемой воды из-под крана. Оттитровывают воду в первой колбе 0,1н. раствором НСl. Для этого с помощью рН-метра фиксируют значения рН воды после каждого прибавления очередной порции HCl из бюретки. Объем каждой порции HCl составляет 0,5 мл.
По полученным значениям рН и объема прилитой кислоты строят интегральную и дифференциальную кривые титрования. Из кривых титрования определяют точку эквивалентности. Пользуясь данными таблицы 8.1 выбирают индикатор для экспресс-анализа. Интервал перехода окраски выбранного индикатора должен находиться в пределах скачка рН на интегральной кривой титрования.
Карбонатную жесткость воды Жкарб., выраженную в ммоль экв./л, определяют по формуле (8.1):
 , (8.1)
, (8.1)
где V(HCl) – объем раствора 0,1н. НСl, израсходованного до достижения точки эквивалентности, мл;
С(HCl) – концентрация раствора HCl, моль экв./л;
V(Н2О) – объем исследуемой воды, мл;
1000 – коэффициент пересчета от моль к ммоль.
Затем проводят титрование воды во второй колбе 0,1н. раствором НСl. Только на этот раз за ходом титрования следят визуально, по изменению окраски выбранного индикатора. Вблизи точки эквивалентности последняя капля титранта вызывает резкое изменение окраски раствора, содержащего индикатор. Фиксируют объем прибавленной кислоты к моменту достижения точки эквивалентности. Проводят расчет карбонатной жесткости воды по формуле (8.1)
8.2.2 Опыт №2. Определение общей жесткости воды
В коническую колбу отмеряют пипеткой 100 – 150 мл исследуемой воды, добавляют 5 мл аммиачного буфера и несколько кристаллов эриохрома черного до образования заметной вишнево-красной окраски. При слабой окраске раствора проверяют его рН универсальной индикаторной бумагой. Значение рН должно находиться в интервале 8-11. При необходимости корректируют рН добавлением в раствор буферной смеси.
Раствор оттитровывают стандартным раствором трилона Б до точки резкого перехода вишнево-красной окраски в синюю. Окраска раствора от избытка трилона Б остается неизменной, поэтому в конце титрования рабочий раствор трилона Б прибавляют осторожно, по каплям, энергично перемешивая.
Титрование повторить два раза и взять среднее значение объема израсходованного раствора трилона Б.
Общую жесткость воды Жобщ., выраженную в ммоль экв./л, определяют по формуле (8.2):
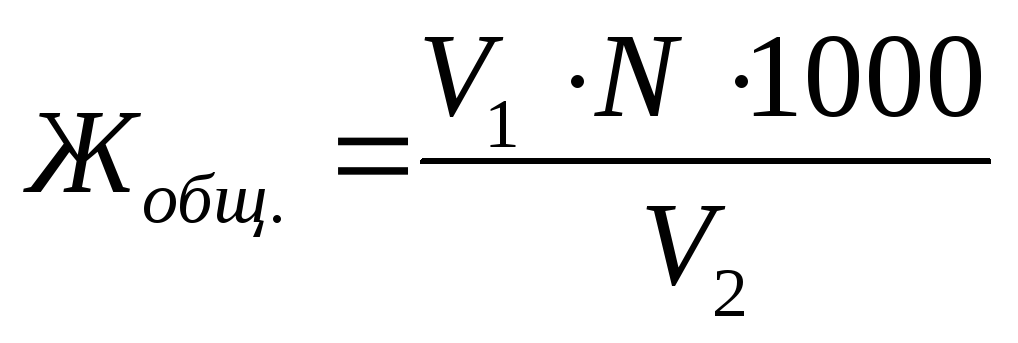 , (8.2)
, (8.2)
где V1 – объем рабочего раствора трилона Б, израсходованного на титрование пробы воды, мл;
N – молярная концентрация эквивалента рабочего раствора трилона Б, моль экв./л;
V2 – объем исследуемой воды, мл;
1000 – коэффициент пересчета от моль к ммоль.
По разности значений общей и карбонатной жёсткости определить постоянную жесткость. Сделать вывод о характере и степени жесткости исследуемой воды.
8.3 Примеры решения задач
Пример 1
Рассчитайте общую жесткость воды (ммоль экв./л), если в 0,15 л воды содержится 16,2 мг гидрокарбоната кальция, 2,92 мг гидрокарбоната магния, 11,10 мг хлорида кальция и 9,50 мг хлорида магния.
Решение
Выразим общую жесткость воды как сумму миллимолярных концентраций эквивалентов двухзарядных катионов металлов (или соответствующих им солей) в воде:
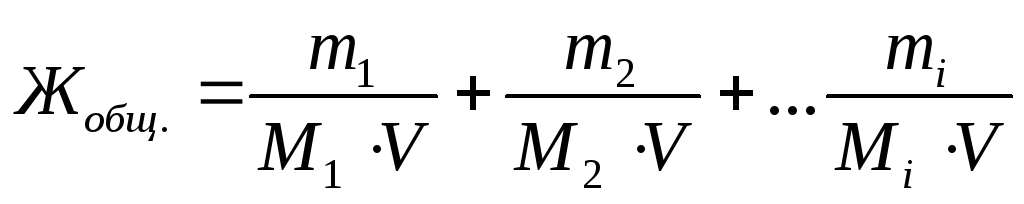 ,
,
где m1, m2, mi – массы двухзарядных катионов металлов, либо массы соответствующих им солей, либо массы веществ, пошедших на устранение жесткости воды, мг;
M1, M2, Mi – молярные массы эквивалентов двухзарядных катионовметаллов, либо массы соответствующих им солей, либо массы веществ, пошедших на устранение жесткости воды, г/моль;
V – объем воды, л.
Молярные массы эквивалентов солей, перечисленных в условии задачи, рассчитываются по формуле:
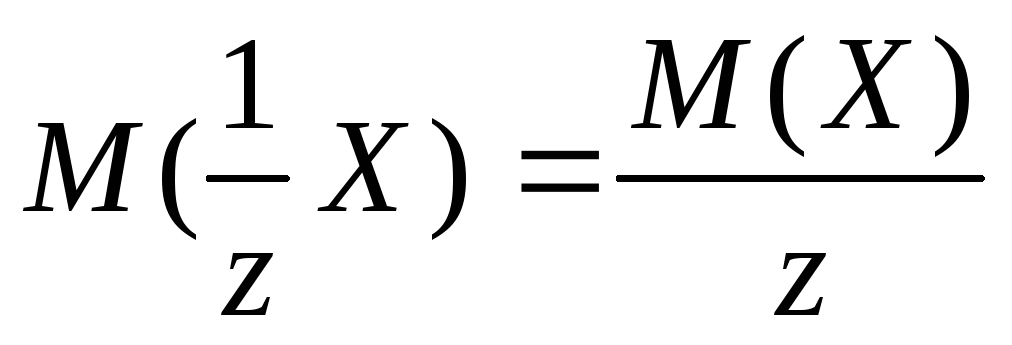 ,
,
где z – эквивалентное число, для солей жесткости оно равно 2;
 – молярная масса
соли Х.
– молярная масса
соли Х.
Формула соли | Са(HCО3)2 | Mg(HCО3)2 | СаCl2 | MgCl2 |
| 81 | 73 | 55.5 | 48 |
Общая жесткость данного образца воды равна сумме временной и постоянной жесткости:
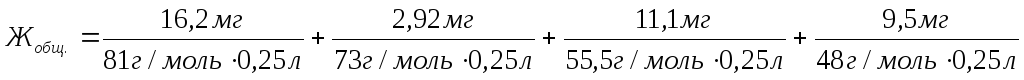 =
=
=2,56 ммоль экв./л
Пример 2
Определите временную жесткость воды, если на титрование 0,1 л воды, содержащей гидрокарбонат магния, израсходовано 7,2∙10-3л 0,14н. раствора HCl.
Решение
При титровании воды соляной кислотой происходит реакция:
Mg(HCO3)2 + 2НС1 = MgCl2 + 2Н2О + 2СО2
Временную жесткость воды рассчитаем по формуле (8.1):
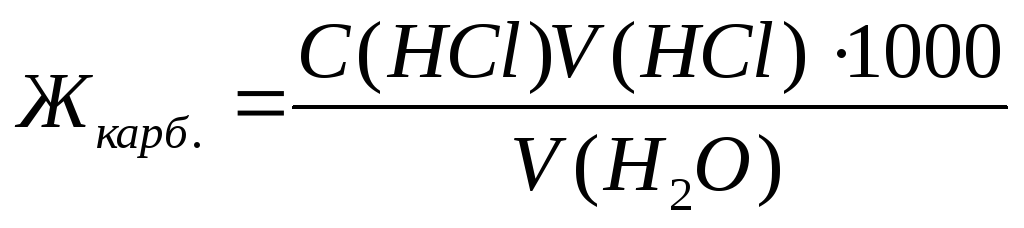
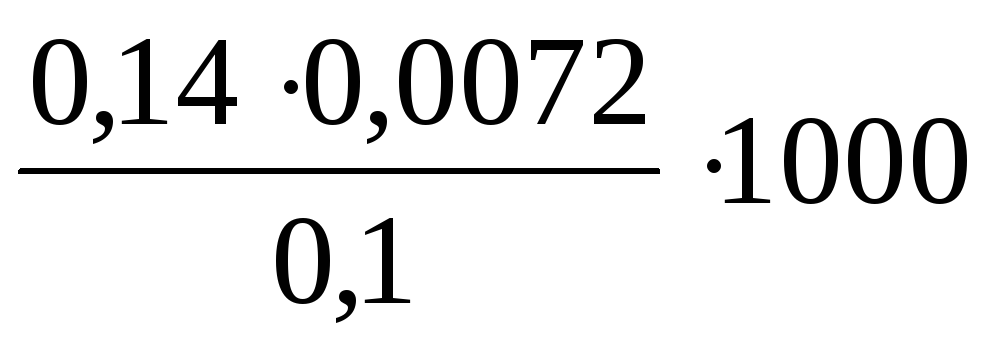 =10,08 ммоль
экв./л
=10,08 ммоль
экв./л
Пример 3
Для устранения общей жесткости по известково-содовому методу добавлено 7,4 г Са(ОН)2 и 5,3 г Na2CO3. Рассчитать временную и постоянную жесткость воды.
Решение
Добавление к воде Са(ОН)2 может устранить временную жесткость, а добавление Na2CO3 – постоянную жесткость. При добавлении этих реагентов к воде происходят следующие реакции:
Ca(HCO3)2 + Ca(OH)2 2CaCO3 + 2H2O
Mg(HCO3)2 + 2Ca(OH)2 Mg(OH)2 + 2CaCO3 + 2H2O.
Ca(NО3)2 + Na2CO3 = MeCO3 + 2NaNO3
Mg(NО3)2 + Na2CO3 = MeCO3 + 2NaNO3
Временную жесткость воды Жвр измеряют количеством вещества эквивалентов гидроксида кальция, участвующего в реакции, а постоянную жесткость Жпост– количеством вещества эквивалентов карбоната натрия.
M(1/2Са(ОН)2) = 74/2=37 г/моль;
M(1/2Na2CO3) = 106/2=53 г/моль;
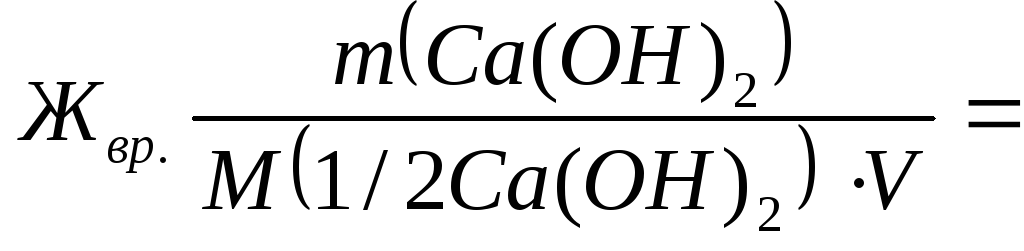 7400/(37∙50) = 4 ммоль
экв./л;
7400/(37∙50) = 4 ммоль
экв./л;
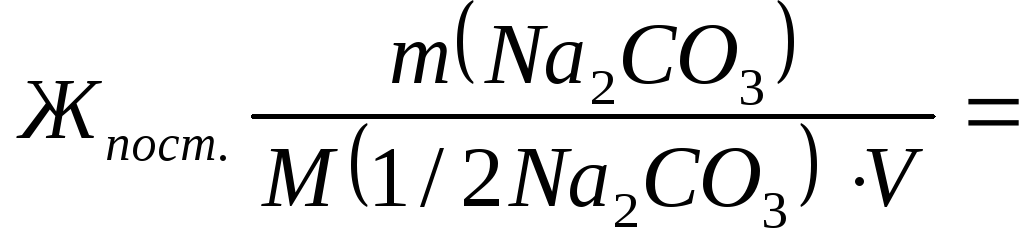 5300/(53∙50)
= 2 ммоль
экв./л
5300/(53∙50)
= 2 ммоль
экв./л
Общая жесткость воды равна:
Жобщ = Жвр + Жпост = 4 + 2 = 6 ммоль экв./л
8.4 Требования к уровню подготовки студентов
Знать понятия: общая, временная (карбонатная) и постоянная (некарбонатная) жесткость воды.
Понимать для чего необходимо умягчение воды.
Иметь представление о методах устранения временной и постоянной жесткости.
Уметь производить расчеты жесткости воды, а также количеств реактивов, необходимых для ее устранения.
8.5 Задания для самоконтроля
При определении карбонатной жесткости воды используют индикатор метиловый оранжевый. Почему нельзя использовать фенолфталеин?
Почему при кипячении воды ее временная (устранимая) жесткость уменьшается?
Почему комплексонометрическим методом определяют только общую жесткость?
Какие соли вызывают постоянную жесткость? Почему она так называется?
Что происходит при кипячении жесткой воды с гидроксидом натрия? Почему израсходованное количество NaOH эквивалентно суммарному количеству растворенных солей некарбонатного происхождения?
Что такое обратное титрование и как его осуществляют? Какие преимущества имеет этот метод?
Какой вид жесткости воды определяют при помощи титрования раствором кислоты? Какая реакция при этом происходит?
Какая характеристика раствора изменяется при кислотно-основном титровании? Какими методами можно фиксировать точку эквивалентности?
Благодаря каким свойствам трилон Б (комплексон III) можно использовать в качестве титранта при определении общей жесткости воды?
Для чего используется аммиачный буферный раствор при определении общей жесткости?
Почему при определении общей жесткости воды прибавление кристаллов эриохрома черного вызывает покраснение раствора, а в точке эквивалентности раствор синеет?
На титрование 100 мл воды пошло 2 мл 0,1н. раствора трилона Б. Рассчитайте жесткость воды.
Вода содержит в 10 л 0,95 г хлорида магния и 1,62 г гидрокарбоната кальция. Определить карбонатную, некарбонатную (постоянную) и общую жесткость этого образца воды.
Чему равна жесткость воды, выраженная в ммоль экв./л, если концентрация СаCl2 составляет 0,005 моль/л?
Растворимость СаSO4 в воде 0,202%. Вычислите жесткость насыщенного раствора этой соли, принимая его плотность за 1,0 г/мл.
Для умягчения 100 л воды потребовалось 12,72 г Na2CO3. Чему равна жесткость образца воды в ммоль экв./л?
На титрование 0,05 л образца воды израсходовано 4,8∙10-3 л 0,1н. раствора HCl. Чему равна карбонатная жесткость воды?
Какую массу гашеной извести надо прибавить к 2,5 л воды, чтобы устранить ее временную жесткость, равную 4,43 ммоль экв./л?
При определении временной жесткости на титрование 0,1 л воды израсходовано 5,25∙10-3 л 0,101н. раствора HCl. Какова величина жесткость этой воды?
Образец воды объемом 1 литр содержит 48,6 мг гидрокарбоната кальция и 29,6 мг сульфата магния. Какое количество Са2+ и Mg2+ содержится в литре этой воды? Чему равна общая, постоянная и карбонатная жесткость воды?
Некарбонатная жесткость воды равна 3,18 ммоль экв./л. Какую массу Na3РO4надо взять, чтобы умягчить 1м3 воды?
8.6 Список рекомендуемой литературы
8.6.1 Глинка Н.Л. Общая химия: Учебное пособие для вузов/ Под ред. А.И.Ермакова. – М.: Интеграл-Пресс, 2010. – 728 с.
8.6.2 Романцева Л.М. Сборник задач и упражнений по общей химии/ Л.М.Романцева, З.Л.Лещинская, В.А.Суханова. – М.: Высш. шк., 1991. – С.146 – 149.
1.4.2. Определение карбонатной жёсткости воды
Для определения карбонатной жёсткости титруют некоторый объем исследуемой воды стандартным раствором соляной кислоты в присутствии индикатора метилового оранжевого. При этом протекают реакции с гидрокарбонатами:
Ca(HCO3)2 + 2HCl = CaCl2 + 2CO2↑ + 2H2O;
Mg(HCO3)2 + 2HCl = MgCl2 + 2CO2↑ + 2H2O;
и карбонатами:
CaCO3 + 2HCl = CaCl2 + CO2↑ + H2O;
MgCO3 + 2HCl = MgCl2 + CO2↑ + H2O.
При достижении точки эквивалентности, когда прореагируют все карбонаты и гидрокарбонаты, индикатор меняет окраску с желтой на оранжевую.
Поскольку содержание карбонатов обычно во много раз меньше, чем содержание гидрокарбонатов, а именно присутствие последних определяет наличие у воды временной жёсткости, такое определение иногда называют определением временной жёсткости. При этом предполагают, что содержание карбонатов настолько мало, что их вкладом в постоянную жёсткость можно пренебречь.
1.4.3. Определение общей жёсткости воды
При определении общей жёсткости используют метод титрования, который называется комплексонометрическим методом, так как в нем используются вещества с общим названием комплексоны. Один из комплексонов, наиболее широко применяемый — трилон Б (это торговая марка, под которой впервые был выпущен этот химический продукт). Он представляет производное органической кислоты, в составе молекулы которого присутствуют два атома водорода, способные замещаться на атомы металла. Не рассматривая строения молекулы трилона Б, используем ее общепринятое условное обозначение: H2Y.
Определение основано на том, что ионы кальция и магния образуют растворимые комплексные соединения с Трилоном Б:
Ca2+ + H2Y → [CaY] + 2H+;
Mg2+ + H2Y → [MgY] + 2H+.
В качестве индикаторов используют реактивы, которые дают с определяемыми ионами характерно окрашенные соединения. При достижении точки эквивалентности, когда почти все ионы Ca2+ и Mg2+ связываются с трилоном Б в комплексы и их концентрация в растворе резко уменьшается, окраска раствора меняется. Титрование необходимо проводить в слабощелочной среде (для связывания образующихся ионов водорода), поэтому к титруемому раствору кроме индикатора добавляют так называемый буферный раствор, который обеспечивает постоянство величины pH (при осуществлении данного титрования добавляют аммиачный буферный раствор, который поддерживает постоянство pH в пределах 8…10 единиц).
2. Экспериментальная часть
Содержание работы:
1. Методом кислотно-основного титрования определить карбонатную жёсткость водопроводной воды.
2. Методом комплексонометрического титрования определить общую жёсткость водопроводной воды.
3. По экспериментальным данным сделать вывод об уровне жёсткости исследованной воды и рассчитать величину постоянной жёсткости.
Опыт 1. Определение карбонатной жёсткости
В две конические колбы налить по 100 мл исследуемой (водопроводной) воды (отмерив ее мерным цилиндром), добавить 5-6 капель раствора индикатора метилового оранжевого. Одна из колб является контрольной, т.е. используется, чтобы заметить изменение окраски раствора в другой колбе при титровании. Записать начальный уровень титранта в бюретке.
Перед титрованием убеждаются, что в бюретке достаточно раствора, а стеклянный носик полностью заполнен жидкостью. Пузырьки воздуха из носика выдавливают потоком жидкости, повернув трубку носика вверх под углом около 45°. Выпускное устройство бюретки представляет резиновую трубку со стеклянным шариком внутри. Для вытекания жидкости слегка оттягивают большим и указательным пальцем стенку трубки от шарика, чтобы между ними образовался просвет. Наполняют бюретку через воронку, после чего воронку вынимают из верхнего отверстия; если этого не сделать, во время титрования с воронки может стечь оставшийся в ней раствор, и измерение объема окажется неточным.
При необходимости долить раствор титранта в бюретку, доведя уровень до нулевого деления. Во вторую колбу из бюретки прибавлять 0,1 н. раствор соляной кислоты до перехода окраски индикатора из желтой в оранжевую (получаемый цвет, скорее, можно назвать персиковым).
Поверхность жидкости в бюретке представляется широкой вогнутой полосой (мени́ск). Отсчет значений по шкале производят по нижнему краю мениска, глаз наблюдателя должен находиться на уровне мениска. Титрант из бюретки сначала приливают достаточно быстро, непрерывно перемешивая содержимое колбы вращательными движениями. На шарик надавливают левой рукой, а колбу держат и перемешивают правой рукой. Титрование проводят стоя! За окраской раствора наблюдают, подложив под колбу лист белой бумаги для лучших условий наблюдения. По мере приближения к концу титрования, о чем можно судить по появлению в центре колбы «облачка» розовой окраски, тут же исчезающего при дальнейшем перемешивании, титрант приливают уже по каплям. Раствор должен изменить цвет от прибавления одной определенной капли; в этот момент розовое «облачко» не исчезнет, а распространится по всему раствору.
Чтобы убедиться в отсутствии значительных случайных ошибок при выполнении титрования и при отмеривании объема титруемого раствора, титрование повторяют два-три раза и рассчитывают среднюю величину Vстанд, которую в дальнейшем используют для расчетов.
Записать уровень раствора в бюретке и вычислить объем титранта, пошедший на титрование, как разность конечного и начального отсчетов. Титрование повторить (можно использовать «контрольную колбу»). Рассчитать объем стандартного раствора как среднее по результатам двух титрований. Вычислить карбонатную жёсткость Жкарб исследуемой воды (в ммоль экв/л) по формуле:
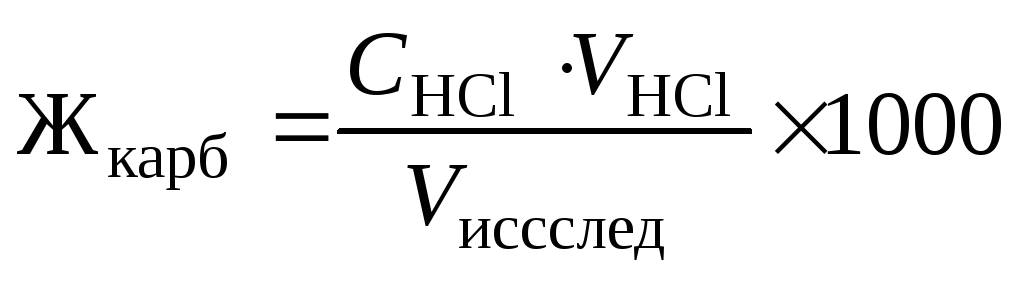 ,
,
где СHCl — молярная концентрация эквивалента (нормальность) раствора соляной кислоты; VHCl — объем соляной кислоты, пошедший на титрование; Vисслед — объем исследуемой воды; 1000 — коэффициент перехода от моль экв/л к ммоль экв/л.
Опыт 2. Определение общей жёсткости
Титрование проводят в присутствии индикатора «хром темно-синий». В коническую колбу налить 25 мл исследуемой воды и добавить дистиллированной воды до общего объема 100 мл (отмерять цилиндром). Добавить 5 мл аммиачного буферного раствора и 5-7 капель раствора индикатора хрома темно-синего; при этом раствор приобретает винно-красную окраску.
Записать начальный уровень титранта в бюретке. При необходимости долить раствор титранта в бюретку, доведя уровень до нулевого деления. Из бюретки по каплям прибавлять 0,1 н. раствор трилона Б до изменения окраски раствора от винно-красной до синевато-сиреневой.
В отличие от титрования в первом опыте, где реакция протекает практически мгновенно, взаимодействие трилона Б с кальцием и магнием требует некоторого заметного промежутка времени. Чтобы не пропустить момент достижения точки эквивалентности, титрант с самого начала титрования добавляют отдельными каплями с интервалом в две-три секунды, внимательно наблюдая, не меняется ли окраска титруемого раствора. Если приливать титрант быстрее, то некоторое количество его попадет в уже оттитрованный раствор, который еще не успел поменять окраску; в результате раствор будет перетитрован, а объем пошедший на титрование — завышен.
Записать уровень раствора в бюретке и вычислить объем титранта, пошедший на титрование, как разность конечного и начального отсчетов. Титрование повторить. Рассчитать объем стандартного раствора как среднее по результатам двух титрований. Вычислить общую жёсткость Жобщ исследуемой воды (в ммоль экв/л) по формуле:
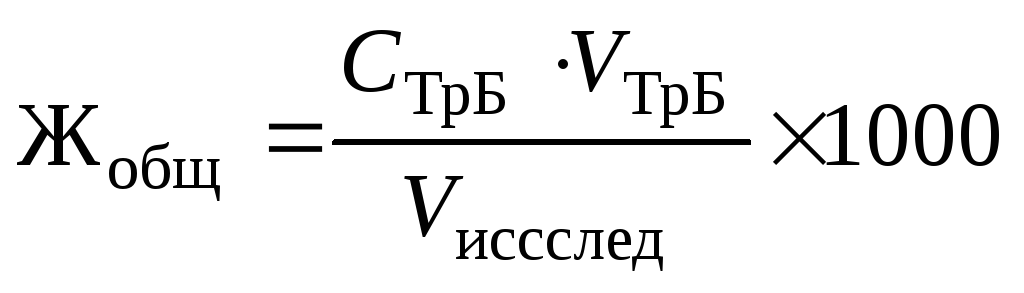 ,
,
где СТрБ — молярная концентрация эквивалента (нормальность) раствора трилона Б; VТрБ — объем трилона Б, пошедший на титрование; Vисслед — объем исследуемой воды; 1000 — коэффициент перехода от моль экв/л к ммоль экв/л.
По полученным данным сделать вывод об уровне жёсткости исследованной воды.
Пренебрегая вкладом карбонатов в величину постоянной жёсткости и считая, что в данном случае временная жёсткость воды совпадает с карбонатной жёсткостью, т.е. Жкарб = Жвр, рассчитать постоянную жёсткость воды по разности между общей и временной жёсткостью.
Жпост = Жобщ – Жвр.
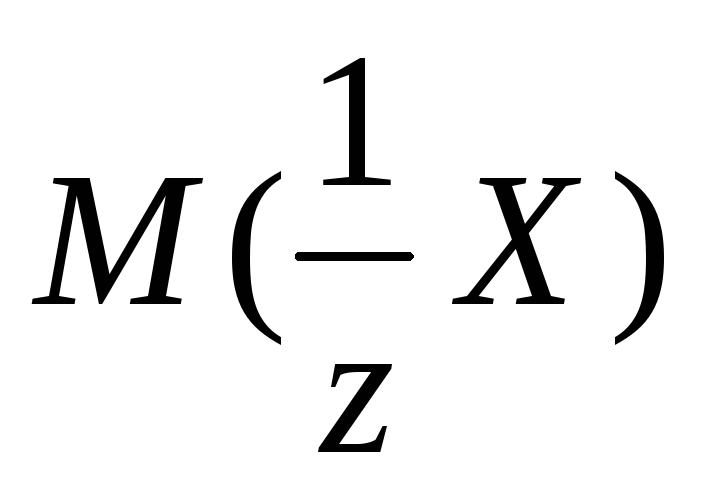 , г/моль
, г/моль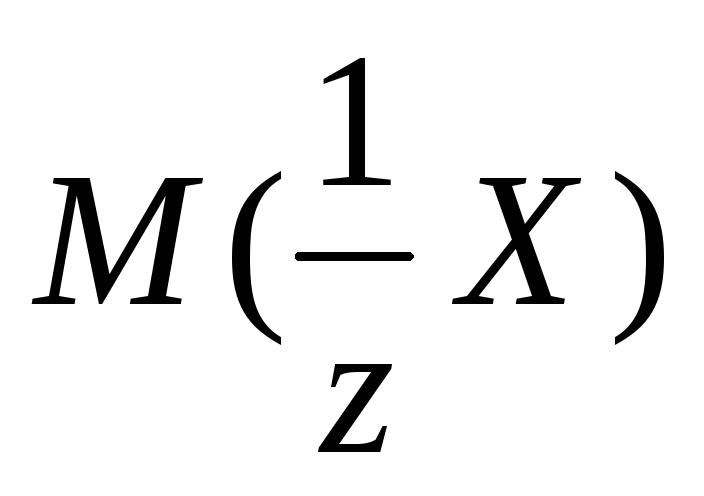 , г/моль
, г/моль