Что такое жесткость воды и на что она влияет? — интересные обзоры — Magicwaters
Различают три вида жесткости воды:
• общая жесткость
• постоянная жесткость
• временная жесткость
Общая жесткость представляет собой сумму временной и постоянной жесткости воды.
Постоянная жесткость воды считают по наличию кальциевых и магниевых солей соляной, серной, азотной кислот, т.е. сильных кислот. Такие соли при кипячении воды не выпадают в осадок и не кристаллизуются в виде накипи. Временная жесткость воды – считается по наличию в воде карбонатов и гидрокарбонатов кальция и магния, которые при кипячении и показателях рН > 8,3 практически полностью выпадают в хлопьевидный осадок, кристаллизуются в виде накипи или образуют пленку на поверхности воды.
Как соли кальция и магния попадают в природную воду? Ведь вода, выпадающая в виде осадков (снег, дождь, град), и талая вода не содержат солей? Соли попадают в воду из породы, богатой известняками, гипсами или доломитами, залегающими в толщах земли.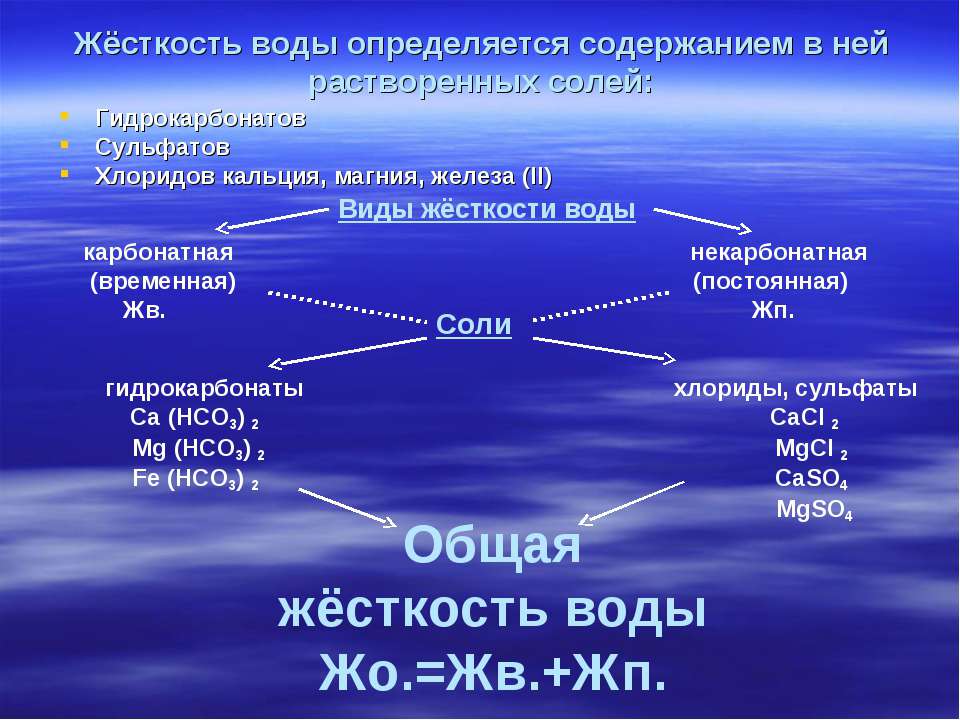
Какая же вода считается жесткой, а какая – мягкой?
Согласно методам определения жесткости воды по гидрохимии, считается, что:
0-4 мг-экв./л мягкая вода
4-8 мг-экв./л вода средней жесткости
8-12 мг-экв./л жесткая вода
> 12 мг-экв./л очень жесткая вода
Это касается оценки общей минерализации воды.
Российский СанПиН определяет
Специалисты в области фильтрации условно делят жесткость питьевой воды так: 0-1,5 мг-экв/л – мягкая вода 1,5-2 мг-экв/л – оптимальная питьевая вода 2-5 мг-экв/л – жесткая вода 5-7 мг-экв/л – сверхжесткая вода Больше 7 мг-экв/л – не питьевая вода, за пределами рекомендованных значений.
Природная вода бывает поверхностной и подземной.
Поверхностная вода имеет меньшую жесткость за счет разбавления осадками и талыми водами. Поверхностные воды имеют существенные сезонные колебания показателей общей жесткости воды.
Поверхностные воды имеют существенные сезонные колебания показателей общей жесткости воды.
Состав питьевой воды должен быть оптимален по количеству солей жесткости.
При избытке солей возникает риск развития мочекаменной болезни, заболеваний костей, суставов. Если солей в воде будет слишком мало, соли будут вымываться из организма, кости приобретут большую ломкость, возрастает риск заболеваний суставов и сосудов.
Пониженный уровень жесткости воды также приводит к риску сердечно-сосудистых заболеваний за счет вымывания солей из организма. Это подтверждает статистика по странам Европы и Северной Америки, исследования в российских регионах с разными средними показателями по жесткости воды.
Жесткая же вода, напротив, образует накипь, которая приводит к уменьшению сроков службы бытовой техники, порче водонагревательного и сантехническое оборудования.
Неожиданным фактом стало то, что вода с уровнем жесткости меньше 2 мг-экв/л оказывает более сильное коррозийное воздействие на водопроводные трубы, нежели жесткая вода. Это связано с тем, что она имеет более низкую щелочность.
Поэтому, в ряде случаев, особенно в теплоэнергетике, приходится добавлять соли карбонатов в водопроводную воду для достижения оптимального соотношения между коррозионной активностью воды, ее водородного показателя и содержания солей кальция и магния.
В настоящее время ряд специалистов, ссылающиеся на данные ВОЗ, утверждают, что имеющаяся статистика не позволяет однозначно считать мягкую и жесткую воду опасной для здоровья человека. Но имеющиеся данные о сердечно-сосудистых заболеваниях четко коррелируются с жесткостью воды в регионе, а отсутствие нормативной доказательной базы на уровне Всемирной Организации Здравоохранения не означает, что нужно пренебрегать качеством питьевой воды и не регламентировать показатели жесткости — соли кальция и магния, тем более что даже бытовая техника очень чувствительна к этим показателям, и требует добавления в воду соответствующих реагентов.
На сайте Мосводоканала есть таблица перевода жесткости воды в единицы других стран, позволяющая рассчитать необходимое количество смягчающих реагентов, которые нужно добавлять в воду согласно инструкциям к бытовым приборам.
Калькуятор жёсткости воды
Умягчение воды для лучшего качества жизни
Обычная вода может быть жесткой и мягкой. Жесткая вода — это вода, которая насыщена ионами кальция и магния. Повышенная жесткость воды приводит к образованию накипи, которая портит нагревательные приборы и стиральные машины. Жесткая вода плохо мылится, поэтому жесткость воды приводит к повышенному расходу моющих средств. Употребление жесткой воды приводит к ухудшению внешнего вида кожи, к сухости и повышенной ломкости волос. Жесткая вода обладает привкусом горечи, а мясо и овощи дольше варятся в жесткой воде. Также ионы кальция и магния приводят к более быстрому образованию солевых отложений в суставах, камней в почках и мочевом пузыре.
Существует такой процесс, как умягчение воды. Он заключается в ионном обмене. Ионы, то есть положительно заряженные атомы кальция и магния оседают в ионообменнике. Ионообменник представляет собой колонну из специальной смолы, которая поглощает вредные ионы кальция и магния. Вместо них ионообменная смола выдает безвредные ионы натрия.
Он заключается в ионном обмене. Ионы, то есть положительно заряженные атомы кальция и магния оседают в ионообменнике. Ионообменник представляет собой колонну из специальной смолы, которая поглощает вредные ионы кальция и магния. Вместо них ионообменная смола выдает безвредные ионы натрия.
Ионный обмен происходит следующим образом: изначально молекулы смолы удерживают ионы натрия. Ионы кальция и натрия замещают ионы натрия, так как имеют более высокий заряд. Со временем, большинство ионов натрия внутри ионообменника замещаются ионами кальция и магния. Для того чтобы восстановить нормальную работу ионообменника, его промывают концентрированным раствором поваренной соли. Соль является соединением натрия и хлора. Ионы натрия, хоть и слабее ионов калия и магния, но за счет своего количества они постепенно выбивают ионы калия и магния. Таким образом, ионообменная смола восстанавливает свои функции.
Умягчение воды улучшает качество жизни. Теперь мы не зависим от природной жесткости воды, и можем улучшать потребительские свойства воды для питья, стирки, приготовления пищи, для промышленных нужд. Существуют различные системы умягчения. Для дома или дачи будет достаточно небольшого прибора, для промышленных и медицинских нужд применяют ионообменные системы большого размера.
Существуют различные системы умягчения. Для дома или дачи будет достаточно небольшого прибора, для промышленных и медицинских нужд применяют ионообменные системы большого размера.
Для изготовления раствора поваренной соли используют чистую соль в таблетках. Можно также использовать не йодированную соль мелкого помола. Помимо своей главной функции — умягчение воды, ионообменные фильтры — умягчители поглощают ионы других вредных веществ. Это органические соединения, соли тяжелых металлов, нитраты, нитриты. А ещё сульфаты, железо, марганец.
Излишнее умягчение тоже является вредным. Естественная жесткость воды, оптимальная для организма человека, лежит в пределах 0.1 — 0.2 миллиграмма кальция на литр воды. Поэтому умягчитель воды не убирает кальций и магний полностью, а приводит его количество в норму.
Чем же опасна излишне мягкая вода?
Кальций и магний — микроэлементы, необходимые для здоровья человека. Кальций — основной строительный материал для костей. Недостаток кальция приводит к хрупкости костей, что повышает вероятность переломов.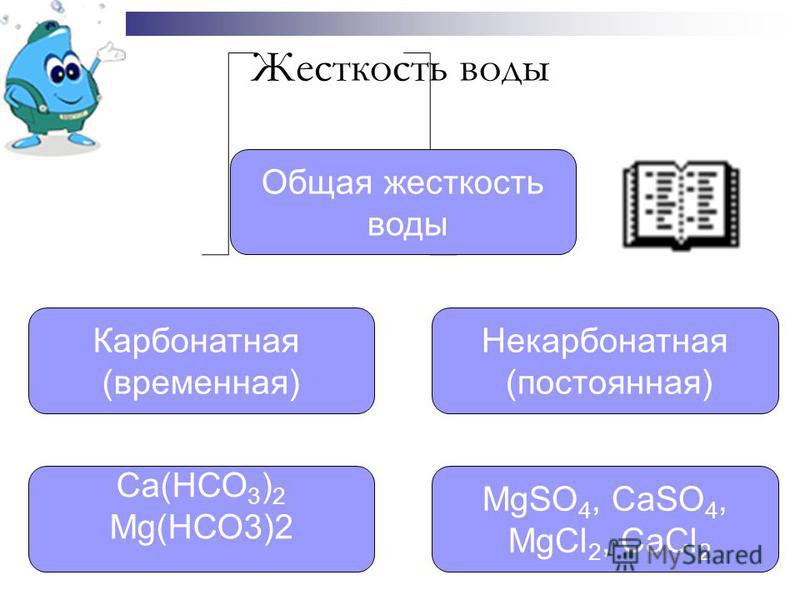
Чересчур мягкая вода не годится для мытья. При мытье рук она создает дискомфорт, потому что мыло и моющие средства слабо смываются мягкой водой. Для техники мягкая вода тоже вредна, так как разрушает шланги и прокладки из резины. Также чрезмерно мягкая вода наносит вред желудку. Это связано с тем, что в мягкой сверх нормы воде повышается содержание соды. Сода нейтрализует природную кислотность желудочного сока с образованием в желудке углекислого газа. Только «золотая середина» между излишней жесткостью, и излишней мягкостью воды оптимальна для человеческого организма.
Помимо использования ионообменной смолы, существуют и другие способы умягчения. Среди них можно назвать нанофильтрацию, электрохимический метод и реагентное умягчение. Реагентное умягчение связанно с введением в воду специальных веществ (реагентов), такая вода потом не годится для питья. Эффективность нанофильтрации не очень высока, и установка для неё является очень дорогостоящей. Электрохимический метод не извлекает из воды соли калия и магния, а переводит их в нерастворимую форму. Поэтому электрохимический метод смягчения подходит далеко не во всех случаях.
Поэтому электрохимический метод смягчения подходит далеко не во всех случаях.
Подытожив, можно сказать, что ионообменные умягчители обладают лучшим соотношением цены и качества. А для бытовых нужд умягчители на основе ионного обмена находятся вне конкуренции.
|
Поиск по сайту Подписка на рассылку | Вода для полива. Жесткость воды Татьяна Рудакова К воде для полива растений предъявляется целый ряд требований. К основным можно отнести то, что в ней должно быть мало содержание солей и других минеральных веществ, полностью должны отсутствовать токсичные примеси. У поливной воды должна быть нейтральная или слабокислая реакция. Вода для полива растений может быть взята из сетей водоснабжения (водопроводная вода), колодцев, скважин, родников, из близлежащих водоемов. Водопроводная вода проходит фильтрацию и различные стадии очистки, что делает ее пригодной для питья. Эта вода подходит и для полива, содержание в ней минеральных веществ достаточно невелико, но в ней значительно содержание хлора. Вода из скважины, колодца или родника, наоборот, отличается высоким содержанием солей и минеральных веществ, поскольку, проходя сквозь толщу грунта, вымывает из него ценные минеральные вещества, что является положительным для воды свойством. Но содержание в воде минеральных веществ не должно быть завышенным, иначе она становится непригодной для полива растений. Вода из водоема менее прочего пригодна для полива, главным образом из-за большого риска содержания в ней токсичных отходов, продуктов гниения, различных химических веществ, бактерий и прочих опасных примесей. Дождевая вода значительно мягче водопроводной, обладает почти нейтральной кислотной реакцией, в ней довольно высоко содержание растворенного кислорода. Благодаря всем этим характеристикам дождевую воду можно рассматривать как идеальную (и естественную) для полива растений. При этом все же следует учитывать, что в дождевую воду неизбежно попадают вредные химические соединения, тяжелые металлы, пыль, продукты сгорания жидкого и твердого топлива, а это сильно снижает ценность дождевой воды. Для уменьшения степени загрязнения дождевой воды, при ее сборе, следует соблюдать ряд правил. Дело в том, что у нас нет специальных приспособлений для сбора дождевой воды. Мы собираем ее, стекающей с крыши. И дождевая вода, прежде чем по водостоку попасть в бочку, стекает по крыше, смывая осевшую на ней пыль, химические соединения, сажу и другие вещества. Особенно сильно загрязнена дождевая вода после длительного периода засухи, т.к. количество накопившейся на крышах грязи особенно велико. Жесткость — еще одно свойство воды, обусловленное наличием в ней солей кальция и магния, реже в сочетании с солями железа. Жесткость воды, в зависимости от вида присутствующих в воде соединений кальция и магния, подразделяют на временную и постоянную. Причем стоит отметить, что временная жесткость более вредна для растений, чем постоянная. Благодаря использованию воды с постоянной жесткостью растения снабжаются такими ценными микроэлементами, как кальций и магний. А регулярное поступление кальция положительно влияет на процессы обмена веществ, активизирует деятельность микроорганизмов и в целом улучшает структуру почвы. Помимо всего прочего, постоянная жесткость воды почти не влияет на изменение уровня кислотности почвы. Чаще всего мы, как городские жители, используем для полива хой водопроводную воду. Как правило, она обладает повышенной жесткостью, что подтверждается толстым слоем накипи в чайниках, белым налетом на поверхности земли и стенках горшков. Особенно сильно жесткость воды увеличивается зимой, когда исчезает полностью или сильно сокращается подпитка водоемов дождевой водой. Поэтому кажется, что о причине жесткости воды и способах ее умягчения стоит поговорить подробнее. Для этого придется вспомнить школьный курс химии. Итак, жесткостью принято называть совокупность свойств воды, обусловленных содержанием в воде катионов кальция (Са) и магния (Mg). Жесткость воды можно подразделить по видам. Общая жесткость — суммарная концентрация ионов магния и кальция. Это сумма карбонатной (временной) и некарбонатной (постоянной) жесткости. Карбонатная жесткость (временная) — обусловлена присутствием в воде гидрокарбонатов и карбонатов кальция и магния. Этот тип жесткости воды практически полностью устраняется кипячением воды, и поэтому получил название временной жесткости. При повышении температуры воды гидрокарбонаты распадаются, в результате образуется нестойкая угольная кислота, а кальций и магний выпадают в осадок в виде карбоната кальция и гидроксида магния. Некарбонатная жесткость (постоянная) – обусловлена наличием солей кальция, магния и таких кислот как соляная, серная, азотная. Измеряется жесткость воды в градусах (условных единицах, миллиграмм — эквивалентах на 1 литр (мг-экв/л). В нашей стране чаще используются русские или немецкие градусы жесткости. Один градус соответствует одному миллиграмм — эквиваленту кальция (20,04 мг), растворенному в 1 л воды, или одному миллиграмм — эквиваленту магния (12,16 мг), также растворенному в 1 л воды.
Жесткость в мг-экв/л и в градусах немецкой шкалы (°dH) связана следующими отношениями: По степени жесткости вода подразделяется на: — очень мягкую 0-4 град. — мягкую 5-8 град. — средней жесткости 9-16 град. — жесткую 17-32 град. — очень жесткую 33 град. и выше.
Как видно из таблицы, водопроводная вода без предварительного удаления кальция и магния, за редким исключением, пригодна для полива растений. Вопрос о том, можно ли поливать водопроводной водой хойи, можно считать дискуссионным. С одной стороны, хойи, как эпифитные растения, в природе получают воду исключительно мягкую, дождевую, и мы должны использовать водопроводную воду с осторожностью. С другой стороны, среди хой немало литофитных, растущих на известняковых склонах и явно привыкших к большому содержанию кальция в почве. В литературе часто можно встретить указания на то, что в субстраты для выращивания хой нужно добавлять известь (как правило, речь идет о ракушечнике). В нашей практике разведения хой как горшечных культур, мы сталкиваемся и с признаками хлороза, и с признаками угнетения растений, видим известковый осадок на стенках горшков и поверхности земли. Видимо, для полива хой водопроводной водой пользоваться можно, но ее следует умягчать зимой, при сезонном значительном увеличении жесткости. О действительной жесткости воды можно узнать в лаборатории городских водопроводных сооружений или сделать такой анализ самому. Снижение жесткости воды называется умягчением. Способов умягчения воды довольно много и они всегда ставят целью снижение в воде концентрации катионов кальция и магния. Временную (карбонатную) жёсткость устраняют либо кипячением воды, либо реагентным способом: добавлением в нее гашёной извести. Постоянную жесткость воды устраняют добавлением соды (иногда используют ортофосфат натрия). Во всех случаях кальций и магний выделяются из воды в виде нерастворимого осадка, вода становится мягкой. При использовании реагентов не надо забывать, что в умягченной воде увеличивается содержание ионов натрия, например, не используемого растениями в процессах жизнедеятельности. В домашних условиях воду для умягчения проще кипятить в течение 20-30 минут. Затем ее, не перемешивая, нужно охладить и осторожно слить 2/3 объема (в остальном объеме будут находиться осажденные соли). Аквариумисты для умягчения воды часто используют подкисление. Этим способом снижается только кальциевая жесткость. Предположим, вам нужно умягчить 5 литров воды и вам известно, что ее кальциевая жесткость составляет 5 град (мг-экв/л). Таким образом, в 5 литрах жесткой воды весовое содержание кальция составит 500мг/л. Поэтому для обработки всей воды потребуется 50 мл раствора щавелевой кислоты. Поскольку кальций необходим растениям для их жизнедеятельности, не стоит производить полное умягчение воды и нужно использовать лишь 45 мл раствора кислоты. Обработанной воде нужно дать отстояться для полного выпадения осадка не менее суток. Есть мнение, что вместо щавелевой кислоты лучше использовать ее растворимую соль, оксалат аммония. В этом случае малорастворимый осадок оксалата кальция образуется быстрее. Аммиак, который образуется в результате этой реакции, может быть источником азота для растений. Если наличие излишнего азота нежелательно, он легко удаляется при нагревании умягченной воды. В продаже часто встречаются разнообразные «декальцификаторы». Как правило, это натриевая соль этилендиаминтетрауксусной кислоты (трилон Б). Эти средства катионы кальция и магния в осадок не выводят, а переводят их в растворимые комплексные соединения, доступные для питания растений. Хорошо умягчает жесткую воду вымораживание из нее солей. В начале процесса происходит образование льда и концентрирование солей в не успевшей замерзнуть части воды. Поэтому следует замораживать не более 2/3 объема воды. Лед при размораживании станет источником прекрасной мягкой воды, незамерзшую же воду, ставшую достаточно концентрированным раствором солей, придется вылить. Тем же, кто живет в местах, где зимой замерзают водоемы, можно напомнить, что в их распоряжении всегда есть лед – источник мягкой воды для полива (или свежевыпавший снег после затяжного снегопада). Обессоленную, мягкую воду получают так же дистилляцией, кипячением воды с улавливанием ее паров с последующей конденсацией. Дистиллированная вода прекрасно подходит для полива растений, следует помнить только, что в этом случае растениям следует обеспечить регулярные подкормки удобрениями (в дистиллированной воде отсутствуют не только соли жесткости, но и соли, необходимые для жизнедеятельности растений). В продаже для умягчения жесткой воды предлагаются ионообменные фильтры. Фильтры представляют собой емкости, наполненные смолой, содержащей способные к замене катионы натрия. При пропускании жесткой воды через фильтр катионы кальция и магния замещаются на катионы натрия, оставаясь в смоле, а вода умягчается. Но при этом она обогащается содой, что делает реакцию среды щелочной и приводит к тому, что некоторые элементы питания почвы становятся нерастворимыми, то есть недоступными для растений. Ну а сами ионы натрия, напомним, растениям не нужны. Все сказанное делает использование такой умягченной воды для полива растений нежелательным. Кроме того, ионообменные фильтры требуют регулярной регенерации (или замены, если вы не хотите регенерировать смолу самостоятельно). Самыми эффективными по умягчению (и очистке) воды являются обратноосмотические фильтры. Они защищают от любых механических примесей, атомов и ионов, размер которых превышает 1/1000 долю микрона, что в сотни и тысячи раз выше адсорбционной способности лучших сортов угля и синтетических волокон. Обратноосмотическую воду можно пить без кипячения, так как в ней отсутствуют вирусы, микробы и бактерии. В такой воде не может быть гербицидов и пестицидов (в силу крупных размеров их молекул). Полупроницаемая осмотическая мембрана препятствует выравниванию концентраций веществ по разные стороны от себя. Поток воды продавливается через мембрану, которая задерживает примеси, поддерживая их высокую концентрацию с той стороны, откуда течет вода. В зависимости от типа мембраны степень очистки воды составляет 90–98%. Необходимо понимать, что прежде, чем вода поступит на обратноосмотическую мембрану, она должна пройти несколько ступеней предварительной (грубой) фильтрации, где будут улавливаться более крупные частицы примесей (это существенно удлинит срок ее службы). | |||
Вода в аквариуме с растениями
Aquascape Promotion >В пошаговой инструкции по созданию акваскейпа для новичков вы уже читали о параметрах воды в аквариуме с растениями, чему посвящена целая глава инструкции — Водоподготовка. Однако по-прежнему возникают вопросы касательного подбора оптимальных параметров воды в аквариуме и как их получить. В этой статье будут даны не только показатели рН и жесткости воды для аквариума с растениями, но и описаны методы как эти параметры изменить, если водопроводная вода имеет неподходящие параметры воды для выращивания аквариумных растений.
В этой статье будут даны не только показатели рН и жесткости воды для аквариума с растениями, но и описаны методы как эти параметры изменить, если водопроводная вода имеет неподходящие параметры воды для выращивания аквариумных растений.
Вариантов на самом деле много: водопроводная вода, вода из источника, дождевая вода, кипяченая вода, вода после фильтра обратного осмоса, дистиллированная вода, реминерализованная вода. Все это вода, но суть не в ней, а в том, что в этой воде содержится. В основном в воде содержаться минералы, причем основные это соли жесткости (сульфаты и карбонаты кальция и магния) и содержаться они в разной воде в разных количествах. Иногда их слишком много, что мешает многим аквариумным растениям. А иногда их слишком мало, что тоже не приветствуется растениями, потому что минералы, содержащиеся в воде, работают точно также как и удобрения для аквариумных растений.
Чаще всего именно водопроводную воду используют для выращивания аквариумных растений.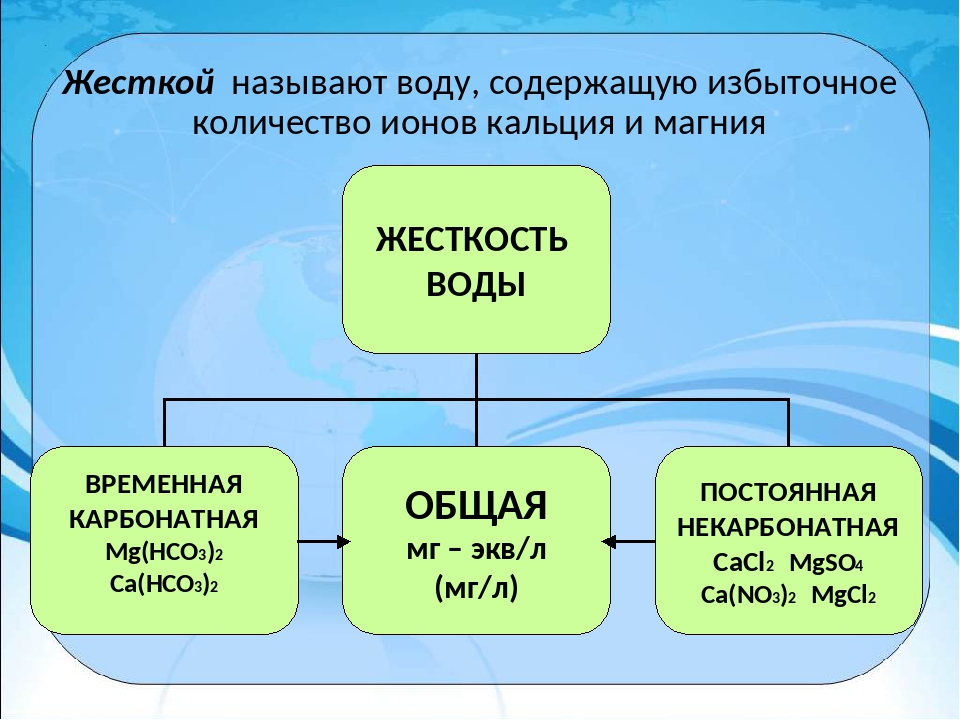 Это удобно и экономично. Но следует не забывать, что водопроводная вода часто хлорируется и может быть небезопасна для рыб в аквариуме. При подмене воды в аквариуме для устранения хлора аквариумисты обычно используют специальные средства, которые также связывают тяжелые металлы и содержат витамины для уменьшения стресса рыб такие как AQUAYER АнтиТоксин Vita.
Это удобно и экономично. Но следует не забывать, что водопроводная вода часто хлорируется и может быть небезопасна для рыб в аквариуме. При подмене воды в аквариуме для устранения хлора аквариумисты обычно используют специальные средства, которые также связывают тяжелые металлы и содержат витамины для уменьшения стресса рыб такие как AQUAYER АнтиТоксин Vita.
Если параметры водопроводной воды не подходят для выращивания аквариумных растений, то их можно подрегулировать. Методы регуляции параметров воды будут подробно описаны в этой статье. Сейчас давайте все же разберемся в том, что же является подходящими параметрами воды.
Начнем с главного – рН кислотность воды в аквариуме. Показатель кислотности рН отображает пропорцию кислот и оснований в воде. По сути, в аквариуме все сводится к пропорции одной кислоты и одного основания. Основание это карбонаты, количество которых иллюстрирует значение КН (карбонатная жесткость). Кислота это углекислый газ — СО2, точнее угольная кислота, которая частично образуется при растворении СО2 в воде.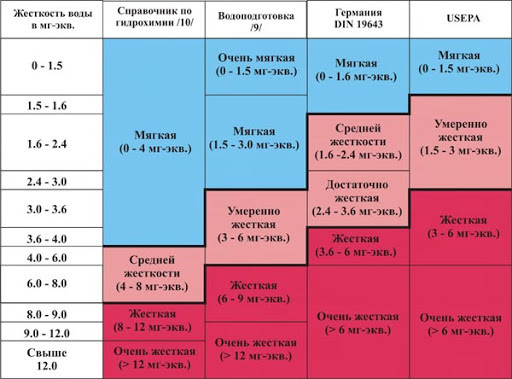 Карбонатная жесткость в аквариуме обычно не меняется. Поэтому основным фактором влияющим на показатель рН – это концентрация СО2. Чем больше концентрация СО2, тем меньше рН. Но нужно учесть еще один немаловажный момент. Со временем в аквариуме могут накапливаться и другие кислоты как следствие естественных биохимических процессов (нитрификация и др.). Поэтому, не смотря на концентрацию СО2, рН в аквариуме со временем уменьшается.
Карбонатная жесткость в аквариуме обычно не меняется. Поэтому основным фактором влияющим на показатель рН – это концентрация СО2. Чем больше концентрация СО2, тем меньше рН. Но нужно учесть еще один немаловажный момент. Со временем в аквариуме могут накапливаться и другие кислоты как следствие естественных биохимических процессов (нитрификация и др.). Поэтому, не смотря на концентрацию СО2, рН в аквариуме со временем уменьшается.
Какой показатель рН нужно поддерживать в аквариуме с растениями? Значение рН 6-7 подходит большинству аквариумных растений. Однако, под одно общее правило подводить все виды аквариумных растений не стоит. Каждое растение имеет свой природный ареал обитания и в идеале в аквариуме нужно поддерживать те параметры, к которым растение приспособлено изначально. Многие растения предпочитают мягкую слабокислую воду (рН менее 7), но есть виды, которым вполне пригодна жесткая вода с слегка щелочной реакцией (рН до 8). Например, роталы и тонины хорошо себя чувствуют при рН 5. 5 и ниже, но эти условия губительны для хемиантуса микрантемоидеса. Валлиснерия, элодея и многие виды эхинодоруса хорошо растут при рН 7.5-8. Но интервал рН 6-7 является некой точкой пересечения, в которой все эти виды растут приемлемо.
5 и ниже, но эти условия губительны для хемиантуса микрантемоидеса. Валлиснерия, элодея и многие виды эхинодоруса хорошо растут при рН 7.5-8. Но интервал рН 6-7 является некой точкой пересечения, в которой все эти виды растут приемлемо.
рН воды в аквариуме влияет на многие процессы жизнедеятельности растений, в частности потребления ими питательных веществ. В конце статьи Болезни аквариумных растений указана зависимость потребления питательных элементов от рН воды. Беря во внимание эту зависимость можно смело сделать следующий вывод. Использование одного и того же состава аквариумных удобрений при разных значениях рН воды будет воспринято растениями равносильно использованию разных составов аквариумных удобрений при одном и том же рН воды. Говоря простым языком, если в целях поддержания баланса, используется одно и тоже удобрение в аквариуме, то и показание рН для этих целей нужно стремиться поддерживать одно и тоже. В этом смысле использование рН контролера для регуляции подачи СО2 имеет свои неоспоримые преимущества.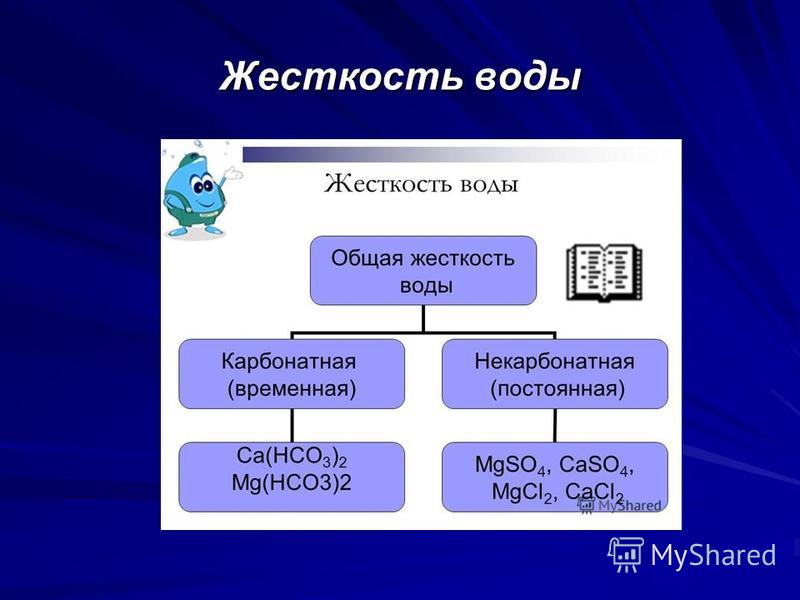
Как уже упоминалось в предыдущей главе, КН – карбонатная жесткость (или щелочность) оказывает влияние на рН воды в аквариуме. А значит, КН является важным параметром для растительного аквариума.
Карбонатная жесткость воды это количество растворенных карбонатов кальция и магния в воде. Однако встречается вода, в которой значение карбонатной жесткости обуславливается содержанием карбоната натрия или калия. В таких случаях КН может превышать значения GH, что приводит в недоумение многих аквариумистов. Поэтому корректней КН называть показателем щелочности.
Оптимальное значение карбонатной жесткости для аквариума с растениями лежит в интервале КН 3-6. Со временем вода в аквариуме подкисляется, поэтому КН в старых аквариумах может быть выше указанного. Но из этих же соображений лучше избегать падения КН до значений менее 3, так как в случае старых аквариумов рН может опуститься ниже 6.
GH — общая жесткость воды в аквариуме с растениями не такой важный параметр как КН.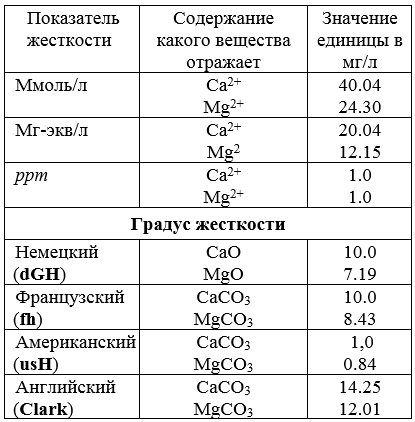 Но низкое значение общей жесткости может оказать губительное влияние на аквариумные растения. Почему? Общая жесткость характеризуется содержанием солей кальция и магния.
Но низкое значение общей жесткости может оказать губительное влияние на аквариумные растения. Почему? Общая жесткость характеризуется содержанием солей кальция и магния.
Кальций и магний нужны растениям для роста и являются макроэлементами, как удобрения. Отсюда следует, что переживать стоит лишь за низкую общую жесткость.
Некоторые виды аквариумных растений начинают показывать признаки недостатка кальция уже при GH 3. Поэтому лучше поддерживать значение общей жесткости начиная от 4 градусов, а для уверенности 6-8 градусов.
Наиболее распространенный способ смягчения воды, а именно снижения как общей, так и карбонатной жесткости это использование воды после фильтра обратного осмоса. Чистую воду после обратного осмоса использовать в аквариуме нельзя, потому что она имеет GH-0 и KH-0. Но если водопроводная вода жесткая, то воду для аквариума с растениями можно подготовить смешиванием водопровода и осмоса по принципу, описанному в Инструкции в главе про жесткость воды в аквариуме. Такой способ подходит для аквариумов больших размеров.
Такой способ подходит для аквариумов больших размеров.
В случае небольшого аквариума, или нано аквариума, не каждый готов приобретать фильтр обратного осмоса, который по размерам больше самого аквариума и дороже.
Альтернативой может служить специальное средство AQUAYER pH/KH минус, которое снижает карбонатную жесткость и рН, при этом GH не изменяется.
Если выбор остановился на использовании воды отфильтрованной обратным осмосом, тогда нужно знать некоторые нюансы. Как уже упоминалось, такая вода имеет нулевые параметры общей и карбонатной жесткости, что неприемлемо для аквариумных растений. Эту воду нужно восстанавливать до нужных параметров жесткости. Существует два способа восстановления жесткости.
Первый, упомянутый выше, смешивание этой воды с жесткой водопроводной водой. Способ приготовления описан в Инструкции в главе про жесткость воды в аквариуме.
Второй способ — это реминерализация солями кальция и магния. Существует много вариантов смесей для реминерализации води после фильтра обратного осмоса. Некоторые смеси содержать хлорид кальция только потому, что это легкорастворимая соль и ее удобного применять. Однако, с поднятием общей жесткости GH эти соли также существенно поднимают концентрацию хлорида. Хлорид в больших концентрациях угнетает рост растений в аквариуме и этот эффект наиболее заметен на прихотливых растениях.
В других смесях используют только сульфаты и хоть они и не содержат хлоридов, но в то же время не восстанавливают карбонатную жесткость (КН), только общую (GH). Если карбонатная жесткость не восстанавливать, в условиях подачи углекислого газа (СО2), рН воды может опускаться ниже значения 6. Некоторые растения могут растворяться при рН ниже 6. Также при нулевой карбонатной жесткости рН может колебаться в больших интервалах, что может вызвать гибель рыб.
Смесь минералов Реминерал GH/KH+ позволяет восстанавливать не только общую жесткость, но и карбонатную в оптимальном соотношении.
Существует много вариантов смесей для реминерализации води после фильтра обратного осмоса. Некоторые смеси содержать хлорид кальция только потому, что это легкорастворимая соль и ее удобного применять. Однако, с поднятием общей жесткости GH эти соли также существенно поднимают концентрацию хлорида. Хлорид в больших концентрациях угнетает рост растений в аквариуме и этот эффект наиболее заметен на прихотливых растениях.
В других смесях используют только сульфаты и хоть они и не содержат хлоридов, но в то же время не восстанавливают карбонатную жесткость (КН), только общую (GH). Если карбонатная жесткость не восстанавливать, в условиях подачи углекислого газа (СО2), рН воды может опускаться ниже значения 6. Некоторые растения могут растворяться при рН ниже 6. Также при нулевой карбонатной жесткости рН может колебаться в больших интервалах, что может вызвать гибель рыб.
Смесь минералов Реминерал GH/KH+ позволяет восстанавливать не только общую жесткость, но и карбонатную в оптимальном соотношении. Фактически его формула состоит из тех же самых солей кальция и магния, которые содержаться в природной воде. При этом Реминерал GH/KH+ еще и не содержит хлориды.
Фактически его формула состоит из тех же самых солей кальция и магния, которые содержаться в природной воде. При этом Реминерал GH/KH+ еще и не содержит хлориды.
Не всегда стоит задача понижать жесткость воды в аквариуме для хорошего роста аквариумных растений. В некоторых регионах водопроводная вода имеет, наоборот, очень низкую жесткость. В таких случаях нужно повышать общую и/или карбонатную жесткость.
Простой, но плохо контролируемый способ повышения жесткости это использование мраморной крошки. Состоит она из карбонатов кальция и магния, поэтому повышает как общую, так и карбонатную жесткость. На небольшой аквариум может хватить и небольшой горсти в незаметном углу аквариума для поднятия жесткости на несколько градусов. Неконтролируемость такого метода заключается в том, что жесткость может подняться и до более высоких параметров.
Более контролируемый способ, но и более сложный заключается в следующем.
Для повышения общей жесткости можно использовать смесь сульфата кальция и магния. Например, следующая комбинация повышает общую жесткость (GH) на 3 градуса в 70 литрах воды:
Например, следующая комбинация повышает общую жесткость (GH) на 3 градуса в 70 литрах воды:
1) 4.8 г сульфата кальция CaSO4*2h3O. Приблизительно 5мл. Можно отмерить шприцом. Эта соль медленно растворяется в воде.
2) 2.8 г сульфата магния MgSO4*7h3O. Приблизительно 3мл. Тоже можно воспользоваться шприцом.
Для повышения карбонатной жесткости можно использовать пищевую соду. Следующее количество соды повышает карбонатную жесткость (КН) на 3 градуса в 50 литрах воды:
4.67 пищевой соды NaHCO3. Приблизительно 5мл. Можно отмерить шприцом.
Если найти данные компоненты составляет сложность, то поднять общую и карбонатную жесткость можно с помощью Реминерала.
Возможно, после этой статьи у вас возникнут вопросы. Вы их всегда можете задать на форуме в разделе Вода для аквариума с растениями.
Жесткость воды — waterservice-dmitrov.ru
В Дмитровском районе жесткость воды из скважин колеблется в диапазоне от 6 до 12 °Ж в зависимости от места и глубины скважины.
Жесткость вод из колодцев, как правило, меньше жесткости вод из скважин, так как подвержена заметным сезонным колебаниям, достигая обычно наибольшего значения в конце зимы и наименьшего в период половодья, когда вода обильно разбавляется мягкой дождевой и талой водой.
Выделяют два типа жесткости воды:
1. Карбонатная жесткость ( временная). Обусловлена наличием в воде гидрокарбонатов и карбонатов кальция и магния. Данный тип жесткости почти полностью устраняется при кипячении воды и поэтому называется временной жесткостью.
2. Некарбонатная жесткость (постоянная). Обусловлена присутствием кальциевых и магниевых солей сильных кислот (серной, азотной, соляной) и при кипячении не устраняется (постоянная жесткость).
Для бытовых приборов, труб, чайников, форсунок душей и аэраторов кранов и т.д. опасность представляет только временная жёсткость. То есть, карбонаты кальция и магния. Почему? Потому что эти приборы имеют дело с горячей водой — и при наличии солей временной жёсткости выпадают в осадок, образуя корку накипи, из-за которой впоследствии возникают многочисленные проблемы. Соответственно, постоянная жёсткость не опасна для этой группы приборов.
Соответственно, постоянная жёсткость не опасна для этой группы приборов.
Возьмём для примера следующую ситуацию: Вы сделали анализ воды, и увидели, что ваша вода очень жёсткая. То есть, напротив показателя «Общая жёсткость» стоит какое-нибудь громадное значение. Или просто значение, даже небольшое — сейчас это не важно. Важно то, что это общая жёсткость. А общая жёсткость — это сумма постоянной и временной жёсткости. И есть вероятность того, что вся (или большая часть) жёсткой воды — не временная, а постоянная. То есть, не вредит (или очень мало вредит) вашим техническим приборам. Поэтому:
ВНИМАНИЕ!!! — обращайте внимание на анализ вашей воды на предмет временной жёсткости
Как с помощью анализа воды увидеть не только общую жёсткость, но и временную жёсткость? Очень просто. В анализе воды должен быть такой показатель, как щёлочность, который численно равен временной жёсткости воды. Щёлочность может превышать общую жёсткость — но это означает лишь то, что вся общая жёсткость является временной. Плюс в воде остаются свободные гидрокарбонаты.
Плюс в воде остаются свободные гидрокарбонаты.
Другой вариант — когда щёлочность воды меньше общей жёсткости. Вот в этом случае можно гарантированно определить, какая часть жёсткости является временной — то есть, самой опасной и вредной, с которой и нужно бороться с помощью умягчителя воды.
И ЕСЛИ щёлочность (то есть, временная жёсткость) меньше 1-2 мг-экв/л, то особо беспокоиться вам не о чем. Разве что о внезапном и непредсказуемом изменении состава воды (что, кстати, случается не так редко, как кажется). Если временная жёсткость воды меньше единицы, то процессы образования накипи происходят достаточно медленно. Накипь образуется, но она выводит из строя теплообменники или тены медленно. Чем при желании можно пренебречь. А уж если щёлочность меньше 0,5, то об умягчителях можно забыть.
Таким образом, перед выбором умягчителя обязательно делайте анализ воды по показателям щёлочность и жёсткость воды, определяя, действительно ли жёсткая вода для вас опасна.
Общие сведения по жесткости воды
Общая жесткость воды обусловливается наличием в воде ионов кальция ( Са 2+ ), магния ( Mg 2+ ), стронция ( Sr 2+ ), бария (Ва 2+ ), железа (Fe 3+ ), марганца (Mn 2+ ).
На практике стронций, железо и марганец оказывают на жесткость столь небольшое влияние, что ими, как правило, пренебрегают, так как общее содержание в природных водах ионов кальция и магния несравнимо больше содержания всех других перечисленных ионов – и даже их суммы. Поэтому:
Общая жесткость определяется суммарной концентрацией ионов кальция и магния и представляет собой сумму карбонатной (временной) и некарбонатной (постоянной) жесткости.
Оптимальная жесткость воды
Согласно ГОСТ Р 520298-2003 «Вода. Единица жесткости» жёсткость выражается в градусах °Ж , что соответствует :
1°Ж = 1 мг-экв/л = 1/2 моль/мг/м3)
1°Ж = 20,04 мг/дм3 Са2+
1°Ж = 12,15 мг/дм3 Mg2+
1°Ж = 50,04 ppm ( 1 ppm = 1мг/дм3 CaCO3 )
Воду принято делить по величине общей жесткости на группы:
ГРУППА ВОДЫ | ЕДИНИЦА ИЗМЕРЕНИЯ °Ж |
ОЧЕНЬ МЯГКАЯ | до 1. |
МЯГКАЯ | 1.6 до 4.0 |
СРЕДНЯЯ ЖЕСТКОСТЬ | 4.1 до 8 |
ЖЕСТКАЯ | 8.1 до 12 |
СВЕРХ ЖЕСТКАЯ | более 12 |
Нормативные требования и рекомендации по жесткости
Рекомендации всемирной организации здравоохранения (ВОЗ) для питьевой воды:
кальций – 20-80 мг/л; магний – 10-30 мг/л. Для жесткости какой-либо рекомендуемой величины не предлагается.
Для жесткости какой-либо рекомендуемой величины не предлагается.
Российские нормативные документы:
СанПиН 2.1.4.1074-01 «Питьевая вода. Гигиенические требования к качеству воды централизованных систем питьевого водоснабжения» — жесткость не более 7°Ж
СанПиН 2.1.4.1175-02 «Гигиенические требования к качеству воды нецентрализованного водоснабжения» — жесткость в пределах 7-10°Ж
СанПиН 2.1.4.1116-02 Норматив физиологической полноценности бутилированной воды — жесткость в пределах 1,5-7°Ж.
Умягчение воды — процесс, в результате которого из воды удаляются соли жесткости. Умягчение сегодня может осуществляться с использованием ряда способов. Это может быть:
- Умягчение с реагентами
- Умягчение ионным обменом
- Умягчение нанофильтрацией
Каждый из способов не универсален и может быть применён в тех или иных случаях. Как правило, для умягчения используется система фильтров, каждый из которых направлен на удаление примесей того или иного типа (крупных взвесей и т.д.).
Как правило, для умягчения используется система фильтров, каждый из которых направлен на удаление примесей того или иного типа (крупных взвесей и т.д.).
В нашем ассортименте представлен широкий спектр оборудования для осуществления такой процедуры, как умягчение. Всё оборудование прошло тестирование и имеет высокое качество. Вы можете использовать его длительный период времени. В выборе, установке и планировании систем Вы всегда сможете воспользоваться помощью специалистов.
Процесс удаления из воды солей жесткости называют умягчением.
Жесткая питьевая вода горьковата на вкус и оказывает отрицательное влияние на органы пищеварения. По нормам ВОЗ оптимальная жесткость питьевой воды составляет 1,0-2,0 мг-экв/л. В бытовых условиях избыток солей жесткости приводит к зарастанию нагревающихся поверхностей в бойлерах, чайниках, трубах, отложению солей на сантехарматуре и выводу ее из строя, а также оставляет налет на волосах и коже человека, создавая неприятное ощущение их «жесткости». При стирке, взаимодействуя с ПАВами мыла или стиральных порошков, соли жесткости связывают их и требуют большего расхода.
При стирке, взаимодействуя с ПАВами мыла или стиральных порошков, соли жесткости связывают их и требуют большего расхода.
В пищевой промышленности жесткая вода ухудшает качество продуктов, вызывая выпадение солей при хранении. Это характерно для бутилированной питьевой воды, пива, соков, водки. Даже при мытье бутылок она оставляет несмываемые потеки. Поэтому жесткость воды, используемой для приготовления различных продуктов, четко регламентирована и находится на уровне 0,1-0,2 мг-экв/л.
В энергетике случайное кратковременное попадание жесткой воды с систему очень быстро выводит из строя теплообменное оборудование, трубопроводы. Даже небольшой слой отложений солей на поверхности теплообменного оборудования приводит к резкому снижению коэффициента теплопередачи и увеличению расхода топлива. Трубопроводы зарастают настолько, что их производительность падает в несколько раз. Поэтому в тех процессах, где допустимо использование воды с некоторым содержанием солей, ее жесткость ограничивается еще меньшими значениями — 0,03-0,05 мг-экв/л.
Процессы извлечения из воды солей Са2+ и Mg2+ в водоподготовке называют умягчением. Относительно селективное удаление солей жесткости может производиться 3 методами:
- реагентным умягчением;
- ионным обменом;
- нанофильтрацией.
Кроме того, для защиты нагревательных элементов водонагревательного оборудования применяют магнитные преобразователи воды, которые на химический состав воды не влияют и не снижают ее жесткость. Они лишь предотвращают отложение солей жесткости на нагревательные элементы оборудования.
Реагентное умягчение воды.
Многие соли жесткости имеют низкую растворимость. При введении в раствор некоторых реагентов увеличивается концентрация анионов, которые образуют малорастворимые соли с ионами жесткости Са2+ и Mg2+. Такой процесс называют реагентным умягчением.
Различают умягчение известкованием и содо-известкованием.
При известковании в раствор добавляют гашеную известь Са(ОН)2 до рН около 10. В результате протекают реакции:
В результате протекают реакции:
Са(НСО3)2 + Са(ОН)2 = 2СаСО3 + 2Н2О;
Mg(HCО3)2 + 2Са(ОН)2 = Mg(OH)2 + 2CaCО3 + 2Н2О.
Данный способ используют при высокой карбонатной и низкой некарбонатной жесткости, когда требуется одновременное снижение жесткости и щелочности. Остаточная жесткость на 0,4-0,8 мг-экв/л превышает некарбонатную жесткость. Обычно используется совместно с ионообменным умягчением.
При содо-известковании в раствор добавляют гашеную известь Са(ОН)2 и соду Na2C03 до рН около 10. В результате протекают реакции:
Са(НСО3)2 + Са(ОН)2 + Na2CО3 = 2CaCО3i+ 2NaOH + H2CО3;
Mg(HCО3)2 + 2NaOH = Mg(OH)2 + 2NaHCО3.
Как следует из уравнений реакций, в процессе образования и осаждения осадка из раствора извлекаются соли жесткости. Вместе с ними удаляются коллоидные и взвешенные частицы с ассоциированными на них загрязнениями. На хлопьях осадка частично сорбируются органические загрязнения.
Вместе с ними удаляются коллоидные и взвешенные частицы с ассоциированными на них загрязнениями. На хлопьях осадка частично сорбируются органические загрязнения.
При содо-известковании за счет избытка ионов НСО3— достигается большая полнота извлечения солей жесткости. Повышение температуры до 70-80°С позволяет довести остаточную жесткость до 0,35-1,0 мг-экв/л. Того же результата можно достигнуть увеличением доз реагентов.
Процессы осаждения осуществляются в отстойниках и осветлителях со взвешенным слоем осадка.
Отстойники малопроизводительны, и получаемая в них гидроксидная пульпа имеет высокую влажность — 91-99%. Поэтому они в настоящее время практически не применяются.
В практике используются различные варианты осветлителей со взвешенным слоем осадка. В них очищаемый раствор подается снизу и проходит через слой осадка. Это увеличивает коэффициент очистки. Для уменьшения объема шлама используются дополнительные зоны и камеры шламоуплотнения. Увеличение степени осветления достигается введением дополнительных секций тонкослойного отстаивания.
Увеличение степени осветления достигается введением дополнительных секций тонкослойного отстаивания.
Реагентные методы в подготовке питьевой воды не используются. После них вода имеет сильнощелочную реакцию. Они широко применяются в энергетике и промышленности как первая ступень очистки до механических фильтров. При совместной работе они позволяют умягчить воду, удалить взвешенные вещества, включая коллоиды, и частично очистить ее от органических веществ.
Поскольку осаждение образовавшихся хлопьев происходит очень медленно, производительность оборудования низкая и оно имеет большие габариты. В результате образуются отходы в виде трудно утилизируемых шламов. Процесс требует тщательного контроля, причем в основном ручного, поскольку зависит от многих факторов: температуры воды, точности дозировки реагентов, исходной мутности и т. п.
Новые технологические решения (тонкослойное отстаивание, контактная коагуляция, ввод флокулянтов) позволяют достигнуть тех же показателей при меньших расходе реагентов, размерах установок и их полной автоматизации.
Ионный обмен в умягчении воды.
В соответствии с современными воззрениями, для питьевой и хозяйственно-бытовой воды оптимальной является жесткость на уровне 1,5 мг-экв/л.
Практически для всех пищевых производств требуется мягкая вода. Для водочного производства установлена предельная жесткость 0,2 мг-экв/л, для производства соков — 0,7 мг-экв/л. для питания паровых котлов — 0,05 мг-экв/л и менее. Многие производители стараются использовать воду еще более высокого качества.
Наиболее просто снижение жесткости до практически любых значений обеспечивается ионным обменом. Производительность метода практически не ограничена.
Умягчение воды может производиться методами:
- Na-катионирования.
- H—Na-катионирования (параллельное или последовательное)
- Н-катионирования с голодной регенерацией на сильно- или слабокислотном катионите.
Как отмечалось выше, в соответствии с уравнением реакции, умягчение воды производится путем ее контактирования с сильнокислотным катионитом в Na-форме, в результате чего из воды извлекаются катионы Са2+ и Mg2+ и замещаются ионом Na+. Солесодержание воды при этом практически не меняется, поскольку катионы Са2+, имеющие вес 1 мг-экв равный 20, замещаются катионом Na+ с весом 1 мг-экв, равным 23. Поскольку анионный состав не меняется, раствор остается практически нейтральным. Щелочность воды и рН может увеличиться на 0,1-0,2 единицы, в зависимости от содержания солей жесткости.
Интересным решением вопроса умягчения со снижением щелочности воды является Na-Cl-ионирование. Оно основано на применении для очистки воды катионита в Na-форме и анионита в С1-форме. Регенерация обоих ионитов производится одним и тем же раствором NaCI. В этом процессе протекают следующие суммарные реакции:
на катионите:
2R-Na + Ca(Mg)(HCO3)2 <-> R2-Ca(Mg) + 2NaHCO3 (1)
2R-Na + Ca(Mg)SО4 <-> R2-Ca(Mg) + Na2S04 (2)
2R-Na + Ca(Mg)(NО3)2 <->R2-Ca(Mg) + 2NaNО3 (3)
на анионите:
R-Cl + NaHCО3<-> R-НСОз + NaCl: (4)
2R-C1 + Na2SО4<-> R2-SO4 + 2NaCl; (5)
R-Cl + NaNО3<-> R-NO3 + NaCI. (6)
В результате реакций (1-3) с сильнокислотным катионитом обрабатываемая вода умягчается до заданного уровня, и в ней остаются только соли натрия. При их контактировании с сильноосновным анионитом в С1-форме происходит замена бикарбонатных, сульфатных и нитратных анионов на С1 (реакции 4-6). При сорбции бикарбонатного иона уменьшается щелочность воды, которая минимальна в начале цикла, а затем постепенно увеличивается. Время работы анионитного фильтра определяется повышением щелочности до заданного предела.
Метод Na-Cl-ионирования применяют при соотношении концентраций анионов в исходной воде НСО3—/ SО42- + NО3— > 1 при суммарном содержании сульфатов и нитратов не более 3 мг-экв/л.
Поскольку регенерация катионита и анионита производится последовательно одним и тем же раствором соли, необходимо исключить образование осадка карбонатов кальция в слое катионита. Для этого регенерат после анионита подкисляют, разрушая бикарбонат-ионы. Также трудно сбалансировать объемы ионитов, чтобы они насыщались одновременно. При близких значениях жесткости и щелочности в исходной воде и вдвое-втрое большей емкости катионита, чем анионита, объем последнего должен быть в 2-3 раза больше.
Другими путями являются умягчение воды методами H-Na-катионирования (параллельным или последовательным), Н-катионирования с нейтрализацией, Н-катионирования с голодной регенерацией на сильно- или на слабокислотном катионите.
Эти способы позволяют свести щелочность к минимуму, а также уменьшить солесодержание воды. Их недостатком является потребность в больших количествах кислоты и специальном кислотостойком оборудовании. Для удаления образовавшейся углекислоты в буферных баках желательно установить распылительные головки или эжекторы-декарбонизаторы.
Н-катионирование воды позволяет полностью удалить жесткость и щелочность, а также снизить солесодержание. При контакте с катионитом в Н-форме из воды извлекаются все катионы, которые замещаются ионом водорода, рН раствора становится равным 2,5-4,0, в зависимости от исходного солесодержания. Во время очистки в воду выделяются катионы водорода, которые реагируют с бикарбонат-ионами по реакции:
HCО3— + Н+ -> Н2О + СО2 (7)
Кислотность воды велика, все бикарбонаты полностью переходят в растворенный углекислый газ, который отдувается в декарбонизаторе — ДКБ. Вода после декарбонизатора содержит только анионы сильных кислот и имеет кислую реакцию. Для ее нейтрализации в воду дозируют раствор щелочи. В результате очищенная вода имеет минимальную щелочность и жесткость, а содержание катионов соответствует первоначальному содержанию анионов сильных кислот. Снижение солесодержания соответствует исходной щелочности.
При необходимости поддерживать щелочность на определенном уровне при минимальной жесткости применяют параллельное или последовательное H-Na-катионирование (рис. 3.3, г, Э). Оба этих режима обеспечивают и некоторое снижение солесодержания воды.
При параллельном H-Na-катионирование часть раствора очищается Н-катионированием на сильнокислотном катионите, а другая часть умягчается Na-катионированием на таком же ионите. В воде, прошедшей через катионит в Н-форме, удаляются все катионы и вместо них в воду поступает катион водорода, рН раствора становится равным 2,5-4,0 в зависимости от солесодержания. Бикарбонаты полностью разрушаются и присутствуют в виде растворенной углекислоты. В воде, прошедшей через катионит в Na-форме, катионы солей жесткости заменены на натрий, рН не меняется. Обработанные растворы смешиваются в расчетных соотношениях и подаются на декарбонизатор, где удаляют углекислоту. Очищенная вода может иметь остаточную щелочность Щост менее 0,35 мг-экв/л.
Параллельное H-Na-катионирование используется тогда, когда необходимо иметь остаточную щелочность Щост менее 0,35 мг-экв/л; в исходной воде карбонатная жесткость составляет более 50%, а сумма концентраций солей сильных кислот — менее 5-7 мг-экв/л.
Последовательное H-Na-катионирование заключается в пропускании части питающего раствора через катионит в Н-форме, смешении подкисленного раствора с исходным, декарбонизации и умягчении всего потока на катионите в Na-форме. При подкислении воды при Н-катионировании частично разрушается бикарбонат-ион, и связанная с ним жесткость становится некарбонатной. Щелочность перед Na-катионированием поддерживается на уровне 0,7-1,0 мг-экв/л. Поскольку степень извлечения жесткости на Н-катионировании особого значения не имеет, регенерация кислотой может осуществляться без избытка. Такой способ умягчения используется для сильноминерализованных вод с солесодержанием более 1 г/л, когда карбонатная жесткость менее 50% от общей, а щелочность 0,7-1,0 устраивает потребителя.
Магнитное проеобразование воды:
В последние десятилетия, как в России, так и за рубежом, для борьбы с образованием накипи и отложений на внутренней поверхности труб и теп- лообменного оборудования применяют магнитную обработку воды. Ее широко используют в конденсаторах паровых турбин, парогенераторах низкого давления и малой производительности, тепловых сетях и системах горячего водоснабжения, в различных теплообменных аппаратах. Эффект, последствия обработки воды в магнитном поле известны давно. Еще в XIII в. были отмечены лечебные свойства «омагниченной» воды. Но только в ХХ в. началось использование магнитов в технике водоподготовки.
Первый патент на аппарат магнитной обработки воды был выдан в 1946 г. бельгийскому инженеру Т. Вермейрену, еще за 10 лет до этого обнаружившего, что при нагреве воды, пересекшей силовые линии магнитного поля, на поверхности теплообмена накипь не образуется.
Магнитная обработка воды в аппаратах с постоянными магнитами и электромагнитами применяется уже несколько десятилетий. Замечено, что при воздействии магнитного поля на солевые кристаллы последние меняют свою структуру: кристаллы становятся гораздо мельче, и кристаллы кальцита приобретают орагонитную форму. В целом кристаллы карбоната кальция вместо обычной накипи образуют рыхлую массу, легко вымываемую из трубопровода. Кроме того, образовавшаяся большая поверхность множества мелких кристаллов «конкурирует» за отложения с нагретой поверхностью. Более 70% частиц имеют размер менее 0,5 мкм.
Механизм воздействия магнитного поля на воду и содержащиеся в ней примеси окончательно не выяснен, но имеется ряд гипотез.
Современные воззрения объясняют механизм воздействия магнитного поля на воду и ее примеси поляризационными эффектами и деформацией ионов солей. Гидратация ионов при обработке уменьшается, ионы сближаются, образуя кристаллическую форму соли. В основу одной из теорий положено влияние магнитного поля на коллоидные примеси воды, другой — изменение структуры воды. При наложении магнитного поля в массе воды формируются центры кристаллизации, вследствие чего выделение нерастворимых солей жесткости происходит не на теплопередающей поверхности (нагрева или охлаждения), а в объеме воды. Таким образом, вместо твердой накипи в воде появляется мигрирующий тонкодисперсный шлам, легко удаляемый с поверхности теплообменников и трубопроводов. В аппаратах магнитной обработки вода должна двигаться перпендикулярно магнитным силовым линиям.
Жесткость воды в аквариуме
Поделитесь статьей:Очень часто, решив заняться аквариумистикой, любители тщательно выбирают емкость для домашнего водоема, продумывают, где ее разместить, какими рыбками и растениями наполнить. Однако напрочь забывают об основном и самом важном компоненте всей этой системы – воде. Как правило, аквариумы наполняются наиболее легкодоступной водой, чаще всего водопроводной. О ее параметрах мало кто задумывается. А если и задумывается, то лишь о том, подойдет ли она рыбкам. Однако растения не менее требовательны к воде, хотя и медленнее реагируют на ее качество.
В данной статье мы затронем один из важных параметров – жесткость. Ведь от нее не в последнюю очередь зависит, станет аквариум таким, как он задуман, или нет.
Что такое жесткость воды в аквариуме?
Ее считают вторым по важности параметром воды после кислотности. От нее зависит возможность содержания и разведения рыб и растений. Она оказывает влияние на остальные свойства воды.
Определяется этот параметр наличием некоторых минералов, которые растворены в воде. Общая жесткость складывается из двух частей:
Постоянной (GH). Она первостепенна, так как определяет мягкость или жесткость воды и степень ее пригодности для обитателей аквариума. GH определяет концентрация ионов Ca++ и Mg++ в воде. Кипячение приводит к разрушению гидрокарбонатов и выпадению в осадок кальция и магния.
Жесткость, которая сохраняется после кипячения, и называется постоянной. Ее измеряют в градусах жесткости. И все тесты выпускаются именно в них.
Переменная или карбонатная (KH). Ее определяет концентрация карбонатов CO3- и бикарбонатов HCO3- в воде.
Жесткость воды в аквариуме норма
Значение жесткости воды в жизни обитателей домашнего водоема велико:
- соли магния и кальция участвуют в построении скелета и костной системы рыб;
- у моллюсков и ракообразных они обеспечивают твёрдость раковины или панциря;
- жесткость способствует нормальной жизнедеятельности и развитию половых органов;
- она влияет на успешность роста и развития растений и т. д.
Жесткость может быть разной степени интенсивности: 0-4 – очень мягкая, 5-8 – мягкая, 9-16 – средней жесткости, 17-32 – жесткая, 33 и более – очень жесткая. Водопроводная вода, как правило, имеет жесткость не более 20.
Жесткость воды в аквариуме должна быть в определенных пределах, обычно этот диапазон составляет 3-15 градусов.
Лучше, если для каждого конкретного вида показатели будут приближенными к природным условиям родных водоемов.
Например,
- улиткам требуется жесткая вода, так как в мягкой воде у них разрушаются раковины;
- живородящие рыбы будут себя хорошо чувствовать при 10;
- харациновые при 6;
- растения сагиттария и папоротник при 10-14 градусах и т. д. Эту информацию можно узнать из рекомендаций по уходу за тем или иным видом.
Также нужно учитывать, что жители аквариума усваивают кальций, поэтому его количество в воде будет постепенно снижаться. Поддерживать жесткость на одном и том же уровне легче, если грунтом является галька или крупный песок. И, разумеется, потребуются регулярные измерения.
Как определить жесткость воды в аквариуме?
Основные способы такие:
Химический реагент Трилон «Б»
Это очень точный метод, но его недостаток в чрезмерной сложности для людей, не очень интересующихся химией, да и дополнительным химическим оборудованием дома не каждый захочет обзаводиться.
TDS-метр
Он же кондуктометр, он же солемер. Метод очень простой. Однако этот электронный прибор измеряет не саму жесткость, а электропроводность воды, по которой лишь косвенно можно судить о жесткости.
Тест-полоски
Они были специально разработаны для измерения жесткости воды в аквариумах. Просты и удобны в использовании. Есть вариант, где в указанный объем воды добавляют реактив и по изменившейся окраске судят о жесткости. Все расчеты производятся по инструкции, входящей в комплект. Недостаток у этого способа один – такие наборы сложновато купить, так как они нечасто бывают в продаже.
Хозяйственное мыло
Это самый доступный, дешевый и точный в домашних условиях метод. В его основе лежит свойство мыла: оно трудно растворяется в жесткой воде и дает пену при избытке солей кальция и магния.
Как проводятся исследования:
1. Хозяйственное мыло (1 грамм) измельчить и осторожно всыпать в малое количество подогретой дистиллированной воды (продается в автомагазинах).
2. Полученный раствор вылить в стакан и добавить дистиллят так, чтобы высота его достигла 6 см для 60-процентного и 7 см для 72-процентного мыла. В каждом сантиметре такого раствора содержится столько мыла, сколько требуется, чтобы связать соли, количество которых равно 1°dH в 1 л воды.
3. Банку емкостью 1 л наполовину заполнить водой из аквариума.
4. По чуть-чуть вливать в нее подготовленный раствор, постоянно помешивая. Сначала появятся хлопья на поверхности, а затем устойчивая мыльная пена, которая свидетельствует о том, что все соли в воде связаны.
Оценка результата. Сосчитать, сколько сантиметров раствора было вылито в воду. 1 см связал в 0, 5 л воды 2°dH солей. То есть, если вылито 4 см, то жесткость 8 градусов и т. д. Если вылит весь раствор, но пены нет, то жесткость выше 12 градусов. Тогда воду для исследования разбавить дистиллятом в два раза, анализ повторить, умножая полученные результаты на два.
Результаты могут иметь погрешность в 1-2 градуса, но это не критично и не приведет к болезням или гибели обитателей аквариума.
Если жесткость воды, имеющейся в распоряжении аквариумиста, не соответствует той, которая нужна ему для содержания аквариумных обитателей, то ее можно изменить. Но делать это нужно плавно, чтобы не вызвать у питомцев стресс или иные проблемы.
Как повысить жесткость воды в аквариуме?
1. Смешать аквариумную воду с более жесткой.
2. Кипятить воду примерно час. Лучше взять эмалированную посуду. Далее остудить ее и осторожно слить две верхние части объема. Нижнюю треть, богатую солями кальция, порциями влить в аквариум, контролируя жесткость измерениями.
3. Поместить в аквариум кусочки ракушек, мрамора или известняковых пород для повышения общей жесткости на 2-4 градуса. Недостатком способа является невозможность контролировать уровень жесткости. Более предпочтительно фильтровать воду в аквариуме через слой раскрошенного мрамора, уменьшая или увеличивая количество воды, проходящей через фильтр.
4. Добавить пищевую соду в количестве 1 ч. л. на 50 л воды для увеличения переменной жесткости (KH) на 4 градуса.
5. Добавить карбонат кальция из расчета 2 ч. л. на 50 л воды для повышения постоянной (GH) и переменной (KH) жесткости на 4 градуса.
6. Добавить в воду десятипроцентный раствор хлористого Ca (можно приобрести в аптеке) и сульфата магния (приготовить самостоятельно: 50 г горькой соли растворить, получив 750 мл раствора) в одинаковых пропорциях (на 1 литр по 1 мл каждого). Жесткость увеличится примерно на 4 градуса.
7. Влить магнезию в 25% растворе (1 мл на 1 литр воды). Это поднимет жесткость на 4 градуса.
Как понизить жесткость воды в аквариуме?
Это сделать гораздо сложнее. Способы следующие:
1. Добавить дистиллированную, талую или чистую дождевую воду.
2. Прокипятить воду, остудить ее, не перемешивая, и слить с поверхности 2\3. Эту верхнюю воду добавить в аквариум.
3. Произвести вымораживание. Воду налить в низкую посуду, например, в таз. Поставить в холод. После замерзания половины лед пробить, незамерзшую воду вылить, лед растопить. Полученную воду добавить в аквариум.
4. Прогнать воду через специальные фильтры (осмотический и деионизация).
5. Отфильтровать воду через торф, добавленный во внешний или внутренний фильтр или помещенный в мешочке в емкость с отстаиваемой водой. Предварительно торф для грунта требуется прокипятить. В некоторых нерестовиках торф используют в качестве грунта.
Желтый оттенок воды, который он дает, можно убрать при помощи фильтрации через активированный уголь.
6. Можно добавить отвар ольховых шишек. Но жесткость от нее снижается незначительно и может измениться состав воды, что не во всех случаях хорошо.
7. Использовать Трилон-Б и ЭДТА согласно инструкции.
8. Посадить элодею, эгропилу и роголистник.
Теперь вы знаете, что такое жёсткость воды в аквариуме, как она важна для его обитателей, имеете представление, как ее измерять и изменять. Мы надеемся, что эта информация поможет вам в создании аквариума вашей мечты. Удачи!
Умягчение воды в домашних условиях: часто задаваемые вопросы
Загрузите версию для печати:
Умягчение воды в домашних условиях: часто задаваемые вопросы (PDF)
Что такое мягкая вода?
Вода естественным образом содержит множество минералов, таких как кальций и магний. Считается ли вода «жесткой» или «мягкой», зависит от того, сколько этих минералов содержится в вашей воде. Мягкая вода содержит меньше кальция и / или магния, чем жесткая вода.
Мне нужно смягчить воду?
Нет необходимости смягчать воду.Решение смягчиться — это личный выбор, который может повлиять на ваш дом и окружающую среду. Если жесткость вашей воды превышает 7 гран на галлон или 120 мг / л, вам может потребоваться смягчитель воды, чтобы обеспечить хорошую работу ваших приборов и улучшить вкус, запах или внешний вид вашей воды.
Определите жесткость воды
Чтобы решить, нужен ли вам домашний смягчитель воды, узнайте о жесткости воды в вашем доме. Вы можете измерить жесткость воды с помощью тестового набора или в независимой лаборатории.Ищите лаборатории в программе аккредитации экологических лабораторий. Если вы получаете воду из общественной системы водоснабжения, вы можете напрямую связаться с ними, чтобы получить информацию о жесткости воды.
Преимущества домашнего умягчения воды
- Предотвращает накопление минералов (накипи) внутри труб, арматуры и водонагревателей.
- Увеличивает срок службы некоторых приборов.
- Уменьшает или предотвращает появление минеральных пятен на стеклянной посуде.
- Предотвращает или уменьшает образование мыльных пленок и моющего творога в раковинах, ваннах и стиральных машинах.
Недостатки домашнего умягчения воды
- Может вызвать коррозию ваших труб. Ржавый металл из труб может оказаться в вашей воде. Это может способствовать повышению уровня свинца и меди в питьевой воде.
- Возможные последствия для здоровья от дополнительного натрия.
- Регулярные испытания воды и техническое обслуживание умягчителя необходимы, чтобы убедиться, что умягчитель работает правильно.
- Отрицательное воздействие на окружающую среду от использования соли.
- Вода, использованная для регенерации капель смягчителя, попадает в отходы.
Как работают кондиционеры для дома?
Домашние умягчители воды, также называемые ионообменными устройствами, — это устройства, удаляющие кальций, магний и другие минералы из питьевой воды. Шарики смолы внутри смягчителя удерживают кальций и магний и заменяют их на натрий или калий. Как только шарики смолы наполняются кальцием и магнием, высококонцентрированный раствор соли или калия удаляет кальций и магний из шариков.После прохождения через шарики образующийся раствор хлорида становится потоком отходов, который спускается в канализацию и в конечном итоге в окружающую среду.
Если у меня есть домашний кондиционер, как мне его правильно использовать?
Убедитесь, что ваш кондиционер установлен и обслуживается в соответствии с инструкциями производителя. Прежде чем добавлять в устройство какие-либо химические вещества, прочтите инструкции производителя. Уход за умягчителем обеспечит стабильное качество воды. Это поможет предотвратить проблемы с коррозией.Дополнительно:
- Если вы получаете воду из коммунальной системы водоснабжения, проверьте, смягчается ли вода в вашем районе. Мягкая вода, поставляемая коммунальным предприятием, не требует дополнительного смягчения и может вызвать коррозию вашего дома.
- Убедитесь, что умягчитель настроен на жесткость вашей воды. Если установить слишком высокую жесткость, умягчитель будет стоить дороже в эксплуатации и будет сточить воду, что будет стоить вам дополнительных денег.
- Если в вашем доме новая медная сантехника, не включайте умягчитель воды по крайней мере в течение первых нескольких недель, когда вы используете воду в своем доме.Это поможет сантехнике сформировать защитный минеральный слой, чтобы снизить риск потребления излишков меди. Узнайте больше о меди в питьевой воде.
- Убедитесь, что умягчитель наполнен хлоридом натрия или калия в соответствии с рекомендациями производителя.
- Смягчите только то, что вам нужно. Люди часто предпочитают смягчать душ, раковину и стиральную машину. Туалеты, нагрудники для шлангов, раковины в подвале и другие краны с холодной водой обычно не нужно подключать к смягчителю.Во многих случаях люди предпочитают смягчать только горячую воду.
- В зависимости от качества воды некоторые умягчители могут полностью или частично удалять медь, железо, марганец и радий, а также кальций и магний. Обратите внимание, что медь может повторно попасть в воду после того, как выйдет из смягчителя и пройдет по трубам и водопроводу вашего дома. Эти умягчители могут иметь специальный фильтрующий материал и могут стоить дороже, чем обычные умягчители. Перед тем, как использовать для этой цели умягчитель, следуйте рекомендациям, приведенным в разделе Домашняя очистка воды.
Чтобы решить эти проблемы, обратитесь к инструкциям производителя:
- Засорение : Если ваша вода мутная, это может привести к засорению смолы в смягчителе грязью и глиной. Обратная промывка обычно решает эту проблему. Также может помочь добавление осадочного фильтра перед умягчителем.
- Загрязнение железом или марганцем : Железо или марганец, подвергшиеся воздействию воздуха или хлора, могут забить смолу и помешать ей работать.Это известно как обрастание. Иногда может потребоваться отфильтровать воду, прежде чем она попадет в умягчитель, чтобы предотвратить загрязнение. Если смола загрязняется, доступны коммерческие очистители. Очистители необходимо использовать в соответствии с инструкциями производителя, чтобы избежать загрязнения.
- Бактерии и грибки : Если ваш водопровод не продезинфицирован перед умягчением, на поверхности потенциально могут расти бактерии и грибки. Это может снизить эффективность смягчителя.
Какое влияние на здоровье оказывает домашнее смягчение?
Смягчитель воды, в котором используется хлорид натрия (соль), увеличивает количество натрия в воде, которую вы пьете дома. Если у вас есть кондиционер для дома, примите во внимание следующее:
- Если у вас или у кого-то в вашем доме в анамнезе было высокое кровяное давление, посоветуйтесь с врачом по поводу употребления смягченной воды.
- Вы можете уменьшить количество выпиваемого натрия:
- Имейте кран без смягчения для приготовления и питья.
- Регенерируйте кондиционер с помощью хлорида калия вместо хлорида натрия (соли). Хлорид калия доступен в большинстве магазинов, продающих соль для смягчения.
Кальций, железо и магний, удаляемые при смягчении, не вредны и могут быть полезными источниками основных элементов, необходимых организму. Удаление их из воды может означать, что вам придется получать больше их из своего рациона.
Какое воздействие на окружающую среду оказывает домашнее смягчение?
В Миннесоте растет проблема содержания хлоридов в воде.Хлорид в воде угрожает нашей пресноводной рыбе и другим водным организмам. Хлорид, используемый в домашних умягчителях воды, также может повлиять на воду, используемую для питья. Достаточно одной чайной ложки соли хлорида натрия, чтобы навсегда загрязнить пять галлонов воды. Как только соль окажется в воде, ее нелегко удалить.
В некоторых населенных пунктах домашние умягчители стекают в городские очистные сооружения, которые не предназначены для удаления хлоридов. Хлорид проходит через очистные сооружения и попадает в наши озера и ручьи.В домах с частными колодцами и домашними умягчителями хлорид стекает в септическую систему дома, а затем попадает в озера и ручьи.
Дополнительные ресурсы
Понимание чисел жесткости воды —
Обладая более чем 30-летним опытом работы в сфере очистки воды в жилых и коммерческих помещениях, Марк Нельсон является оператором питьевой воды класса 1 и сертифицированным оператором установки CBWA (Канадская ассоциация бутилированной воды). Как основатель и президент компании Nelson Water в Оттаве, Марк занимается разработкой сложных систем водоподготовки для проблемной воды.Он также возглавляет крупнейший завод по розливу воды в Оттаве с сетью доставки по всей долине.
Жесткая вода может быть запутанной темой, и для ее полного понимания требуются серьезные исследования. Есть несколько цифр, связанных с жесткой водой, и понимание их имеет решающее значение, если вы хотите выбрать правильный смягчитель воды. В этой статье мы объясним некоторые ключевые концепции, что означают числа и как это повлияет на ваш выбор.
A Базовая грунтовка для жесткой воды
Жесткость воды вызвана повышенным содержанием растворенного кальция, магния и, в меньшей степени, железа.Когда вы моете руки, вы можете почувствовать воздействие жесткой воды, и на них останется тонкая пленка или остатки. Это тот минеральный состав, который остается на ваших руках, и вы можете заметить, что вам «нужно» использовать больше мыла. Минералы, вызывающие жесткость воды, препятствуют образованию мыльной пены, что приводит к образованию «мыльной пены». Легко увидеть влияние минералов жесткой воды на вашу сантехнику, если вы заметите образование известкового налета. Пятна от воды, оставшиеся на душевой кабине или на поверхности автомобиля после мытья, представляют собой минеральные отложения, которые остаются после испарения воды.Единственный верный способ избавиться от жесткой воды — это установить смягчитель воды, но в первую очередь следует учитывать ряд факторов.
Объяснение цифр жесткости воды
Если вы посмотрите на устройство для смягчения воды, вы заметите, что на нем есть число жесткости. Жесткость воды выражается в единицах измерения, обычно используются две единицы:
- частей на миллион (ppm).
частей на миллион карбоната кальция, который представляет собой растворенную концентрацию кальция и магния.Это упрощает расчет жесткости воды, где всегда верно следующее.
1 ppm = 1 единица карбоната кальция, растворенного в 1 миллионе единиц воды.
частей на миллион эквивалентно миллиграмму на литр (мг / л), что полезно, когда вы хотите провести сравнение с умягчителями воды, в которых используется количество зерен на галлон (gpg).
- зерен на галлон (галлон)
Как и ppm, зерна на галлон измеряют количество зерен карбоната кальция в галлоне воды.
Тестирование воды в доме
Если вы городской домовладелец, вы можете проверить свой текущий уровень жесткости воды на своей городской веб-странице. Если вы сельский домовладелец, вы можете купить в Интернете набор для измерения жесткости воды. Два самых популярных варианта — это тест-полоски и наборы для фильтрации. Они оба просты в использовании, и инструкции легко выполнять. Оба типа тестов указывают на наличие жесткой воды с изменением цвета в зависимости от серьезности проблемы.
Результаты испытаний воды
Если ваша полоска для измерения жесткости воды или набор для фильтрации показали результат 1 г / г (17,1 ppm), поздравляем, у вас мягкая вода. Но если у вас число выше этого, у вас проблемы с жесткой водой. Чем выше число, тем жестче ваша вода и тем серьезнее будут проблемы, которые она вызывает.
Одно зерно на галлон (gpg) равно 17,14 частей на миллион (ppm).
Когда дело доходит до проверки жесткости воды, вы заметите, что gpg является наиболее часто используемым измерением.Но жесткость воды можно измерить в галлонах на галлон или промилле, и полезно понимать различия, чтобы проводить точные сравнения.
Вместимость большинства имеющихся умягчителей воды находится в диапазоне от 20 000 до 80 000 галлонов на галлон. Но вам может понадобиться смягчитель воды большего или меньшего размера в зависимости от других факторов, таких как ежедневное использование воды и количество людей, живущих в вашем доме. Умягчитель воды должен быть тщательно подобран к вашему дому, если вы хотите оптимальную производительность и эффективность.
Удобный справочник жесткости воды
Трудно представить себе эти цифры жесткости воды так, чтобы они подходили для вас и вашего дома.Итак, мы составили это удобное руководство, чтобы показать, как возрастающий уровень жесткости воды влияет на средний дом.
0-3 г / г: смягчение воды не требуется
Как мы упоминали ранее, результат теста воды 1 г / г или ниже указывает на то, что у вас мягкая вода. Но, если у вас будет 3 галлона на галлон, влияние жесткой воды на ваш дом будет незначительным. При расходе 0–3 галлона смягчение воды не требуется.
3-7 gpg: Умеренно жесткая вода
Когда gpg превышает 3 — 7 gpg, вода относится к категории умеренно жесткой.В вашем доме это будет замечено как участки сухой кожи после мытья, купания и душа. Открыв посудомоечную машину, вы можете заметить, что она покрыта пятнами (растворенные минералы), и попытаетесь вымыть ее снова с аналогичным результатом.
7-11 г / г: жесткая вода
В пределах этого диапазона gpg вода считается жесткой, и вы, вероятно, заметите много проблем в своем доме. Самым очевидным признаком может быть образование корки белого налета на сантехнике. Это известковый налет, его можно очистить белым уксусом и большим количеством смазки для локтей, но он всегда возвращается, потому что вода все еще жесткая.Этот известковый налет также накапливается внутри ваших водопроводных труб, где он сужает диаметр трубы, что приводит к потере давления воды. В конце концов, водопроводная труба будет полностью заблокирована, и профессиональный сантехник должен будет заменить целые участки трубы. Вы также можете заметить красные / коричневые пятна на фарфоровых поверхностях и в белье из-за чрезмерной концентрации железа в вашей воде.
11-15 г / г: очень жесткая вода
Эта серия жесткой воды действительно считается очень жесткой, и вы постоянно будете замечать все ранее упомянутые проблемы.
15+ gpg: очень жесткая вода
На этом уровне водоснабжение просто невозможно использовать ежедневно.
Что ты умеешь?
Если тестирование воды в вашем доме показывает, что у вас жесткая вода более 3 галлонов на 100 фунтов, что вы можете сделать с этой проблемой? Городские поставщики воды не обрабатывают воду на жесткость, а сельские домовладельцы несут ответственность за качество своей воды. Но есть много способов уменьшить жесткость воды с помощью системы смягчения или кондиционирования.Если в вашей воде слишком много железа, их можно удалить с помощью специализированных систем очистки воды. Также можно установить предварительный фильтр для удаления отложений и мусора, чтобы защитить устройство для смягчения воды и удалить мутность. Если вас беспокоит жесткость питьевой воды, обратитесь к местному специалисту по очистке воды за советом.
Жесткость воды — обзор
5.2.2. Builder Systems
Сегодняшние строители почти полностью связаны с синтетическими поверхностно-активными веществами.Причина их использования заключается в улучшении или наращивании системы поверхностно-активных веществ для повышения эффективности очистки в широком диапазоне условий использования. К химическим веществам, которые классифицируются как добавки, относятся фосфаты, силикаты, карбонаты, этилендиаминтетраацетат (ЭДТА) и глюконаты. Строители действуют путем связывания с ионами металлов, помогая удалить их с подложки и способствуя их растворению или диспергированию. Таким образом, они помогают детергентам удалять и рассеивать твердые загрязнения.
Добавки, смягчающие воду, очень важны.В мягкой воде мало или совсем нет свободных ионов жесткости, что помогает удерживать моющие средства и загрязнения в растворе, позволяя моющему средству лучше очищать и полоскать. Жесткая вода снижает моющие свойства и затрудняет смывание грязи. Кольцо для ванны — прекрасный пример того, как жесткая вода мешает процессу очистки. Ионы кальция и магния вступают в реакцию с ингредиентами чистящего раствора, образуя нерастворимую пленку, которую трудно смыть из ванны.
Есть проблемы с использованием некоторых конструкторов.Фосфаты, например, являются необходимыми питательными веществами для поддержания жизни растений. Однако слишком много фосфата в водной экосистеме может привести к эвтрофикации или отмиранию водной системы [13]. Свойства системы
Builder, связанные с производительностью, обычно включают следующее:
- •
Секвестрация жесткой воды.
- •
Дефлокуляция почвы.
- •
Обеспечивает щелочность.
- •
Диапазон pH буферного раствора.
Идеальный строитель обладал бы всеми этими качествами. Однако комбинированные системы из двух или более ингредиентов вместе могут более эффективно выполнять эти функции. Кроме того, любая строительная или строительная комбинация должна быть стабильной в растворе. В наш век экологических и нормативных требований столь же важно, что любой строитель должен соответствовать жестким критериям безопасности человека и экологической приемлемости.
У каждого типа построителя есть отличные друг от друга функциональные возможности.Некоторые строители предназначены для удаления почвы, а другие лучше умягчают воду. В любом случае, добавка предназначена для облегчения процесса очистки, обеспечивая лучшее полоскание и меньшее количество остатков.
Самая важная функция строителя — смягчение последствий жесткости воды. Строители делают это, связывая или связывая ионы кальция и магния в воде, которые в свободном состоянии могут нанести вред процессу очистки. Свободные ионы жесткости воды могут отрицательно влиять на характеристики анионных поверхностно-активных веществ, заставляя их выделяться из раствора.
Вторая по важности функция строителя — измельчение и диспергирование твердых частиц почвы. Это помогает удалить, рассредоточить и приостановить частицы почвы для эффективного удаления. Это очень важно для удаления с волокон глинистых загрязнений. Сложные фосфаты и силикатные добавки могут изменять адсорбцию моющего средства на подложке и / или почве, а также действовать как суспендирующие агенты.
Строители должны обеспечивать безопасный уровень щелочности для обеспечения хорошей очистки.Буферизация — это способность поддерживать pH чистящего раствора в узком диапазоне, несмотря на добавление умеренных количеств кислот или основания. Некоторые составы обеспечивают как щелочность, так и буферную способность. В таких системах, когда щелочность уменьшается, способность модификатора действовать как буфер уменьшается.
5.2.2.1. Различные типы модификаторов
В зависимости от конкретного модификатора, умягчение воды может осуществляться посредством хелатирования или связывания, ионного обмена или осаждения.По словам Уллы, использование строительных систем, которые действуют исключительно за счет атмосферных осадков (обычно на основе щелочей или монофосфатов), в Северной Америке устарело. Несмотря на то, что системы на основе карбоната натрия, содержащие полимерные соединения и / или смеси других модификаторов, продолжают оставаться популярными [14]. Используемые системы нефосфатных модифицирующих добавок состоят из смеси модифицирующих добавок и со-модификаторов.
Уллах также указывает, что строители комплексообразующего типа можно разделить на два типа: те, которые содержат фосфор (фосфаты), и те, которые не содержат.Эти соединения действуют, хелатируя ионы жесткости воды, удерживая их в растворе и не позволяя им влиять на свойства поверхностно-активного вещества. С конца 1960-х годов использование фосфатных модификаторов, таких как триполифосфат натрия (STPP), все чаще подвергается критике из-за предполагаемого вклада в раннюю эвтрофикацию (непреднамеренное удобрение) водоемов [14].
Фосфаты включают пирофосфаты, триполифосфаты и метафосфаты. Фосфаты обладают необычной способностью пептизировать и суспендировать определенные глины, пигменты и другие мелкодисперсные твердые вещества в водных растворах.Отчасти это связано с улавливающей способностью фосфатов. В то время как значительные исследования были посвящены разработке строительных материалов без фосфатов, лишь немногие из них были коммерциализированы.
ЭДТА — один из наиболее распространенных модификаторов, который особенно хорошо удаляет кальций и магний, способствуя смягчению воды. Благодаря своей эффективности ЭДТА содержится в широком спектре промышленных и потребительских товаров. EDTA захватывает ионы металлов за счет хелатирования и образует очень прочные комплексы с металлами, что затрудняет отделение ионов металлов от потока воды.Таким образом, могут возникнуть проблемы с высоким содержанием металлов в сточных водах из-за EDTA.
5.2.2.2. Полимерные системы
Водорастворимые полимеры используются в сочетании с другими компонентами моющих средств для оптимальной очистки и затрат. Эти полимеры разработаны для использования при очистке с высокими нагрузками на почву, в условиях жесткой воды и умеренной температуры. Они предназначены для облегчения очистки за счет диспергирования твердых частиц, предотвращения повторного осаждения загрязнений и связывания минеральных ионов, таких как ионы кальция и магния.Например, полиакриловые кислоты, полиакрилаты, сополимеры акриловой и малеиновой кислоты — вот некоторые типы полимеров, используемые для чистки ковров.
Кроме того, полимерные материалы, такие как смола стирол / малеиновый ангидрид (SMA), сополимеры акрилата, фторсодержащие акрилаты и т. Д., Также используются в составах для чистки ковров для придания защитных свойств от повторного загрязнения и окрашивания.
5.2.2.3. Ароматизаторы
Ароматы добавляются к средствам для чистки ковров, чтобы придать им приятный и характерный аромат.Ароматические материалы используются для выполнения трех функций независимо от аромата. Они нейтрализуют химический запах продукта и запах грязи в восстановленном чистящем растворе. Они придают ковровым тканям и окружающей атмосфере приятный запах, тем самым усиливая чистоту продукта. Кроме того, аромат отличает продукт, чтобы сформировать характер этого продукта.
5.2.2.4. Растворители
Растворители удаляют жир и масло и улучшают общие очищающие свойства состава для чистки ковров.Кроме того, определенные типы растворителей используются в рецептурах для получения прозрачных стабильных продуктов. Однако сегодня средства для чистки ковров для дома разработаны с учетом нормативных требований и требований охраны окружающей среды. Из-за этих требований, по опыту автора, включение достаточного количества растворителя для обеспечения эффективности и действенности может быть трудным, и все больше и больше составов основаны на системах поверхностно-активных веществ.
5.2.2.5. Источник воды
Вода — самый распространенный ингредиент, используемый в средствах для чистки ковров на водной основе.Тип и количество примесей, содержащихся в воде, различаются в зависимости от источника (озеро, река или колодец) и географического района. Городская вода содержит растворенные ионы кальция, магния, железа и других материалов, которые выше определенного уровня считаются «жесткой водой». Жесткость муниципальной воды варьируется и может составлять от 50 до более 250 частей на миллион (ppm). Кроме того, pH воды может варьироваться от примерно 6,5 или выше, если вода поступает из колодцев и резервуаров.
При разработке чистящих средств важно знать качество воды.Хотя агенты обычно добавляются для противодействия ионам жесткости воды, они могут быть частично истощены в процессе смешивания за счет реакции с ионами жесткости необработанной воды. В идеале вода, используемая для приготовления чистящих средств, должна быть обработана для удаления ионов жесткости и следов металлов.
Худые на умягчителях воды
Многие из нас сталкивались с неприятными последствиями жесткой воды: грязной одеждой, отложениями на стеклянной посуде и кухонных принадлежностях, отложениями накипи в трубах и сантехнике и т. Д.Неудивительно, что смягчители воды — популярный предмет домашнего обихода.
Мягкая вода имеет ряд заметных преимуществ. Среди прочего, он может продлить срок службы и повысить эффективность водонагревателей, посудомоечных машин и других приборов, что потенциально позволяет сэкономить воду, энергию и использование моющих средств.
Основным недостатком солевых ионообменных умягчителей воды является хлорид, который они производят и сбрасывают в септические или канализационные системы. Хлорид из соли может просачиваться в грунтовые воды и загрязнять их из местных септических систем.Хлорид также попадает в окружающую среду через очистные сооружения. Поскольку устройства не предназначены для его удаления, хлорид попадает в реки, озера и ручьи. Высокий уровень хлоридов в окружающей среде токсичен для рыб и водных организмов.
Варианты смягчения
Если у вас есть устройство для смягчения воды или вы думаете о его приобретении, прочтите некоторые стратегии, которые могут помочь уменьшить их воздействие на окружающую среду.
| Степень твердости | Карбонат кальция: | Карбонат кальция: зерен на галлон |
|---|---|---|
| Мягкий | 0–60 | 0 — 3.5 |
| Умеренно твердый | 60–120 | 3,5 — 7 |
| Жесткий | 120-180 | 7 — 10,5 |
| Очень твердый | Более 180 | Более 10,5 |
Определите, действительно ли он вам нужен. Жесткость определяется содержанием в воде минералов, в основном кальция и магния — чем больше минералов присутствует, тем жестче вода.Подземные воды обычно более твердые, чем речные или озерные. В таблице справа представлена общая классификация жесткости воды. Вы можете приобрести комплект для измерения жесткости, если у вас есть доступ к воде, не прошедшей через умягчитель (например, из крана на открытом воздухе).
Перед покупкой умягчителя протестируйте воду на жесткость или обратитесь за информацией в свой город. Узнайте в вашем водоканале, происходит ли смягчение воды на этапе очистки питьевой воды. Миннеаполис, св.Пол, Блумингтон и несколько других городов Миннесоты используют умягчение извести или другие предварительные методы для смягчения воды, что устраняет или уменьшает необходимость в очистке воды в домашних условиях.
Уменьшить количество соли . Смягчайте только ту воду, которая в этом нуждается. Не смягчайте воду из кранов или из кранов с холодной питьевой водой. Размягчайте только до оптимальной жесткости — чрезмерное умягчение приводит к потере соли и воды и приводит к избытку хлоридов. Проверьте настройки вашего устройства и отрегулируйте, если они слишком высокие — возможно, оборудование было предварительно настроено на излишне высокий уровень на заводе.
Как уменьшить общее потребление воды . Это будет иметь экологические и экономические преимущества, включая меньшую потребность в умягчении воды. Найдите идеи о том, как можно сэкономить воду.
Настройте таймер . Если вы используете меньше воды из-за изменения размера дома или из-за того, что вы установили водосберегающие приборы и приспособления, а ваш умягчитель воды работает по таймеру, вы можете увеличить время между циклами регенерации. Чем меньше регенерация, тем меньше хлоридов в сточных водах.
Обновление до высокоэффективного умягчителя воды. Если вы покупаете или переходите на новый смягчитель воды (хорошая идея, если у вас есть более старая установка), ищите тот, который отличается высокой солевой эффективностью и ориентирован на спрос. Хотя вы можете заплатить немного больше вперед, вы сэкономите на соли и произведете меньше хлоридов.
Перейти с услугой . Другой вариант — подписаться на услугу обмена. Компания поставляет водообменные емкости для умягченной воды заказчику в соответствии с графиком, определяемым размером домохозяйства и уровнем жесткости воды.Вынутые резервуары регенерируются на специальном предприятии, что избавляет потребителей от управления сливом соли и раствора.
Узнать больше
- Качество хлоридов и воды. Подробная информация о хлоридах и качестве воды в Миннесоте. Включает предложение по политике Рабочей группы по хлоридам.
- Умягчение воды в домашних условиях: часто задаваемые вопросы. Сотрудничество между MDH и MPCA для демонстрации преимуществ и недостатков бытовых умягчителей воды.
- Умягчение бытовой воды.Информация о том, как умягчение воды в домашних условиях влияет на озера и ручьи Миннесоты, а также на ресурсы для оценки умягчения в жилых помещениях (Центр водных ресурсов, Университет Миннесоты)
- В недавней статье Pipestone County Star описывается план города по умягчению воды на заводе по производству питьевой воды, что снизит или устранит потребность в домашних умягчителях воды.
- Факты о смягчителях воды, регион Ватерлоо и город Гвельф. Веб-сайт правительства Канады содержит полезную информацию о том, как работают смягчители воды, на что обращать внимание при покупке одного, альтернативы смягчителям воды и многое другое.
- Информация о жесткости воды. Краткий информативный обзор жесткости воды и смягчителей воды (Департамент здравоохранения и окружающей среды округа Вашингтон)
- Влияние хлоридов из сточных вод на окружающую среду, Центр малых городов, Университет Миннесоты, Моррис. В отчете за 2013 год обсуждается связь между домашними умягчителями воды и хлоридным загрязнением водосбора реки Помм-де-Терре.
Жесткая вода, описание и варианты очистки
Жесткая вода, описание и варианты очисткиЖесткая вода
Жесткая вода — очень распространенная проблема, влияющая на воду в чем 85% страны.Это результат растворенных минералов. кальций, магний и марганец. При увеличении этих минералов видны (1):
- Мыльная пена в раковинах и ваннах
- Кольца для ванны
- Пятна на посуде или дверце душа
- Пониженная пенообразующая и очищающая способность мыла и моющие средства
- Тусклая и пожелтевшая одежда с остатками мыла, которые требуется дополнительное полоскание для удаления
- Трубы забиты из-за отложений минералов
- Повышенные затраты на нагрев воды из-за накопления минералов, снижение КПД водонагревателей
- Возможные кожные инфекции от бактерий, застрявших в порах под мыльную пену
Хотя все это неприятные эффекты, жесткая вода не опасность для здоровья человека и поддается лечению.
Если вы подозреваете, что у вас жесткая вода, ее можно проверить. Если Вы подключены к водопроводу, позвоните в водопровод суперинтенданта или мэрии и спросите, жесткая ли вода. если ты находятся в частной поставке, соберите образец в утвержденном контейнер и отнесите в испытательную лабораторию или отправьте в свой город или государственный департамент здравоохранения для тестирования.
Вода считается жесткой, если ее содержание превышает 3 зерна на галлон. (GPG). GPG эквивалентен 17.1 PPM, поэтому, если ваша вода составляет 171 PPM, то ваша жесткость составляет 10 GPG (2).
Когда результаты возвращены вам и ваша вода окажется трудно, вам доступны несколько вариантов. Самый распространенный способ умягчения воды через ионный обмен воды смягчитель. Эта система работает путем обмена положительно заряженных минералы жесткости (кальций и магний) с положительно заряженными минералы мягкости (натрий или калий) на поверхности смолы, которая регенерируется.Этот обмен минералов смягчает воду и может продлить срок службы сантехнических систем, так как засорение труб. Остатки, включая мыльную пену и пятна посуды, тоже должно уменьшиться.
В настоящее время существует три основных типа переноса ионов. смягчители. Первый — это автоматический кондиционер. Этот тип умягчитель подключен к таймеру, который в определенное время Интервалы времени запускают процесс регенерации с промывки твердые ионы прилипают к смоле и заменяют их мягкими ионы.Это позволяет постоянно обмениваться жесткими и мягкими ионы в течение дня. Второй тип пластификатора — это регенерация по запросу (DIR). С этой системой регенерация происходит только после того, как закончилась мягкая вода. Поскольку это система подстраивается под количество используемой воды в отличие от автоматический тип, он потребляет меньше соли и воды и более эффективный. Последний умягчитель — это переносная замена. Здесь танк сдан в аренду домовладельцу и имеет регенерированную смолу.Когда смола больше не может обменивать ионы, бак возвращается в Компания и восстановлена там (1,2).
Чтобы выбрать систему, которая соответствует вашим потребностям, лучше всего попросите представителей разных компаний проверить ваш сантехника и дадим вам оценку. Затем спросите своих соседей, какие компаний, которые они используют, и если у них есть проблемы с их служба. Свяжитесь с Better Business Bureau, чтобы узнать, вы выбираете какие-либо проблемы с обслуживанием клиентов.
Артикул:
- Основы качества воды. Служба Ассоциация качества воды, Лайл, Иллинойс. http: www.wqa.org/WQIS/wqb-hardwater.html. (1996).
- «Легкий способ тестирования», услуга Сиуксленда, собрание организаций Среднего Запада на интернет. http://www.siouxlan.com/siouxlan/commercial/water/faq.html # tsO . (без даты).
Эта страница была подготовлена S.L. Кейсер, UCD EXTOXNET
Команда FAQ.
июнь 1997
Часто задаваемые вопросы по умягчителю воды
1. Жесткая вода1.1 Что такое жесткая вода?
Когда воду называют «жесткой», это просто означает, что она содержит больше минералов, чем обычная вода. Это особенно минералы кальций и магний. Степень жесткости воды увеличивается, когда растворяется больше кальция и магния.
Магний и кальций — положительно заряженные ионы. Из-за их присутствия другие положительно заряженные ионы менее легко растворяются в жесткой воде, чем в воде, не содержащей кальция и магния.
Это причина того, что мыло не растворяется в жесткой воде.
1.2 В каких отраслях промышленности ценится жесткость воды?
Во многих промышленных применениях, таких как подготовка питьевой воды, на пивоваренных заводах и при производстве газированных напитков, а также для охлаждающей и питательной воды для котлов, жесткость воды очень важна.
2. Умягчение воды
2.1 Что такое умягчение воды?
Когда вода содержит значительное количество кальция и магния, она называется жесткой водой. Известно, что жесткая вода забивает трубы и затрудняет растворение мыла и моющих средств в воде.
Умягчение воды — это метод, который служит для удаления ионов, которые делают воду жесткой, в большинстве случаев ионов кальция и магния. Ионы железа также можно удалить во время умягчения.
Лучший способ смягчить воду — это использовать устройство для смягчения воды и подключить его непосредственно к водопроводу.
2.2 Что такое смягчитель воды?
Устройство для смягчения воды — это устройство, которое используется для смягчения воды путем удаления минералов, которые делают воду жесткой.
2.3 Почему применяется смягчение воды?
Умягчение воды — важный процесс, потому что жесткость воды в домах и на предприятиях уменьшается во время этого процесса.
Жесткая вода может забивать трубы, и мыло не так легко растворяется в ней. Умягчение воды может предотвратить эти негативные эффекты.
Жесткая вода вызывает более высокий риск образования известковых отложений в системах водоснабжения дома. Из-за накопления известкового налета трубы блокируются, и эффективность горячих котлов и резервуаров снижается. Это увеличивает стоимость нагрева воды для бытового потребления примерно на пятнадцать-двадцать процентов.
Еще одним негативным эффектом известкового налета является то, что он оказывает вредное воздействие на бытовую технику, например стиральные машины.
Умягчение воды означает увеличение срока службы бытовой техники, такой как стиральные машины, а также срока службы трубопроводов. Это также способствует улучшению работы и увеличению срока службы солнечных систем отопления, кондиционирования воздуха и многих других применений на водной основе.
2.4 Что делает умягчитель воды?
Умягчители воды — это специальные ионообменники, предназначенные для удаления положительно заряженных ионов.
Умягчители в основном удаляют ионы кальция (Ca 2+ ) и магния (Mg 2+ ).Кальций и магний часто называют «минералами жесткости».
Пластификаторы иногда даже применяются для удаления железа. Смягчающие устройства могут удалять до пяти миллиграммов на литр (5 мг / л) растворенного железа. Умягчители
могут работать в автоматическом, полуавтоматическом или ручном режиме. Каждый тип оценивается по степени твердости, которую он может удалить до того, как потребуется регенерация.
Устройство для смягчения воды собирает минералы жесткости в своем резервуаре для кондиционирования и время от времени смывает их в канализацию.
Ионообменники часто используются для умягчения воды. Когда ионообменник применяется для смягчения воды, он заменяет ионы кальция и магния в воде другими ионами, например натрием или калием. Ионы теплообменника добавляются в резервуар ионообменника в виде солей натрия и калия (NaCl и KCl).
2,5 Как долго прослужит смягчитель воды?
Хороший умягчитель воды прослужит много лет. Умягчители, которые поставлялись в 1980-х годах, могут все еще работать, и многие из них не нуждаются в небольшом обслуживании, кроме периодического наполнения их солью.
3. Умягчающие соли3.1 Какие типы соли продаются для использования в установках для умягчения воды?
Для смягчения воды обычно продаются три типа соли:
— Каменная соль
— Солнечная соль
— Испаренная соль
Каменная соль как минерал встречается в естественных условиях в земле. Его получают из подземных солевых отложений традиционными методами добычи. Он содержит от девяноста восьми до девяноста девяти процентов хлорида натрия. Он имеет уровень нерастворимости в воде около 0.5-1,5%, в основном это сульфат кальция. Его важнейший компонент — сульфат кальция.
Солнечная соль как природный продукт получают в основном путем испарения морской воды. Он содержит 85% хлорида натрия. Его уровень нерастворимости в воде составляет менее 0,03%. Обычно он продается в кристаллической форме. Иногда его также продают в гранулах.
Испаренная соль добывается подземными соляными месторождениями растворяющейся соли. Затем влага испаряется, используя энергию природного газа или угля.Выпаренная соль содержит от 99,6 до 99,99% хлорида натрия.
3.2 Должны ли мы использовать каменную соль, выпаренную соль или солнечную соль в смягчителе воды?
Каменная соль содержит много веществ, не растворимых в воде. В результате, при использовании каменной соли резервуары для умягчения необходимо очищать гораздо чаще. Каменная соль дешевле, чем испаренная соль и солнечная соль, но очистка резервуара может занять у вас много времени и энергии.
Солнечная соль содержит немного больше нерастворимых в воде веществ, чем испаренная соль.Когда кто-то принимает решение о том, какую соль использовать, следует учитывать, сколько соли используется, как часто умягчитель нуждается в очистке, а также о конструкции умягчителя. Если потребление соли невелико, продукты можно использовать поочередно.
Если используется большое количество соли, нерастворимые соли будут накапливаться быстрее при использовании солнечной соли. Кроме того, резервуар потребуется более частая очистка. В этом случае рекомендуется выпаренная соль.
3.3 Вредно ли смешивать разные виды соли в смягчителе воды?
Как правило, смешивать соли в смягчителе воды не вредно, но есть типы смягчителей, которые предназначены для определенных продуктов для смягчения воды.При использовании альтернативных продуктов эти смягчители не будут работать должным образом.
Не рекомендуется смешивать испаренную соль с каменной солью, так как это может привести к засорению резервуара для умягчения. Рекомендуется, чтобы вы позволили вашему устройству освободиться от одного типа соли перед добавлением другой, чтобы избежать возникновения каких-либо проблем.
3.4 Как часто нужно добавлять соль в умягчитель?
Соль обычно добавляется в резервуар во время регенерации умягчителя. Чем чаще регенерируется умягчитель, тем чаще нужно добавлять соль.
Обычно установка для смягчения воды проверяется раз в месяц. Чтобы гарантировать удовлетворительное производство мягкой воды, уровень соли всегда должен быть как минимум наполовину полным.
3.5 Почему вода иногда не становится мягче при добавлении соли?
Прежде чем соль начнет работать в водоумягчителе, ей необходимо некоторое время нахождения в резервуаре, поскольку соль растворяется медленно. Если сразу начать регенерацию после добавления соли в резервуар, смягчитель воды может не работать в соответствии со стандартами.
Если умягчение воды не происходит, это также может указывать на неисправность умягчителя или проблему с применяемой солью.
4.1 Сколько стоит умягчитель воды?
Некоторые смягчители более эффективны, чем другие, поэтому призы могут отличаться. Доступны умягчители с таймером и умягчители с водосчетчиком. Установки с водосчетчиком производят самую мягкую воду на фунт соли.
Некоторые умягчители работают на электричестве, но некоторые более современные умягчители используют воду. Стоимость смягчителя воды в значительной степени зависит от типа смягчителя воды и типа используемой энергии, а также от жесткости воды, которая нуждается в смягчении, и использования воды. Когда вода очень жесткая и используется интенсивно, затраты на умягчение возрастают.
Обычно стоимость устройства для смягчения воды может варьироваться от 0,20 до 0,40 евро в день.
Затраты на умягчители обычно намного перевешиваются выгодами и экономией средств, полученными за счет использования умягченной воды.
4.2 Сколько стоит установка для смягчения воды во время эксплуатации?
Текущие расходы — это просто стоимость соли. Скорее всего, это будет около 1,95 евро на человека в месяц.
5. Умягчение питьевой воды5.1 Всегда ли производящие воду компании производят умягченную воду?
Хотя производители воды имеют возможность производить умягченную воду, они не всегда это делают. Компании по производству воды достаточно добавить смягчитель воды в свою систему очистки воды, чтобы производить умягченную воду с меньшими затратами.
Но тогда у потребителей не будет выбора пить не умягченную воду.
Проблемы с жесткой водой чаще всего возникают при нагревании воды. В результате жесткая вода не создает особых проблем для водоснабжающих компаний, особенно когда по их трубам течет только холодная вода.
5.2 Можно ли пить смягченную воду?
Умягченная вода по-прежнему содержит все необходимые нам природные минералы. Он только лишен содержания кальция и магния, а в процессе размягчения добавляется немного натрия.Вот почему в большинстве случаев смягченная вода совершенно безопасна для питья. Рекомендуется, чтобы смягченная вода содержала не более 300 мг / л натрия.
На участках с очень высокой жесткостью нельзя использовать умягченную воду для приготовления детского молока из-за высокого содержания натрия после завершения процесса умягчения.
5.3 Может ли соль из установок умягчения попадать в питьевую воду?
Соль не может попадать в питьевую воду через умягчительные установки.
Единственное назначение соли в смягчителе воды — регенерировать шарики смолы, снижающие жесткость воды.
5.4 Сколько натрия поглощает умягченная вода?
Поглощение натрия через умягченную воду зависит от жесткости воды. В среднем, потребление смягченной воды составляет менее 3%.
По оценкам, человек потребляет от двух до трех чайных ложек соли в день из различных источников. При ежедневном потреблении пяти граммов натрия с пищей и трех квартах воды вклад натрия (Na +) в воду в результате процесса умягчения воды в домашних условиях минимален по сравнению с общим дневным потреблением многих богатых натрием продукты.
5.5 Не лишит ли смягчение питьевая вода необходимых минералов?
Умягчение не лишит воду необходимых минералов. Умягчение лишает питьевую воду только минералов, которые делают воду жесткой, таких как кальций, магний и железо.
6. Уход за пластификатором 6.1 Когда требуется замена пластификатора?
Когда вода не становится достаточно мягкой, следует в первую очередь учитывать проблемы с используемой солью или механические неисправности компонентов умягчителя.Если эти элементы не являются причиной неудовлетворительного умягчения воды, возможно, пришло время заменить смолу-умягчитель или, возможно, даже весь умягчитель.
По опыту мы знаем, что срок службы большинства пластификаторов и ионообменных смол составляет от двадцати до двадцати пяти лет.
6.2 Требуется ли очистка солевого бака для умягчителя?
Обычно нет необходимости в очистке солевого бака, если в используемом солевом продукте не содержится много нерастворимых в воде веществ или если имеется серьезная неисправность какого-либо рода.
Если в смоле скопилось нерастворимое вещество, необходимо очистить резервуар, чтобы предотвратить неисправность умягчителя.
6.3 Что такое «месиво» и почему его следует избегать?
Когда в смоле используются слабо уплотненные гранулы соли или соль в форме куба, они могут образовывать крошечные кристаллы выпаренной соли, похожие на поваренную соль. Эти кристаллы могут склеиваться, образуя густую массу в солевом баке. Это явление, широко известное как «перемешивание», может прервать производство рассола.Производство рассола — самый важный элемент для освежения шариков смолы в умягчителе воды. Без производства рассола устройство для смягчения воды не может производить мягкую воду.
7. Эксплуатационные вопросы умягчителя7.1 Может ли рассол умягчителей повредить септик?
Ассоциация качества воды провела исследования по этому вопросу. Эти исследования показали, что правильно установленный септик, который работает должным образом, не может быть поврежден рассолом, сливаемым из устройства для смягчения воды.А умягченная вода иногда может даже помочь уменьшить количество моющих средств, сливаемых в септик.
7.2 Можно ли использовать смягчитель воды со свинцовыми трубами?
Системы свинцовых труб необходимо заменить, прежде чем через них сможет течь умягченная вода. Хотя системы свинцовых труб в районах с жесткой водой могут не вызывать проблем, все же рекомендуется их заменить. Когда естественная или искусственно умягченная вода попадает в эти системы свинцовых трубопроводов, это может вызвать накопление свинца.
7.2 Можно ли измерить жесткость воды на линии?
Да, хотя система измерения в основном применяется в промышленных установках умягчения воды.
Встроенный измеритель жесткости воды Testomat
8.1 Можно ли брать с собой смягчитель воды во время переезда?
Современные водоумягчители позволяют брать их с собой во время переезда. При установке используются быстроразъемные соединения, аналогичные тем, которые используются в стиральных машинах.
Все, что нужно сделать, это закрыть впускной и выпускной клапаны умягчителя и открыть перепускной клапан, позволяя жесткой воде течь в накопительный бак и бытовые краны. После этого умягчитель можно отключить, переместить на новое место и разместить там.
8.2 Можно ли сбрасывать отходы устройства для смягчения воды прямо в сад?
Поскольку рассол изменяет осмотическое давление, на которое растения полагаются для регулирования потребностей в воде, следует избегать прямого сброса рассола хлорида натрия или калия.
8.3 Может ли смягченная вода помочь при сухой коже?
Следует отметить случаи, когда люди с сухой кожей получали пользу от смягчения воды, потому что мягкая вода более благоприятна для волос и кожи.
Рекомендуемая литература по теме: Устройство для смягчения воды
Другие интересные страницы: История очистки воды
Новичок: Химия воды
Начинающий: Химия водыЧто вам нужно знать о химии воды и почему?
Вода в природе редко бывает чистой в смысле «дистиллированной воды»; Это содержит растворенные соли, буферы, питательные вещества и т. д., с точным концентрация зависит от местных условий. Рыба (и растения) имеют эволюционировали за миллионы лет до конкретных условий воды в в их естественной среде обитания и может быть не в состоянии разные среды.
Новичкам (и особенно ленивым) следует выбирать простой подход выбора рыбы, потребности которой соответствуют качеству их обычного водопровода воды. Как вариант, продвинутый (и энергичный!) Аквариумист может изменить характеристики воды в соответствии с потребностями рыбы, хотя сделать это почти всегда труднее, чем кажется на первый взгляд.В в любом случае вам необходимо знать достаточно о химическом составе воды, чтобы что вода в вашем аквариуме имеет нужные свойства для рыб, которых вы хранятся.
Вода имеет четыре обычно используемых измеримых свойства чтобы охарактеризовать его химию. Они есть:
- pH относится к воде, которая является кислотой, основанием или ни одной из них.
(нейтральный). PH 7 считается нейтральным, pH ниже 7 — «кислым».
и pH выше 7 являются «основными» или «щелочными». Как шкала Рихтера
шкала pH, используемая для измерения землетрясений, является логарифмической.PH 5,5
в 10 раз кислотнее воды при pH 6,5. Таким образом, изменение
pH в небольшом количестве (внезапно) — это скорее химическое изменение (и более
стресс для рыбалки!), чем может показаться на первый взгляд.
Для рыбовода важны два аспекта pH. Во-первых, быстрые изменения pH вызывают стресс для рыб, и их следует избегать. Изменение pH на известно, что более 0,3 единицы в день вызывают стресс у рыб. Таким образом, вы хотите pH вашего аквариума, чтобы оставаться постоянным и стабильным в течение длительного времени. Во-вторых, рыба приспособилась к жизни в (иногда узком) диапазоне pH.Вы хотите быть уверены, что pH вашего аквариума соответствует определенному потребности рыбы, которую вы держите.
Большинство рыб могут приспосабливаться к pH, выходящему за пределы оптимального диапазоны. Если pH вашей воды естественным образом находится в диапазоне от 6,5 до 7.5 вы сможете содержать большинство видов рыб без проблемы. Если ваш pH находится в этом диапазоне, вероятно, нет нужно отрегулировать его вверх или вниз.
- Буферная способность означает способность воды поддерживать pH.
стабильна при добавлении кислот или оснований.pH и буферная способность
переплетаются друг с другом; хотя можно подумать, что добавление
равные объемы кислой и нейтральной воды приведут к pH
На полпути это редко случается на практике. Если в воде есть
достаточная буферная емкость, буферная емкость может поглощать и
нейтрализовать добавленную кислоту без значительного изменения pH.
Концептуально буфер действует как большая губка. Как более
добавляется кислота, «губка» впитывает кислоту, не меняя pH
много.Однако емкость «губки» ограничена; после буферизации
емкость исчерпывается, pH изменяется быстрее, чем добавляются кислоты.
Буферизация имеет как положительные, так и отрицательные последствия. О плюсе Кроме того, цикл нитрификации производит азотную кислоту (нитрат). Без буферизация, pH вашего аквариума со временем упадет (плохо). С достаточная буферизация, pH остается стабильным (хорошо). На отрицательная сторона, жесткая водопроводная вода часто почти всегда имеет большой буферная емкость. Если pH воды слишком высок для вашей рыбы, буферная способность затрудняет снижение pH до более соответствующее значение.Наивные попытки изменить pH воды обычно сбой, поскольку игнорируются эффекты буферизации.
В пресноводных аквариумах большая часть буферной способности воды обусловлена карбонатам и бикарбонатам. Таким образом, термины «карбонатная жесткость» (KH), «щелочность» и «буферная емкость» взаимозаменяемы. Хотя технически это не одно и то же, они эквивалентны в практика в контексте рыбоводства. Примечание: термин «щелочность» не следует путать с термином «щелочной». Щелочность относится к буферизация, а акалин относится к раствору, который является основанием (например,г., pH > 7).
Сколько буферизации нужно вашему танку? Большая буферизация аквариума Комплекты для проверки емкости фактически измеряют KH. Чем больше KH, тем больше Ваша вода будет устойчива к изменениям pH. KH танка должен быть высоким достаточно, чтобы предотвратить большие колебания pH в вашем аквариуме с течением времени. Если ваш KH ниже примерно 4,5 dH, вам следует обратить особое внимание на pH резервуара (например, проверяйте еженедельно, пока не почувствуете, насколько стабильна pH есть). ОСОБЕННО важно, если вы пренебрегаете частыми частичная подмена воды.В частности, цикл нитрификации создает тенденция к снижению установленного pH в аквариуме со временем. В точное изменение pH зависит от количества и скорости нитратов произведены, а также KH. Если ваш pH падает более чем примерно на два десятых долей балла в течение месяца, вам следует подумать об увеличении KH или выполнять частичную подмену воды чаще. KH не влияют на рыбу напрямую, поэтому нет необходимости сопоставлять виды рыб с в частности KH.
Примечание: не рекомендуется использовать в резервуаре дистиллированную воду.К По определению, дистиллированная вода практически не имеет KH. Это означает, что добавление даже небольшого количества кислоты значительно изменит pH (подчеркивая рыбу). Из-за нестабильности дистиллированный (или любой по существу чистая вода) никогда не используется напрямую. Водопроводная вода или другое соли должны быть сначала добавлены к нему, чтобы увеличить его GH и KH.
- Общая жесткость (GH) относится к растворенной концентрации
ионы магния и кальция. Когда говорят, что рыба предпочитает «мягкую» или
«жесткая» вода — это GH (а не KH).
Примечание: GH, KH и pH образуют Бермудский треугольник воды. химия. Хотя эти три свойства различны, все они взаимодействуют друг с другом в разной степени, что затрудняет отрегулируйте одно, не влияя на другое. Это одна из причин, почему начинающим аквариумистам рекомендуется НЕ изменять эти параметры без крайней необходимости. Например, «жесткая» вода часто часто происходит из известняковых водоносных горизонтов. Известняк содержит кальций карбонат, который при растворении в воде увеличивает как GH (от кальций) и KH (из карбоната) компонентов.Увеличение KH компонент также обычно увеличивает pH. Концептуально KH действует как «губка», впитывающая кислоту, присутствующую в воде, повышая pH воды.
Жесткость воды соответствует следующим требованиям. Единица dH означает «степень твердости», в то время как ppm означает «части на миллион», что примерно соответствует мг / л в воде. 1 единица dH равна 17,8 ppm CaCO3. Большинство тестовых наборов дают жесткость в единицах CaCO3; это означает жесткость эквивалентна количеству CaCO3 в воде, но не означает это фактически произошло из CaCO3.
0 - 4 dH, 0 - 70 ppm: очень мягкий 4-8 dH, 70-140 частей на миллион: мягкий 8 - 12 dH, 140 - 210 ppm: средняя твердость 12 - 18 dH, 210 - 320 ppm: довольно сложно 18 - 30 dH, 320 - 530 ppm: жесткий выше: жидкая порода (озеро Малави и Лос-Анджелес, Калифорния) - Соленость относится к общему количеству растворенных веществ.
При измерениях солености учитываются как компоненты GH, так и KH, а также такие компоненты.
другие вещества, такие как натрий. Знание солености воды становится важным
в аквариумах с соленой водой.В резервуарах с пресной водой, зная pH, GH и KH
достаточно.
Соленость обычно выражается через ее удельный вес, отношение веса раствора к весу равного объема дистиллированной воды. Поскольку вода расширяется при нагревании (изменяя свою плотность), используется обычная эталонная температура 39F градусов. Соленость измеряется ареометром, который откалиброван для использования в определенных температура (например, обычно 75 градусов по Фаренгейту).
Одним из компонентов солености, который не включает ни GH, ни KH, является натрий.Некоторые пресноводные рыбы переносят (или даже предпочитают) небольшое количество соли. (стимулирует рост слизистой оболочки). Более того, паразиты (например, ick) действительно совсем не переносит соли. Таким образом, соль в концентрациях (до) 1 столовая ложка на 5 галлонов может действительно помочь предотвратить и вылечить болезнь и другие паразитарные инфекции.
С другой стороны, некоторые виды рыб не переносят ЛЮБОЙ соли Что ж. Рыба без чешуи (в общем) и некоторые сомы Коридора далеки более чувствительны к соли, чем большинство пресноводных рыб.Добавляйте соль, только если вы уверены, что все обитатели вашего танка его предпочитают или могут по крайней мере терпеть это.
Что еще мне нужно знать о химическом составе воды?
Помимо GH, KH, pH и солености, есть еще несколько вещества, о которых вы, возможно, захотите узнать. Большая часть водопроводной воды содержит Ассортимент микроэлементов в очень низких концентрациях. Присутствие (или отсутствие) микроэлементов может быть важным в некоторых ситуациях. Конкретно:
- Фосфаты связаны с ростом водорослей.Если у вас есть настойчивый
проблемы с водорослями, высокое содержание фосфатов может быть одним из факторов. В
бак для растений, идеальный уровень фосфатов составляет 0,2 мг / л или ниже. Контролировать
водорослей часто рекомендуется частая частичная подмена воды для уменьшения
уровни питательных веществ. Если в вашей водопроводной воде содержится избыток фосфатов, вода
изменения могут усугубить ситуацию. Ваша местная водопроводная компания
могу сказать вам, каковы точные уровни фосфатов.
Для роста растениям необходимо минимальное количество железа. Водопроводная вода во многих области вообще не содержат железа.Обратитесь к FAQ по установке для получения более подробной информации.
Как я могу повысить свой GH и / или KH?
Следующие ниже измерения являются приблизительными; используйте тестовый набор для проверки вы достигли желаемых результатов.Для одновременного повышения GH и KH добавьте карбонат кальция. (CaCO3). Две чайные ложки на 50 литров воды увеличивают как KH и GH примерно на 4 dH. Как вариант, добавьте морские ракушки, кораллы, известняк, мраморная крошка и т. д. в фильтр.
Чтобы поднять KH без повышения GH, добавьте бикарбонат натрия. (NaHCO3), широко известный как пищевая сода.Одна чайная ложка на 50 литров повышает KH примерно на 4 dH. Бикарбонат натрия приближает pH равновесное значение 8,2.
Как повысить или понизить pH?
Можно повышать или понижать pH, добавляя химические вещества. Потому что буферизация, однако, процесс трудно наладить. Увеличение или снижение pH (стабильным способом) фактически включает изменение KH. Наиболее распространенный подход — добавить буфер, состояние равновесия которого поддерживает желаемый уровень pH.
Соляная (соляная) кислота может использоваться для снижения pH.Обратите внимание, что точное необходимое количество зависит от буферной способности воды. Фактически, вы добавляете достаточно кислоты, чтобы использовать всю буферную емкость. Как только это будет сделано, снизить pH станет легко. Однако следует Следует отметить, что получаемая вода с более низким pH имеет гораздо меньшую буферность KH. чем раньше, что делает его более восприимчивым к колебаниям pH, когда (скажем) повышается уровень нитратов. Предупреждение: само собой разумеется, что кислоты ОЧЕНЬ опасно! Не используйте этот подход, если не знаете, что ты делаешь!
Такие продукты, как «pH-Down», созданы на основе кислой фосфорной кислоты.Фосфорная кислота имеет тенденцию поддерживать pH примерно на уровне (6.5 ??? ХХХ). К сожалению, использование фосфорной кислоты имеет сторону BIG . эффект повышения уровня фосфатов в вашем аквариуме, стимулирующий рост водорослей рост. Сложно контролировать рост водорослей в аквариуме с повышенный уровень фосфатов.
Один из безопасных способов понизить pH БЕЗ регулировки KH — это CO2 (диоксид углерода) через резервуар. CO2 растворяется в воде, и часть его образует угольную кислоту. Образование кислоты снижает pH.Конечно, для того, чтобы этот подход был практичным, постоянный источник пузырьков CO2 (например, баллон с CO2) необходим для поддержания pH в место. Как только CO2 уходит, pH возвращается к прежнему значению. ценить. Высокая стоимость системы впрыска CO2 не позволяет использовать ее в качестве Техника понижения pH в большинстве аквариумов. Однако системы впрыска CO2 очень популярны в тяжелых резервуарах, потому что дополнительный CO2 стимулирует рост растений.
Как смягчить воду (например, снизить ее GH)?
Немного рыбы (e.г., дискусы, кардинальные тетры и др.) предпочитают мягкую воду. Хотя они могут выжить в более жесткой воде, они вряд ли порода. Таким образом, вы можете почувствовать необходимость смягчить воду, несмотря на хлопот, связанных с этим.
Обычные домашние водоумягчители умягчают воду с использованием известного метода как «ионный обмен». То есть они удаляют ионы кальция и магния путем заменяя их ионами натрия. Хотя это технически делает вода мягче, большинство рыб не заметят разницы. То есть рыба любители мягкой воды тоже не любят натрий, а для них такие смягчители воды совсем не помогают.Таким образом, домашние смягчители воды не подходящий способ смягчения воды для использования в аквариуме.
Рыбные магазины также продают «подушки для смягчения воды». Они используют тот же принцип ионного обмена. Подушку «перезаряжают», намочив ее. в растворе соленой воды, затем помещает его в резервуар, где натрий ионы попадают в воду и заменяются кальцием и магнием ионы. Через несколько часов или дней подушка (вместе с кальцием и магний) удаляются, а подушка заряжается.Подушки продаваемые в магазинах, слишком малы, чтобы работать на практике, и не должны использоваться по той же причине, указанной выше.
Торфяной мох смягчает воду и снижает ее жесткость (GH). Большинство эффективный способ смягчить воду с помощью торфа — аэрировать воду на 1-2 часа. недель в ведре, содержащем торфяной мох. Например, получить (пластиковый) ведро подходящего размера. Затем получите большое количество торфа. (галлон или больше), вскипятите (чтобы он утонул), положите в подушку ящик и поместите его в ведро с водой.Используйте воздушный насос для аэрации Это. Через 1-2 недели вода станет мягче и кислее. Использовать это при частичной подмене воды в аквариуме.
Торф можно купить в зоомагазинах, но он дорогой. Это много Более выгодно покупать его оптом в местном садовом магазине. Читать этикетки внимательно! Вы не хотите использовать торф, содержащий удобрения или другие добавки.
Хотя некоторые люди помещают торф в фильтры своих резервуаров, Техника имеет ряд недостатков.Во-первых, торф легко забивается, поэтому добавление торфа не всегда эффективно. Во-вторых, торф может быть грязным и может замутните воду в вашем аквариуме. В-третьих, точное количество торфа. необходимое для эффективного смягчения воды оценить сложно. Использование неправильного количества приводит к неправильному химическому составу воды. Ну наконец то, при подмене воды химический состав вашего аквариума меняется, когда новая вода добавлен (у него неправильные свойства). В течение следующих нескольких дней химический состав меняется по мере того, как торф вступает в силу. Использование выдержанной воды помогает убедитесь, что химический состав вашего аквариума не меняется при выполнении подмены воды.
Жесткую воду также можно смягчить, разбавив ее дистиллированной водой. или слив воды. Вода R / O (обратного осмоса) — это очищенная вода, произведенная Блок R / O. К сожалению, блоки R / O слишком дороги (100-500 долларов) для большинство хобби.
 Так же для полива используется дождевая вода. Каждый вид воды обладает своими особенностями и характеристиками, имеет разную пригодность для полива.
Так же для полива используется дождевая вода. Каждый вид воды обладает своими особенностями и характеристиками, имеет разную пригодность для полива.
 Поэтому не рекомендуется собирать дождевую воду, если до этого долго не было осадков. Но получаса сильного или затяжного дождя достаточно для того, чтобы очистить крышу от пыли, содержащей вредные примеси. После этого можно начинать сбор дождевой воды для полива.
Поэтому не рекомендуется собирать дождевую воду, если до этого долго не было осадков. Но получаса сильного или затяжного дождя достаточно для того, чтобы очистить крышу от пыли, содержащей вредные примеси. После этого можно начинать сбор дождевой воды для полива. Что же касается временной жесткости воды, то, если она достаточно высока, происходит нарушение кислотно-щелочного баланса почвы в сторону увеличения содержания щелочных соединений. У растений часто проявляются признаки хлороза. Из-за использования воды с временной жесткостью происходит появление твердого осадка на почве, стенках горшка и даже частях растений.
Что же касается временной жесткости воды, то, если она достаточно высока, происходит нарушение кислотно-щелочного баланса почвы в сторону увеличения содержания щелочных соединений. У растений часто проявляются признаки хлороза. Из-за использования воды с временной жесткостью происходит появление твердого осадка на почве, стенках горшка и даже частях растений. На самом деле, все двухвалентные катионы влияют на жесткость воды, просто влияние катионов стронция (Sr), железа (Fe) или марганца (Mn) ничтожно по сравнению с влиянием катионов кальция и магния, а растворимость солей трехвалентного железа и алюминия (Al) мала при уровне кислотности природной воды.
На самом деле, все двухвалентные катионы влияют на жесткость воды, просто влияние катионов стронция (Sr), железа (Fe) или марганца (Mn) ничтожно по сравнению с влиянием катионов кальция и магния, а растворимость солей трехвалентного железа и алюминия (Al) мала при уровне кислотности природной воды. При повышении температуры этот вид жесткости не устраняется, так как эти соли не выпадают в осадок.
При повышении температуры этот вид жесткости не устраняется, так как эти соли не выпадают в осадок. 000
000
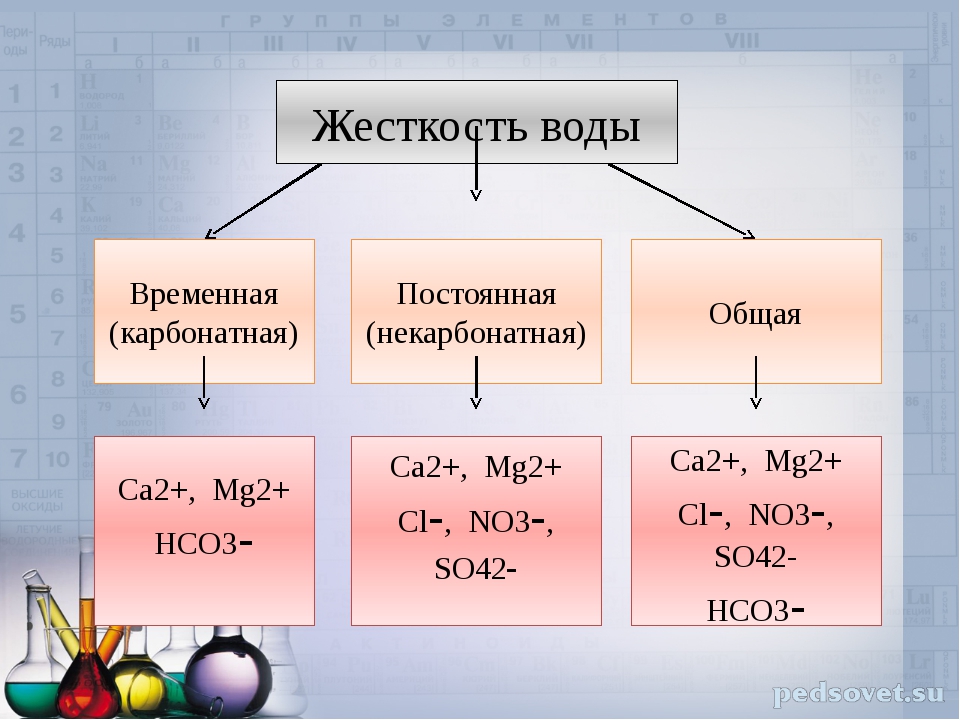

 Можно попытаться полученный осадок отфильтровать, но это будет затруднительно в силу его мелкодисперстности. Необходимо помнить, что кипяченая вода лишается растворенного в ней кислорода. Но думается, что для хой это несущественно, так как высаживаются они в воздухопроницаемый и быстро просыхающий субстрат. А поливаются после просушивания земляного кома. В этой ситуации снабжение корней хойи кислородом не будет нарушено.
Можно попытаться полученный осадок отфильтровать, но это будет затруднительно в силу его мелкодисперстности. Необходимо помнить, что кипяченая вода лишается растворенного в ней кислорода. Но думается, что для хой это несущественно, так как высаживаются они в воздухопроницаемый и быстро просыхающий субстрат. А поливаются после просушивания земляного кома. В этой ситуации снабжение корней хойи кислородом не будет нарушено.
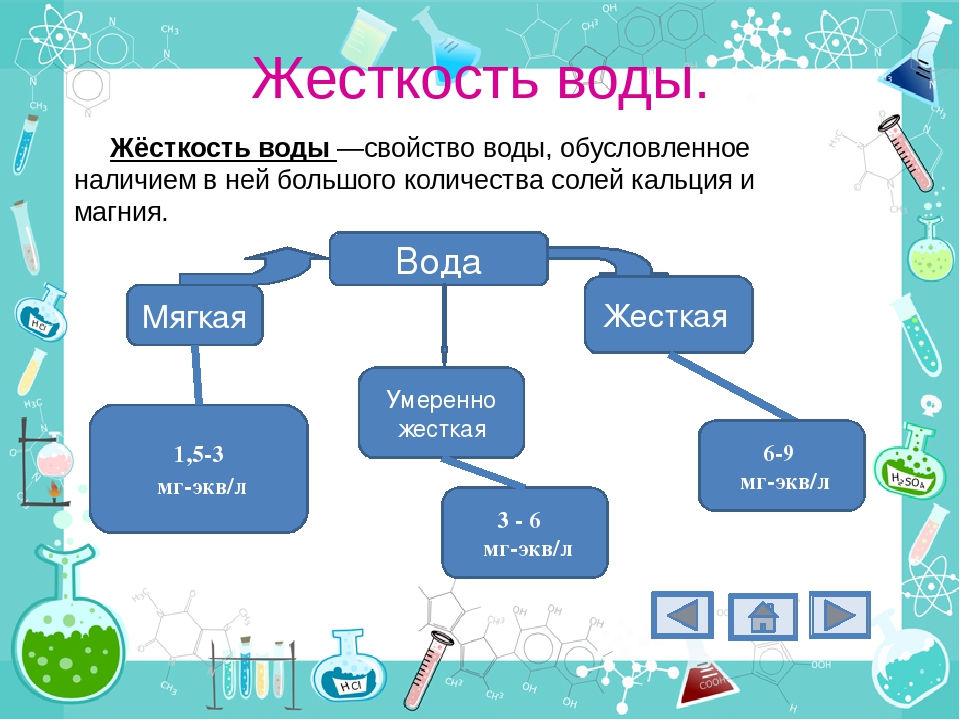 Опыты показали, что добавление 1-1,5 г. трилона Б на 1 литр воды жесткостью 12-16 град. позволяют выращивать растения, требующие очень мягкой воды.
Опыты показали, что добавление 1-1,5 г. трилона Б на 1 литр воды жесткостью 12-16 град. позволяют выращивать растения, требующие очень мягкой воды. В домашних условиях этот метод не используется не только в силу высокой энергоемкости процесса, но и в силу того, что дистиллятор требует стационарного подключения к водопроводу, системы охлаждения для конденсации паров, строгого соблюдения мер безопасности.
В домашних условиях этот метод не используется не только в силу высокой энергоемкости процесса, но и в силу того, что дистиллятор требует стационарного подключения к водопроводу, системы охлаждения для конденсации паров, строгого соблюдения мер безопасности. Ориентировочно, 1 куб. дециметр ионообменной смолы может умягчить 160 литров воды жесткостью 5 мг-экв/л.
Ориентировочно, 1 куб. дециметр ионообменной смолы может умягчить 160 литров воды жесткостью 5 мг-экв/л.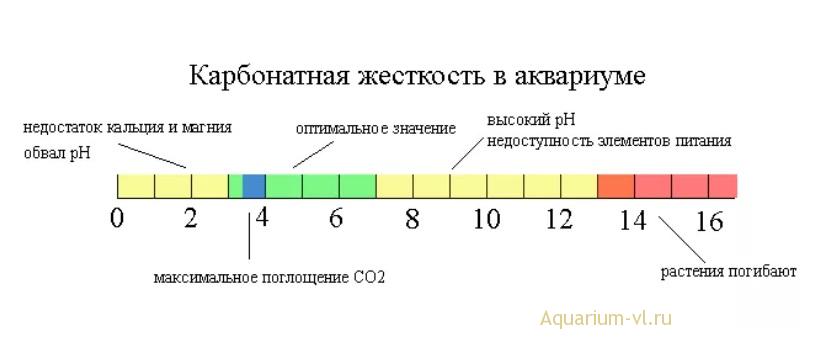 Обратноосмотические бытовые фильтры достаточно дороги, их стоимость начинается от $300–$400, пока они не являются массовым продуктом.
Обратноосмотические бытовые фильтры достаточно дороги, их стоимость начинается от $300–$400, пока они не являются массовым продуктом. 5
5