Что такое рН воды и как его можно определить: просто и понятно о сложном
Такой термин, как рН воды впервые был озвучен датским ученым, специализирующимся на химии Соренсеном – он установил его в качестве показателя веса водорода. Произошло это более века тому назад – еще в 1909 году.
Сегодня этот показатель используется довольно часто и о нем слышали фактически все. Например, из рекламы косметических средств. Отметим, что с помощью такого показателя, как рН характеризуют практически все жидкости и не только:
- для чистой питьевой воды данный показатель составляет 7,0;
- для морской воды – 8,0;
- для нормального шампуня – в пределах 5,5;
- для жидкого мыла – около 9,5.
У кожного покрова человека, не нарушенного недугами и неповрежденного раздражениями и аллергией, оптимальный показатель – 6,5.
На что влияет рН?
Чтобы лучше понять, что такое рН воды, следует рассказать, на что он влияет.
Добавим, что если показатель превышает отметку в 7, то это вода будет щелочной, а если меньше 7, то кислотной. Все воды можно разделить на несколько групп именно по уровню рН:
- уровень меньше 3 характерен сильнокислым водам;
- для кислых вод этот показатель колеблется в пределах от 3 до 5;
- для слабокислых он будет составлять от 5 до 6,5;
- для нейтральных, обычных – от 6,5 до 7,5;
- показатель от 7,5 до 8,5 будет указывать на то, что это вода слабощелочная;
- если уровень рН колеблется в пределах от 8,5 до 9,5 – вода будет щелочной;
- если показатель превышает 9,5 – это сильнощелочные воды.
Отметим, что в подавляющем большинстве случаев данный показатель находится в пределах, не оказывающих воздействия на потребительские свойства питьевой воды, и колеблется от 6 до 9 единиц.
Как определить рН воды: простой метод
Если вас интересует, как измерить рН воды, то все зависит от места, где вы будете проводить измерения, и целей, которые преследуете. Например, для предприятий, промышленных объектов используют специальные приборы. Также, на тех же коммунальных предприятиях, осуществляющих подачу воды населению, исследования проводят в специализированных лабораториях. А вот в домашних условиях эти исследования чаще всего необходимы для того, чтобы обеспечить аквариумных рыбок безопасной и чистой водой.
Как определить рН воды? Проще всего купить специальные тест-полоски. Кстати, они также применяются в практике гастроэнтерологов, которые определяет тип гастритов и других заболеваний – для правильной диагностики недуга крайне важно точно узнать среду в организме (щелочная она или кислотная). В зависимости от того, как изменится цвет тест-полоски и зависит уровень рН:
- красный – повышенная кислотность;
- фиолетовый – нейтральный уровень рН;
- желтый – повышенный щелочной уровень;
- переход от красного к фиолетовому – это средний уровень кислотности;
- оттенки фиолетового в сторону к синему, а также зеленый – это средний щелочной уровень
Теперь вы знаете, как узнать рН воды – процесс довольно простой и не требует особых знаний в химии.
Просто пейте чистую воду!
Чтобы не переживать о том, какую воду вы пьете, просто установите современное, высококачественное очистительное оборудование. На сайте компании Filter.ua представлены как бытовые фильтры, так и промышленные фильтры. Среди них системы обратного осмоса, умягчители воды и многие другие. Сориентироваться в разнообразии моделей и сделать правильный выбор помогут квалифицированные менеджеры компании. А чтобы система подачи воды всегда работала эффективно, рекомендуем купить насосную станцию, которая будет нагнетать необходимое давление
Что такое pH воды в бассейне и как сохранить правильный баланс
Использование чистой (дистиллированной) воды в бассейнах не обосновано экономически и не полезно с точки зрения гигиены кожи. Жидкость в бассейнах является водным раствором различных веществ, количество которых определяет кислотную или щелочную среду в воде.
Основным показателем, определяющим кислотно-щелочной баланс, является pH — мера активности ионов водорода. О «пэ-аш» многие слышали в школе, но редко кто помнит нюансы. Разберемся вместе на что он влияет, как его контролировать и поддерживать в нужном диапазоне.
О «пэ-аш» многие слышали в школе, но редко кто помнит нюансы. Разберемся вместе на что он влияет, как его контролировать и поддерживать в нужном диапазоне.
Каким должен быть pH в бассейне
Водородный показатель влияет на химические, биологические процессы в воде. От них зависит как комфортность купания, так и эффективность дезинфицирующих препаратов.
Показатель pH от 0 до 7 считается кислотным, а от 7 до 14 щелочным. Оптимальным для эффективной дезинфекции, сохранности оборудования и гигиены кожи является водородный показатель в пределах от 6,7 до 7,4. Такие значения соответствуют слабощелочной среде. Для справки: pH человеческой крови примерно 7,4.
Поддержание pH на уровне 6,7-7,4:
исключит образование известковых отложений на стенках чаши бассейна и трубах;
минимизирует коррозию металлических частей оборудования;
обеспечит комфортное купание, избавит от раздражения кожи и слизистых оболочек глаз.

Контроль водородного показателя на заданном уровне позволяет экономно расходовать дезинфицирующие средства и корректирующие препараты. Важно помнить что хлор, который чаще всего используется для дезинфекции, вступает в реакцию с содержащейся в воде органикой. Неполные реакции при высоком pH приводят к образованию побочных продуктов дезинфекции, некоторые из которых являются канцерогенами. Они негативно влияют на самочувствие купающихся. Это может быть раздражение кожи, слизистых и даже астматические заболевания. Именно поэтому так важно контролировать кислотно- щелочной баланс в воде бассейна.
Причины и последствия снижения pH
Значение pH ниже 7 говорит о накоплении в воде бассейна кислоты. Это происходит из-за передозировки химических реагентов, используемых в оборудовании водоподготовки.
Снижение pH в воде бассейна приводит к:
кислотной коррозии оборудования;
постепенному разрушению облицовки чаши;
чрезмерному расходу химических препаратов;
появлению у купающихся жжения в глазах, сухости кожных покровов и ломкости волос.

Визуально уменьшение pH незаметно, однако на металлических частях оборудования и коммуникаций может появляться налет из ржавчины.
Причины и последствия повышения pH
Повышение pH в воде бассейна приводит к:
появлению на оборудовании, облицовке и трубах кальциевых отложений;
ускоренному размножению и росту микроорганизмов;
раздражению кожи и слизистых у пловцов;
увеличению расходов на обслуживание за счет неэффективности химических препаратов в щелочной среде.
Визуально повышение pH проявляется в виде помутнения воды в бассейне. Возникают мелкодисперсные хлопья, часть из которых выпадают в осадок на дно и стены чаши.
Методы контроля уровня pH в воде бассейна
Для контроля кислотно-щелочного баланса в воде искусственных водоемов применяются три метода. Они применимы как к загородным, так и к общественным, спортивным бассейнам.
Лакмусовая бумага
Полоски бумаги с нанесенным и высушенным раствором кислотно-основного индикатора лакмуса являются самым простым способом определить pH. Метод понятен и доступен даже школьникам. Лакмусовая бумажка при окунании в образец воды из бассейна может менять цвет от синего (сильно кислая среда) до красного (сильно щелочная среда). Шкала зависимости цвета лакмусовой полоски от pH приводится на упаковке.
Достоинства применения лакмусовых полосок:
невысокая цена;
наличие практически в любом магазине химии или средств для обслуживания бассейнов;
простота использования.
Недостатки применения лакмусовых полосок:
Таблетки
Небольшие таблетки содержат кислотно-основной индикатор и нейтральный наполнитель. Для определения с их помощью водородного показателя необходимо отобрать пробу воды в колбу и добавить туда же таблетку. После растворения таблетки жидкость окрашивается в определенный цвет. Сравнив его с нанесенной на колбу цветовой шкалой, определяют уровень pH.
Для определения с их помощью водородного показателя необходимо отобрать пробу воды в колбу и добавить туда же таблетку. После растворения таблетки жидкость окрашивается в определенный цвет. Сравнив его с нанесенной на колбу цветовой шкалой, определяют уровень pH.
Таблетки, также как и лакмусовые полоски, не дают точного результата. Погрешность измерений у метода достаточно высока.
Фотометры
Электронный прибор, измеряющий прозрачность раствора и преобразующий ее в значение водородного показателя, позволяет достаточно точно определить величину pH. Если не углубляться в физико-химические принцип работы pH-метра, то использовать его достаточно просто. Необходимо сделать забор 25-30 мл воды из бассейна в пробирку и поместить ее в прибор. Уже через несколько секунд прибор закончит измерения и покажет на шкале значение водородного показателя.
Точность измерений фотометра составляет 0,1 единица. Это позволяет производить мониторинг малейших изменений качества жидкости в чаше бассейна, своевременно добавлять реагенты, корректирующие кислотно-щелочной баланс.
Использование фотометра требует минимальных навыков работы с лабораторным оборудованием..
Препараты для корректировки уровня pH в бассейне
Измерение водородного показателя в искусственном водоеме позволяет определить отклонения качества воды в кислую или щелочную сторону. После этого необходимо провести корректировку pH до рекомендуемого уровня при помощи специальных реактивов.
Понижаем pH в бассейне
Для увеличения кислотности воды используются препараты pH-минус. Их действие направлено на снижение концентрации щелочи, содержания солей жесткости и растворенного углекислого газа (СО2). Основное действующее вещество таких препаратов бисульфат натрия. Реактивы для снижения pH выпускаются в гранулированном, порошкообразном или жидком виде.
Использовать препарат рекомендуется в соответствии с таблицей дозировок. Для правильного расчета необходимо знать объем искусственного водоема и актуальное значение pH.
Отмеренное в соответствии с таблицей количество сухого препарата разводят в небольшом количестве воды и добавляют в чашу бассейна или в бак помпы. Также сухой препарат можно засыпать в скиммер. В жидком виде препараты используются вместе с автоматическими станциями дозирования, которые измеряют и дозируют необходимое количество препарата непосредственно в трубопровод системы циркуляции бассейна.
Также сухой препарат можно засыпать в скиммер. В жидком виде препараты используются вместе с автоматическими станциями дозирования, которые измеряют и дозируют необходимое количество препарата непосредственно в трубопровод системы циркуляции бассейна.
Повышаем pH в бассейне
Для уменьшения кислотности воды используют препараты pH-плюс. Основным действующим веществом в них является карбонат натрия. Реактивы выпускаются в порошкообразном и жидком виде.
Необходимое количество реагента определяется на основании таблицы дозировок. Растворенный в небольшом количестве воды порошкообразный реактив добавляют прямо в чашу водоема, оптимально перед соплом возврата потока отфильтрованной воды. Разводить порошок можно в распределительном баке.
Меры предосторожности
Использовать реагенты pH-плюс и pH-минус необходимо только в рекомендуемой дозировке. Разводить их нужно в прохладной воде, не пытаясь ускорить процесс растворения, подогревая воду. Также важно соблюдать меры безопасности, а именно надевать защитную одежду, очки, избегать вдыхания выделяющихся испарений. При попадании раствора реагента на кожу либо слизистую нужно обильно промыть пораженное место чистой водой и обратиться к врачу.
При попадании раствора реагента на кожу либо слизистую нужно обильно промыть пораженное место чистой водой и обратиться к врачу.
Надеемся, теперь вы знаете все о pH в воде бассейна, как его контролировать и корректировать. Если нет возможности или желания самостоятельно следить за качеством воды в искусственном водоеме, можете поручить это специалистам «Центра обслуживания бассейнов». У нас для этого есть необходимое оборудование, реактивы и квалифицированные специалисты.
Для чего нужно контролировать pH воды?
Покупая бассейн, все мы хотим получить от него максимальную пользу без вреда для здоровья, а также минимальных расходах по эксплуатации. Правильно подобранная химия обеспечит чистую, прозрачную воду, а вместе с этим, здоровое плавание, а также продление срока службы, как самого бассейна, так и его фильтрационной системы, аксессуаров.Первый шаг по дезинфекции – контроль уровня pH.
 Давайте, разберемся детально, что это за показатель и почему он так важен.
Давайте, разберемся детально, что это за показатель и почему он так важен.Что такое уровень pH воды? pH (лат. pondus Hydrogenii — «вес водорода») — это мера активности ионов водорода в растворах. Проще говоря, указывает на кислотность или щелочность воды. Если уровень ниже нормы (недостаток ионов водорода), то это указывает на увеличение кислотности. Если же выше (излишек ионов водорода) – увеличение щелочности. Оба эти явления могут вызвать нежелательные химические реакции.
От чего зависит уровень кислотно-щелочной среды?
Факторов есть множество. Самые важные из них:
— добавления дезинфицирующих химикатов;
— температура воды;
— интенсивность использования бассейна;
— погодные условия.
Почему так важен баланс pH в бассейне? При уровне pH выше или ниже нормы, наблюдаются следующие проблемы:
— отложение кальция на поверхности бассейна, коррозия металлических аксессуаров;
— значительное помутнение воды;
— засорение элементов фильтрующей системы;
— снижение эффективности хлора и других химических препаратов, что приводит к росту водорослей, размножению вредных бактерий,
следовательно, не сбалансированный pH — увеличивает Ваши расходы по химии, либо придется менять воду в бассейне.

— жжение в носу и глазах, их воспаление;
— сухая, зудящая кожа;
Норма pH и меры контроля Показатель pH является самым важным, поскольку от него напрямую зависит эффективность дезинфекции воды в бассейне. Поэтому перед использованием бассейна, в первую очередь, обязательно нужно его проверить и, при необходимости, выровнять. И только тогда приступать к подбору других веществ для дезинфекции.
Оптимальное значение показателя – 7,2-7,6.
Отклонение в любую сторону несет негативные последствия. Поэтому нужно постоянно контролировать уровень pH в Вашем бассейне. Рекомендуется проверять показатель 1 — 2 раза в неделю с помощью специальных тестеров для анализа воды.
При минимальном несоответствии нормам, следует принять меры по сбалансированию.
Если показатель pH ниже нормы Это свидетельствует о повышенной кислотности воды.
 Она будет разъедать металлическое оборудование, может вызвать раздражение, различные аллергические реакции кожи и слизистых оболочек организма.
Она будет разъедать металлическое оборудование, может вызвать раздражение, различные аллергические реакции кожи и слизистых оболочек организма.Для повышения уровня pH используют регулятор «pH-плюс». Приблизительная дозировка: чтобы повысить уровень pH на 0.1, необходимо на 10 куб. м воды – 100 гр гранул препарата. Необходимое количество вещества растворить в воде в пластиковой емкости. Данный раствор разделить на несколько порций, которые по очереди, распределить по периметру бассейна равномерно, либо вблизи места подачи воды (но только не перед фильтрами) во время работы насоса. Перед добавлением каждой порции следует проверять изменение показателя рН (с интервалом не менее 30 минут).
Если повышен уровень pH Это говорит о том, что вода слишком щелочная. Данная ситуация приводит к выпадению извести. Хлор или другие препараты утрачивают свои дезинфицирующие свойства. Впоследствии, водная среда может превратиться в зеленую массу, которая через некоторое время также начинает источать неприятный запах.
 И это даже при высокой концентрации хлора. В данном состоянии вода действует, как сильный раздражитель кожи и глаз. В таком бассейне купаться категорически нельзя.
И это даже при высокой концентрации хлора. В данном состоянии вода действует, как сильный раздражитель кожи и глаз. В таком бассейне купаться категорически нельзя.
В результате такой химической реакции начинается процесс осадки кальция в устройствах, вследствие чего ломается водонагреватель и засоряется и может быть полностью расстроена работа системы фильтрации. Снизить уровень pH поможет регулятор «pH-минус». Дозировка и способ применения аналогичный «pH-плюс».
Внимание! Запрещено применять химические реагенты во время пользования бассейном! После добавления в воду, купаться нельзя минимум 30 минут. Не рекомендуется использовать перед фильтрацией. Хранить в сухом, прохладном месте, вне зоны доступа детей.
Регулирование уровня рН воды в бассейне способствует следующему:
— эффективному действию химических веществ (хлор, альгицид, флокулятор и т. д.), а следовательно, их меньшему расходу;
д.), а следовательно, их меньшему расходу;
— продлению службы установок фильтрующей системы, а также улучшению эффективности их работы;
— улучшению эксплуатационных характеристик бассейна, сохранение его облицовки.
И самое главное – это безопасное, здоровое купание, как для взрослых, так и для детей.
уровень pH и его значение
Способность к растворению веществ является основной особенностью воды. И любой водный раствор имеет кислотно-щелочной баланс. Показатель «pH» при анализе воды используется для определения отклонения этого баланса в одну из сторон. Он выражает концентрацию водородных ионов (в молях) на литр раствора.
При равном количестве положительных (H) и отрицательных (OH) ионов в воде с температурой +25 градусов ее называют нейтральной. В этом случае pH равен 7. Дополнительные примеси в такой воде обычно отсутствуют. Если этот показатель станет равен 6, т.е. произойдет отклонение на единицу, то это означает, по сравнению с нейтральной средой концентрация ионов снизилась в 10 раз.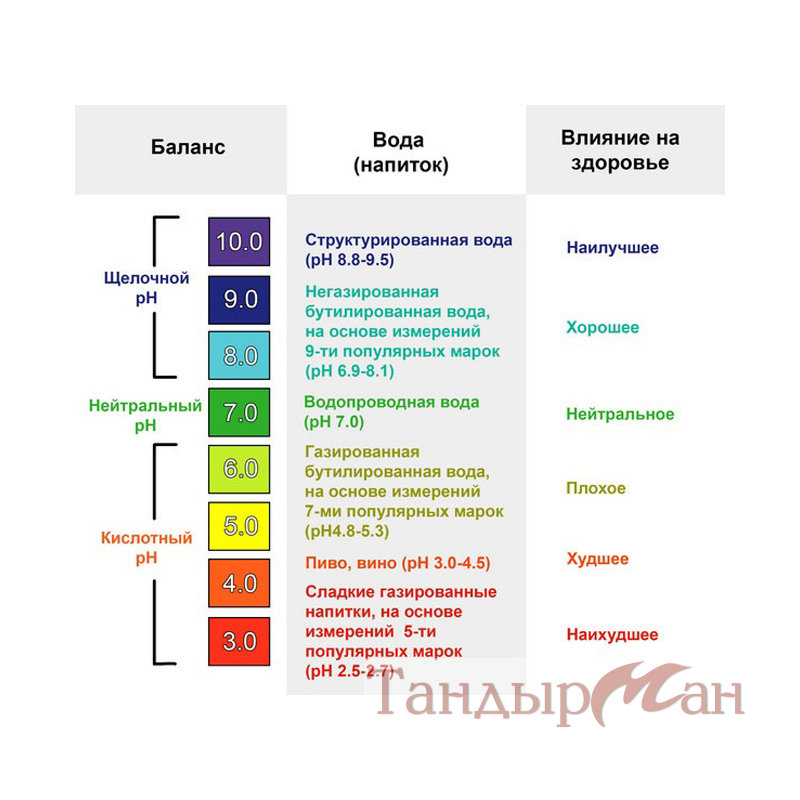 Для показателя 8 ситуация противоположная. Также используются понятия кислая и щелочная среда. Зависит кислотность от уровня pH в воде. Т.е. если этот показатель ниже 7, то среда кислая, а если выше – щелочная.
Для показателя 8 ситуация противоположная. Также используются понятия кислая и щелочная среда. Зависит кислотность от уровня pH в воде. Т.е. если этот показатель ниже 7, то среда кислая, а если выше – щелочная.
Какой уровень pH является приемлемым для питьевой воды
Примеси отсутствуют только в дистиллированной воде. Природная вода в любом случае имеет отклонение от нейтрального pH в одну из сторон. Для питьевой воды оптимальным показателем является pH на уровне 7,0-8,0. Подбор метода очистки и фильтрующего материала подбирается с учетом показателя кислотности. От правильного выбора напрямую зависит эффективность очистной системы.
Как можно определить показатель pH?
В плане экономии денежных средств наиболее приемлемым является анализ воды при помощи индикатора. Ярким примером в этом случае служит лакмусовая бумага. В зависимости от степени кислотности, бумага окрашивается в разные цвета.
Использование индикатора позволяет определить лишь отклонение от нормы. Но для точного определения уровня pH больше подойдет инструментальный метод. Для этого предназначен специальный прибор, который просто погружается в воду. На нем имеется экран, на котором через некоторое время появляется показатель кислотности.
Но для точного определения уровня pH больше подойдет инструментальный метод. Для этого предназначен специальный прибор, который просто погружается в воду. На нем имеется экран, на котором через некоторое время появляется показатель кислотности.
Некоторые фактор могут повлиять на полученный при анализе результат:
- Объем жидкости и ее температура;
- Время, прошедшее с забора воды до ее анализа;
- Имеются ли пузырьки воздуха в воде;
- Насколько чиста посуда, в которой проводится исследование;
- Соблюдение правил пользования инструментом.
Анализ воды в Перми
Значение pH в гидропонике
pH является мерой между кислотностью и щелочностью водного раствора. Если раствор имеет кислую реакцию, то он имеет pH в диапазоне от 0 до 6,9. Если раствор щелочной, то он имеет pH — от 7,1 до 14. Чистая вода или деионизированная (дистиллярованная) вода нейтральна и имеет pH 7,0. Идеальным значением pH для большинства гидропонных садов находится между 5,8 — 6,2.
 Исключением является минеральная вата, которой необходим немного низкий уровень pH — около 5,5.
Исключением является минеральная вата, которой необходим немного низкий уровень pH — около 5,5.Узнай больше: pH = -log [H+], или еще строже говоря pH = -log [h4O+] (химики утверждают, что именно в таком виде положительный ион водорода живет в водном растворе). pH показывает кислотно / щелочной баланс раствора, а не кислотность или щелочность (основность) отдельно.
pH измеряется в степенях числа 10. Концентрация ионов водорода в растворе с pH 1.0 в 10 раз выше, чем концентрация ионов водорода в растворе с pH 2.0. Чем выше концентрация ионов водорода, тем ниже pH
- при pH > 7 раствор щелочной (основной)
- при pH < 7 раствор кислый, или кислотный
В чистой нейтральной воде концентрация ионов водорода и гидроксильных ионов = гидроксид-ионов = OH- обе равны 10-7 моль/л.
Почему значение pH так важно?
Если уровень pH находится в неправильном диапазоне, то растение не будет способно поглощать некоторые необходимые элементы для роста. Все растения имеют свой диапазон значения pH, при котором будет происходить здоровый рост. Это значение варьируется от растения к растению, но все же большинство растений предпочитают кислую среду ( от 5,8 до 6,2), при этом много растений способны выжить при диапазоне между 5,0 и 7,0.
Все растения имеют свой диапазон значения pH, при котором будет происходить здоровый рост. Это значение варьируется от растения к растению, но все же большинство растений предпочитают кислую среду ( от 5,8 до 6,2), при этом много растений способны выжить при диапазоне между 5,0 и 7,0.
Растения выращенные на кислых средах могут испытывать различные недостатки, включая алюминий (Al), водород(H), и/или отравление марганцем(Mn), а так же недостатки питательных веществ кальция(Ca) и магния(Mg)
В щелочных средах повышается содержание молибдена(Mo) и макроэлементов ( за исключением фосфора ), а содержание фосфора(P), железа(Fe), марганца(Mn), цинка(Zn), меди(Cu) и кобальта(Co) снижается и может отрицательно повлиять на развитие растения.
Из диаграммы можно увидеть, что каждый элемент может стать более или менее доступным для растения, в зависимости от изменения уровня pH. Если значение pH Вашего раствора вышло из заданного диапазона, это может вызвать нехватку важных элементов, что в своем случае замедлит рост и понизит итоговый урожай.
Как измерить pH моего раствора?
Существуют несколько способов проверить уровень pH Вашего питательного раствора, такие как бумажные тест-полоски, жидкий pH тест-наборы и цифровые pH-метры.
Бумажные тест-полоски pH
Пропитаны специальными красителями, которые чувствительны к значениям pH. Если их опустить в питательных раствор,они изменят цвет. Бумажные полоски сравниваются с цветовой шкалой для определения значения pH.
Жидкий pH-тест
Если добавить несколько капель чувствительного красителя в небольшое количество питательного раствора. Затем сравнить цвет получившейся жидкости с цветовой шкалой для определения значения pH.
Цифровые pH-метры
Это самый высокотехнологичный метод проверить значение pH. Все, что Вам необходимо, это окунуть электрод в питательный раствор на несколько минут, и значение pH отобразится на ЖК-дисплее. Цифровые pH-метры работают очень быстро и точно, если правильно откалиброван. Такие приборы требуют должного ухода, иначе они перестают действовать. Стеклянный шарик должен быть чистым, а некоторые электроды должны постоянно находится в специальном растворе. Перед применением проверяйте и при необходимости откалибруйте Ваш pH-метр для достижения точности.
Такие приборы требуют должного ухода, иначе они перестают действовать. Стеклянный шарик должен быть чистым, а некоторые электроды должны постоянно находится в специальном растворе. Перед применением проверяйте и при необходимости откалибруйте Ваш pH-метр для достижения точности.
Следим за уровнем pH
Пассивная гидропоника
В пассивной гидропонике используются контейнеры или горшки наполненные субстратом, таким как кокос, перлит, вермикулит, минеральная вата Rockwool и другие. Как правило, для такого типа культивирования используется один большой резервуар для приготовления раствора. После того как Вы приготовили питательный раствор, можно проверить и отрегулировать значение pH до идеального уровня (5,8 — 6,2). Особое внимание следует уделить точному количеству pH Up/pH Down добавляемого в раствор, в дальнейшем это поможет определить точную дозировку для Вашей воды. Эта дозировка должна оставаться постоянной от партии к партии, хотя выборочные проверки рекомендуются время от времени. В идеале Вы должны иметь автоматический регулятор pH. Питательный раствор должен оставаться стабильным и по мере необходимости применяться к растениям.
В идеале Вы должны иметь автоматический регулятор pH. Питательный раствор должен оставаться стабильным и по мере необходимости применяться к растениям.
Активная гидропоника
Активные гидропонные — это системы, в которых питательный раствор подается к растениям с помощью насоса, такие как N.F.T., Ebb&Flow(Flood&Drain), аэропоника, а также системы водных культур (DWC, SWC). В большинстве систем питательный раствор циркулирует вокруг корней в течении определенного времени.
В активных системах проверять и регулировать значение pH необходимо в основном баке и на регулярной основе. В большинстве систем, по мере расхода питательного раствора, доливают обычную воду. Эта вода, как правило, имеет высокое значение pH, чем в питательном растворе, поэтому идет тенденция к повышению уровня pH. Это можно исправить регулярным добавлением небольшого количества pH Down. Этот процесс регулирования уровня pH может быть осуществлено с помощью жидкого pH теста, но так как это нужно делать часто, занятым садоводам проще это делать через цифровой прибор.
Значение pH и жесткая вода (Hard Water)
Жесткая вода является содержателем высокого уровня бикарбонатов, это можно увидеть в известняковом налете на чайнике и в быстром смывании мыла с рук. Жесткая вода обычно имеет высокий уровень pH, но не обязательно. Отличие состоит в том, что на жесткую воду Вам потребуется больше количества кислоты, чтобы снизить уровень pH, чем с эквивалентным образцом мягкой воды. Это потому, что бикарбонаты должны быть нейтрализованы, при этом используется много кислоты. Очевидная проблема садовода, который использует большое количество фосфорной кислоты, что в свою очередь, может привести к накоплению фосфата в растительной среде с течением времени. Высокий уровень фосфата в растворе может подавлять поглощение других элементов, например, цинк. И может стать причиной общего дисбаланса веществ.
К счастью у многих производителей есть решение, в качестве питательных удобрений специально для жесткой(Hard Water) или мягкой (Soft Water) воды.
Здоровье и безопасность:
Вещества для контроля pH являются высокотоксичными и агрессивными жидкостями. Пожалуйста, следуйте простым рекомендациям для обеспечения безопасности и спокойствия.
- Всегда храните их в безопасном месте, желательно в запирающемся шкафу.
- Всегда держите их вне досягаемости от детей.
- Всегда используйте средства индивидуальной защиты. Одевайте перчатки и защитные очки при работе с любыми агрессивными химическими веществами.
- Перед применением разбавляйте необходимую дозировку в небольшом количестве воды.
Переведено: http://www.growthtechnology.com/growtorial/what-is-the-ph-value/
Как проверить уровень кислотности воды?
Характеристики подходящей воды
Общее правило заключается в том, что хорошая поливная вода обладает низким содержанием натриевых солей. Если вы выращиваете растения в открытой почве, то для полива обычно используется вода с содержанием натриевых солей 0,5 ммоль/литр.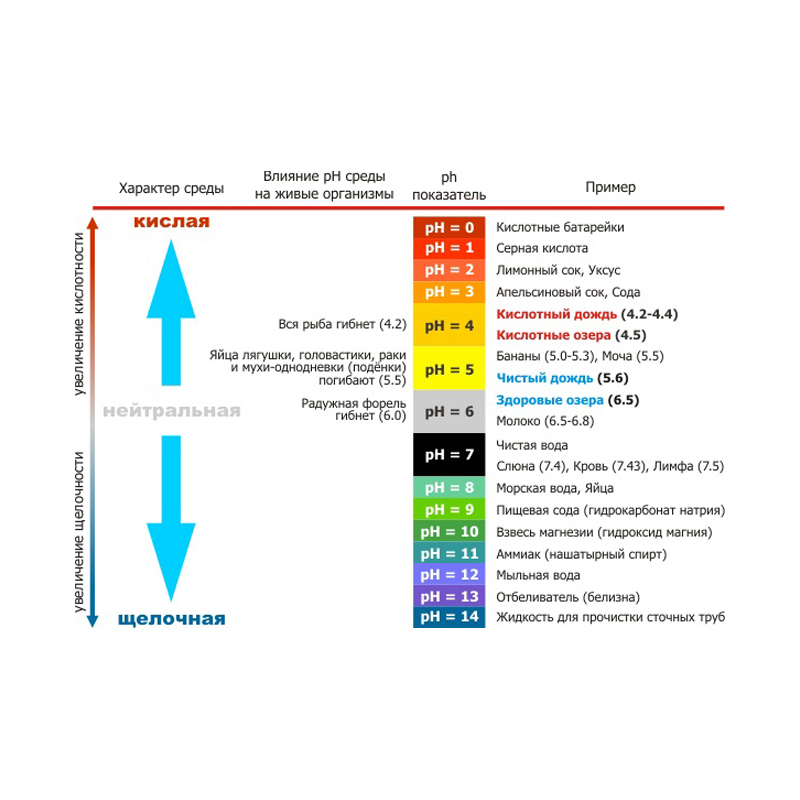 С другой стороны, содержание натриевых солей может быть выше, если вы культивируете растения, не являющиеся чувствительными к солям. Подходящей для полива, обычно, считается вода, уровень кислотности которой находится в пределах 4,5-6,0 pH. Если показатель pH ниже указанных значений, то существует вероятность повреждения почвы и корней растения. Слишком высокий уровень кислотности также ведет к снижению способности корневой системы впитывать полезные вещества. Присутствие бикарбоната в воде повышает уровень pH. А это, в свою очередь, усложняет контроль уровня кислотности в корневой среде. Поэтому, очень важно нейтрализовать основное содержание бикарбоната при помощи при помощи кислотных удобрений.
С другой стороны, содержание натриевых солей может быть выше, если вы культивируете растения, не являющиеся чувствительными к солям. Подходящей для полива, обычно, считается вода, уровень кислотности которой находится в пределах 4,5-6,0 pH. Если показатель pH ниже указанных значений, то существует вероятность повреждения почвы и корней растения. Слишком высокий уровень кислотности также ведет к снижению способности корневой системы впитывать полезные вещества. Присутствие бикарбоната в воде повышает уровень pH. А это, в свою очередь, усложняет контроль уровня кислотности в корневой среде. Поэтому, очень важно нейтрализовать основное содержание бикарбоната при помощи при помощи кислотных удобрений.
Подсказка: содержание бикарбоната в ммоль/литр должно быть равно азотной кислоты.
Проверка показателя pH воды для полива
Значение pH у воды для полива может быть проверено при помощи pH-метра. Для измерения уровня рН воды для полива, придерживайтесь следующего порядка действий:- Налейте воду, которую собираетесь исследовать, в чистую чашку или измерительный стакан и измерьте ее температуру.

- Промойте датчик рН-метра дистиллированной водой и протрите его салфеткой. Затем, поместите датчик в воду, уровень кислотности которой хотите измерить, и слегка помешайте им.
- Установите температуру измеряемой жидкости на приборе при помощи левостороннего регулятора.
- Подержите датчик в воде на протяжении 1 минуты в неподвижном состоянии.
- Теперь вы можете прочитать уровень рН воды для полива.
- После измерения, опять промойте датчик дистиллированной водой и положите обратно в футляр.
Сопутствующие товары
Все об уровне pH: определение, значение, концентрация
На правильном уровне pH базируется вся химия для бассейна – ее верный выбор и пропорции. Уровень кислотности может быть определен в любых жидких средах – питьевой воде, напитках, моющих средствах. Однако в быту мы чаще всего не придаем значения этому показателю. И только если мы завели аквариум или бассейн, придется познакомиться с показателем pH поближе.
Уровень кислотности может быть определен в любых жидких средах – питьевой воде, напитках, моющих средствах. Однако в быту мы чаще всего не придаем значения этому показателю. И только если мы завели аквариум или бассейн, придется познакомиться с показателем pH поближе.
Для аквариума pH важен, поскольку некоторые рыбы очень чувствительны к нарушению кислотно-щелочного состава воды. А для бассейна оптимальный уровень pH – необходимое условие чистой воды и успешности всех дальнейших мероприятий по уходу за бассейном.
Уровень pH в воде бассейна должен постоянно находиться в границах 7,2 – 7,8.
При пониженном pH (кислотная вода) возможны:
- Коррозия оборудования бассейна
- Раздражение кожи и слизистых купальщиков
- Изменение эффективности хлорных дезинфектантов
При повышенном pH (щелочная вода) возможны:
- Образование накипи на трубах и оборудовании
- Раздражение кожи и слизистых купальщиков
- Усиленный рост микроорганизмов
- Изменение эффективности хлорных дезинфектантов
Общие правила
Казалось бы, с pH в бассейне все ясно и просто:
- Кислотность нужно поддерживать на уровне 7,2 – 7,8
- Измерить pH можно с помощью тестов – таблеточных, индикаторных, капельных или электронных
- Чтобы увеличить pH, нужно добавить средство из серии pH+, чтобы уменьшить – средство из серии pH-
Если pH не меняется
Однако нередко в бассейне возникают проблемы, которые не удается решить привычными средствами, и анализ показывает: причина – в изменении уровня pH. Да и сам уровень pH не всегда одинаково хорошо поддается коррекции.
Да и сам уровень pH не всегда одинаково хорошо поддается коррекции.
Вот некоторые решения нестандартных проблем.
Уровень pH не удается повысить.
Так может получиться, если вы используете кислотные реагенты на основе хлора, например, трихлорид. Влиять на pH может и качество водопроводной воды – если она слишком мягкая, уровень pH может оставаться стабильно низким.
Решение: использовать дезинфектанты с высоким уровнем pH, например, гипохлорит кальция и гипохлорит натрия.
Уровень pH не удается понизить
Возможные причины:
- Действие средств серии pH– нейтрализуется использованием щелочных источников хлорирования, таких как гипохлорит кальция или гипохлорит натрия
- Бассейн заполняется водопроводной водой с повышенной щелочностью.
Решение: Нужно заменить средство хлорирования и подобрать реагент с низким уровнем pH, например, трихлорид. Для быстрого понижения уровня pH можно добавить в воду дихлор, в пропорции 1 кг на 100 м3 в сутки.
В зависимости от качества исходной водопроводной воды стоит использовать средства хлорирования на кислотной или щелочной основе. В случае нейтральной воды хорошо подходит дихлор – наиболее pH-нейтральный из реагентов.
pH баланса питьевой воды
pH баланса питьевой водыpH воды
Питьевая вода
Справочное руководство — Бесплатная информация о качестве воды
и окружающей среде
Информация о воде Тестирование / Очистка воды (ионизаторы)
Ищу сертифицированных — базовый уровень Тестирование воды
Рекомендуемые курсы онлайн-обучения
Железо в воде, Бактерии в воде
Техническое определение pH заключается в том, что это мера активности
ион водорода (H +) и выражается как величина, обратная логарифму
активности ионов водорода.Следовательно, вода с pH 7 имеет 10-7
молей на литр ионов водорода; тогда как pH 6 составляет 10-6 моль на
литр. Шкала pH колеблется от 0 до 14.
Шкала pH колеблется от 0 до 14.
Как правило, вода с pH 7 считается основным. Нормальный диапазон pH в системах поверхностных вод составляет 6,5–8,5 и для систем грунтовых вод 6–8,5. Щелочность — это мера способности воды противостоять изменению pH, которое сделает воду более кислой. В измерение щелочности и pH необходимо для определения коррозионной активности воды.
PH чистой воды (h30) составляет 7 при 25oC, но при воздействии углерода диоксида в атмосфере это равновесие приводит к pH примерно 5.2. Из-за связи pH с атмосферным газов и температуры, настоятельно рекомендуется проверить воду как можно скорее. PH воды не мера силы кислотного или основного раствора и сама по себе не предоставить полное представление о характеристиках или ограничениях водоснабжение.
В общем, вода с низким pH (сине-зеленая окраска раковин и
стоки. В
Основной способ решения проблемы воды с низким pH — использование
нейтрализатор. Нейтрализатор подает раствор в воду для предотвращения
вода вступает в реакцию с водопроводом дома или способствует
электролитическая коррозия; типичным нейтрализующим химическим веществом является кальцинированная сода. Нейтрализация кальцинированной содой увеличивает содержание натрия в воде.
Нейтрализация кальцинированной содой увеличивает содержание натрия в воде.
Вода с pH> 8,5 может указывать на жесткость воды.Жесткая вода не представляет опасности для здоровья, но может вызвать эстетические проблемы. Эти проблемы включают:
- Образование «накипи» или осадка на трубопроводах и арматуре, вызывающее
давление воды и внутренний диаметр трубопроводов уменьшатся;
Придает воде щелочной привкус и может сделать кофе горьким на вкус;
Образование накипи или отложений на посуде, посуде и стирке бассейны;
Затруднение в пенообразовании и образовании мыла и моющих средств нерастворимых осадков на одежде и т. д.; и
Снижает КПД электрических водонагревателей.
Обычно эти проблемы возникают, когда твердость превышает
От 100 до 200 миллиграмм (мг) CaCO3 / литр (л), что эквивалентно 12 зернам на галлон. Воду можно смягчить с помощью ионного обмена или добавления кальцинированной соды, но и то, и другое.
процессы увеличивают содержание натрия в воде.
Примечание: «Идеальный pH уровень щелочной ионизированной воды для длительного потребления человеком находится между 8.5 и 9,5 (и не более 10,0) с идеальным значением ОВП от -200 мВ до -300 мВ (и никоим образом не превышает -400 мВ). (Источник: Bawell Water Ионизаторы) ».
Измерение качества воды (Измерители поля) — Студенты / специалисты
pH обычных жидкостей
| Уксус | 3,0 |
| Вино | 2,8 — 3,8 |
| Пиво | 4-5 |
| Молоко | 6,3 — 6.6 |
| Морская вода | 8,3 |
Курсы онлайн-обучения
Для получения дополнительной информации, обращайтесь:
Attn:
Г-н Брайан Орам, профессиональный геолог (PG)
Центр водных исследований
B. F. Environmental Consultants Inc.
F. Environmental Consultants Inc.
15 Hillcrest Drive
Dallas, PA 18612
Ищу сертифицированных — базовый уровень Тестирование воды
Главная | Программа распространения технологий | Справочные руководства по питьевой воде | Связаться с нами
Us
в наличии
Параметры испытаний
Исследования
Интересы, финансируемые исследования и прикладные исследования
Информация для домовладельцев Проверка воды
Экологическая
Темы — инфильтрация, проницаемость, почвоведение,
Защита устья скважины, подземные воды, водоразделы
Презентации в PowerPoint
Курсы повышения квалификации —
OSHA
Подготовка, Инженеры, Геологи,
Устойчивость, Архитекторы, LEED Professionals
Водораздел
Мониторинг, исследования, обучение,
Исследования озер и водосборов, Гражданский мониторинг, Программы добровольного мониторинга
Водная библиотека — PDF-файлы по вопросам и темам, связанным с водой,
Tools
для экологов, граждан и студентов
Field
Обучение и семинары по наукам о Земле
Affiliations
и горячие ссылки
| Поиск Наш сайт |
Новая партнерская программа
Веб-сайт Разработано:
Профессионалы веб-дизайна. нетто
нетто
Преимущества, побочные эффекты и опасности
Мы включаем продукты, которые мы считаем полезными для наших читателей. Если вы покупаете по ссылкам на этой странице, мы можем получить небольшую комиссию. Вот наш процесс.
Что такое щелочная вода?
Возможно, вы слышали различные утверждения о пользе для здоровья щелочной воды. Некоторые говорят, что это может помочь замедлить процесс старения, отрегулировать уровень pH в организме и предотвратить хронические заболевания, такие как рак. Но что такое щелочная вода и почему такая шумиха?
«Щелочь» в щелочной воде относится к ее уровню pH.Уровень pH — это число, которое измеряет, насколько кислым или щелочным является вещество по шкале от 0 до 14. Например, что-то с pH 1 будет очень кислым, а что-то с pH 13 будет очень щелочным.
Щелочная вода имеет более высокий уровень pH, чем обычная питьевая вода. По этой причине некоторые сторонники щелочной воды считают, что она может нейтрализовать кислоту в организме.
Нормальная питьевая вода обычно имеет нейтральный pH 7. Щелочная вода обычно имеет pH 8 или 9.Однако одного pH недостаточно, чтобы придать воде значительную щелочность.
Щелочная вода также должна содержать щелочные минералы и иметь отрицательный окислительно-восстановительный потенциал (ОВП). ОВП — это способность воды действовать как про- или антиоксидант. Чем отрицательнее значение ОВП, тем больше он антиоксидант.
Щелочная вода несколько спорно. Многие медицинские работники говорят, что недостаточно исследований, чтобы подтвердить многочисленные заявления о пользе для здоровья, сделанные пользователями и продавцами. Различия в результатах исследований могут быть связаны с типами исследований щелочной воды.
По данным Mayo Clinic, обычная вода лучше всего подходит для большинства людей. Они заявляют, что нет никаких научных доказательств, полностью подтверждающих утверждения сторонников щелочной воды.
Однако есть несколько исследований, которые показывают, что щелочная вода может быть полезна при определенных условиях.
Например, исследование 2012 года показало, что употребление натуральной газированной щелочной воды из артезианских колодцев с pH 8,8 может помочь дезактивировать пепсин, основной фермент, вызывающий кислотный рефлюкс.
Другое исследование показало, что употребление щелочной ионизированной воды может быть полезно для людей с высоким кровяным давлением, диабетом и высоким уровнем холестерина.
Более недавнее исследование, в котором участвовало 100 человек, обнаружило значительную разницу в вязкости цельной крови после употребления воды с высоким pH по сравнению с обычной водой после интенсивной тренировки. Вязкость — это прямое измерение того, насколько эффективно кровь течет по сосудам.
Те, кто употреблял воду с высоким pH, снизили вязкость на 6.3 процента по сравнению с 3,36 процента со стандартной очищенной питьевой водой. Это означает, что щелочная вода текла более эффективно. Это может увеличить доставку кислорода по всему телу.
Однако помимо этих небольших исследований необходимы дополнительные исследования. В частности, необходимы исследования, чтобы ответить на другие утверждения сторонников щелочной воды.
В частности, необходимы исследования, чтобы ответить на другие утверждения сторонников щелочной воды.
Несмотря на отсутствие доказанных научных исследований, сторонники щелочной воды по-прежнему верят в ее предполагаемую пользу для здоровья. К ним относятся:
- антивозрастные свойства (за счет жидких антиоксидантов, которые быстрее всасываются в организм человека)
- очищающие свойства толстой кишки
- поддержка иммунной системы
- увлажнение, здоровье кожи и другие детоксицирующие свойства
- потеря веса
- устойчивость к раку
Они также утверждают, что безалкогольные напитки, которые, как известно, являются кислотными, имеют очень положительные ОВП, приводящие ко многим проблемам со здоровьем, в то время как должным образом ионизированная и подщелачиваемая вода имеет крайне отрицательные ОВП.Зеленый чай богат антиоксидантами и имеет немного отрицательный ОВП.
Хотя щелочная питьевая вода считается безопасной, она может вызывать побочные эффекты.
Некоторые примеры негативных побочных эффектов включают снижение естественной кислотности желудка, что помогает убивать бактерии и выводить другие нежелательные патогены из кровотока.
Кроме того, общий избыток щелочности в организме может вызвать желудочно-кишечные проблемы и раздражение кожи. Слишком высокая щелочность также может нарушить нормальный уровень pH в организме, что приведет к метаболическому алкалозу, состоянию, которое может вызывать следующие симптомы:
- тошнота
- рвота
- тремор рук
- мышечные подергивания
- покалывание в конечностях или лице
- путаница
Алкалоз также может вызвать уменьшение свободного кальция в организме, что может повлиять на здоровье костей.Однако наиболее частой причиной гипокальциемии является не употребление щелочной воды, а недостаточная активность паращитовидной железы.
Вода, которая по своей природе является щелочной, образуется, когда вода проходит по камням, например по источникам, и собирает минералы, которые повышают ее щелочной уровень.
Однако многие люди, которые пьют щелочную воду, покупают щелочную воду, прошедшую химический процесс, называемый электролизом.
В этом методе используется продукт, называемый ионизатором, для повышения pH обычной воды.Создатели ионизаторов говорят, что электричество используется для разделения более кислых или более щелочных молекул в воде. Затем кислая вода сливается.
Тем не менее, некоторые врачи и исследователи говорят, что эти утверждения не подтверждаются качественными исследованиями. Качество воды из первоначального источника до ионизации имеет решающее значение для обеспечения отсутствия загрязняющих веществ в питьевой воде.
Некоторые ученые советуют использовать обратный осмос для надлежащей очистки воды перед подключением щелочного ионизатора, который может повысить pH и добавить минералы.
Исследование, опубликованное Всемирной организацией здравоохранения, предостерегает от употребления питьевой воды с низким содержанием минералов, которую регулярно получают путем обратного осмоса, дистилляции и других методов (без дополнительной минерализации).
Щелочную воду можно купить во многих продуктовых магазинах или магазинах здорового питания. Его также можно найти в Интернете.
Ионизаторы воды также продаются во многих крупных сетевых магазинах.
Вы также можете сделать это самостоятельно дома. Несмотря на то, что соки лимона и лайма являются кислыми, они содержат минералы, которые могут создавать щелочные побочные продукты после переваривания и метаболизма.Добавление лимона или лайма в стакан воды может сделать воду более щелочной по мере ее переваривания организмом. Добавление капель pH или пищевой соды — еще один способ сделать воду более щелочной.
Если вода правильно фильтруется для удаления загрязняющих веществ, ионизирована и повторно минерализована или куплена из качественного источника, нет никаких доказательств, указывающих на ограничение количества щелочной воды, которое можно употреблять ежедневно.
Проблема, с которой сталкиваются многие медицинские работники с щелочной водой, заключается не в ее безопасности, а скорее в ее заявлениях о ее здоровье.
Недостаточно научных доказательств, подтверждающих использование щелочной воды для лечения любого заболевания. Медицинские эксперты предупреждают, что нельзя верить всем маркетинговым утверждениям.
Питьевая природная щелочная вода обычно считается безопасной, так как она содержит природные минералы.
Тем не менее, вы должны проявлять осторожность с искусственной щелочной водой, которая, вероятно, содержит меньше полезных минералов, чем вы думаете, ее высокий pH и может содержать загрязняющие вещества. Также имейте в виду, что употребление слишком большого количества щелочной воды может вызвать дефицит минералов.
Значения pH питьевой воды полностью объяснены
|
| 1 | 2 |
pH и вода
Итак, что означает pH для воды? По сути, значение pH является хорошим индикатором того, жесткая или мягкая вода.PH чистой воды равен 7. Как правило, вода с pH ниже 7 считается кислой, а с pH выше 7 — щелочной. Нормальный диапазон pH в системах поверхностных вод составляет от 6,5 до 8,5, а диапазон pH для систем грунтовых вод составляет от 6 до 8,5. Щелочность — это мера способности воды противостоять изменению pH, которое может сделать воду более кислой. Для определения коррозионной активности воды необходимо использовать измерение щелочности и pH.
Обычно вода с pH <6.5 может быть кислотным, мягким и едким. Кислая вода может содержать ионы металлов, таких как железо, марганец, медь, свинец и цинк. Другими словами, кислая вода содержит повышенный уровень токсичных металлов. Кислая вода может вызвать преждевременное повреждение металлических трубопроводов и иметь связанные с этим эстетические проблемы, такие как металлический или кислый привкус. Он также может окрашивать белье и вызывать сине-зеленые пятна на раковинах и стоках. Что еще более важно, эти токсины сопряжены с рядом рисков для здоровья. Основной способ решить проблему воды с низким pH — использовать нейтрализатор.Нейтрализатор подает раствор в воду, чтобы вода не вступала в реакцию с водопроводом или не способствовала электролитической коррозии. Типичным нейтрализующим химическим веществом является кальцинированная сода. Кальцинированная сода, также известная как карбонат натрия, увеличивает содержание натрия, что увеличивает pH. Вода с pH> 8,5 может указывать на жесткость воды. Жесткая вода не только опасна для здоровья, но и может вызвать эстетические проблемы. Эти проблемы включают щелочной привкус воды (из-за чего утренний кофе становится горьким!), Образование отложений накипи на посуде, посуде и тазах для стирки, трудности с мылом и моющими средствами, а также образование нерастворимых осадков на одежде.
Другими словами, кислая вода содержит повышенный уровень токсичных металлов. Кислая вода может вызвать преждевременное повреждение металлических трубопроводов и иметь связанные с этим эстетические проблемы, такие как металлический или кислый привкус. Он также может окрашивать белье и вызывать сине-зеленые пятна на раковинах и стоках. Что еще более важно, эти токсины сопряжены с рядом рисков для здоровья. Основной способ решить проблему воды с низким pH — использовать нейтрализатор.Нейтрализатор подает раствор в воду, чтобы вода не вступала в реакцию с водопроводом или не способствовала электролитической коррозии. Типичным нейтрализующим химическим веществом является кальцинированная сода. Кальцинированная сода, также известная как карбонат натрия, увеличивает содержание натрия, что увеличивает pH. Вода с pH> 8,5 может указывать на жесткость воды. Жесткая вода не только опасна для здоровья, но и может вызвать эстетические проблемы. Эти проблемы включают щелочной привкус воды (из-за чего утренний кофе становится горьким!), Образование отложений накипи на посуде, посуде и тазах для стирки, трудности с мылом и моющими средствами, а также образование нерастворимых осадков на одежде.
Согласно исследованию Университета Уилкса, связь pH с атмосферными газами и температурой является основной причиной, по которой образцы воды следует проверять на регулярной основе. В исследовании говорится, что значение pH воды не является мерой силы кислотного или основного раствора и само по себе не может предоставить полную картину характеристик или ограничений, связанных с подачей воды.
В то время как идеальный уровень pH питьевой воды должен быть от 6 до 8.5, человеческое тело постоянно поддерживает равновесие pH, и на него не влияет потребление воды. Например, наш желудок имеет естественный низкий уровень pH 2, который является полезной кислотностью, которая помогает нам переваривать пищу.
| 1 | 2 |
Читать дальше: Важность воды и здоровья человека
pH воды — Системы измерения окружающей среды
Что такое pH?
pH — это определенное значение на основе определенной шкалы, аналогичное температуре.Это означает, что pH воды не является физическим параметром, который можно измерить как концентрацию или количество. Вместо этого, это число от 0 до 14, определяющее, насколько кислым или основным является водоем по логарифмической шкале ¹. Чем меньше число, тем более кислая вода. Чем выше число, тем оно более базовое. PH 7 считается нейтральным. Логарифмическая шкала означает, что каждое число ниже 7 в 10 раз более кислое, чем предыдущее при обратном отсчете. Точно так же, если считать выше 7, каждое число в 10 раз больше основного, чем предыдущее число ².
pH означает «мощность водорода» ³. Числовое значение pH определяется молярной концентрацией ионов водорода (H +) ³. Это делается путем отрицательного логарифма концентрации H + (-log (H +)). Например, если в растворе концентрация H + составляет 10 -3 M, pH раствора будет -log (10 -3 ), что равно 3.
Это определение связано с влиянием ионов водорода (H +) и гидроксильных ионов (OH-) на pH. Чем выше концентрация H +, тем ниже pH, и чем выше концентрация OH-, тем выше pH. При нейтральном pH 7 (чистая вода) концентрация как ионов H +, так и ионов OH- составляет 10⁻⁷ M. Таким образом, ионы H + и OH- всегда спарены — по мере увеличения концентрации одного из них концентрация другого будет уменьшаться; независимо от pH сумма ионов всегда будет равна 10⁻¹⁴ M ². Из-за этого влияния H + и OH- относятся к основным определениям кислот и оснований.
Из-за этого влияния H + и OH- относятся к основным определениям кислот и оснований.
Кислоты и основания
Пары кислот и оснований могут нейтрализовать друг друга, как H + и OH- в этом уравнении. Согласно рабочему определению, кислота — это вещество, которое снижает pH при добавлении в чистую воду. Таким же образом, основа — это вещество, которое увеличивает pH воды ⁴. Для дальнейшего определения этих веществ Аррениус в 1884 году определил, что кислота выделяет ион водорода (H +) при растворении в воде, а основание выделяет ион гидроксила (OH-) в воде ⁴.Однако есть некоторые вещества, которые подходят под рабочее определение (изменение pH), но не подходят под определение Аррениуса (высвобождение иона). Чтобы учесть это, Бренстед и Лоури изменили определение кислот и оснований; кислота выделяет ион водорода или протон (эквивалент H +), а основание принимает ион водорода или протон ⁴. Это означает, что кислоты и основания могут нейтрализовать друг друга, как показано в уравнении воды справа.
Основные или щелочные
Общие примеры щелочей включают молоко магнезии — Mg (OH) 2, едкий калий — KOH, гашеную известь / известковую воду — Ca (OH) 2 и каустическую соду (щелок) — NaOH. Термины «щелочной» и «основной» означают примерно одно и то же. Согласно определению Бренстеда-Лоури, под основным понимается любое вещество, которое снижает концентрацию ионов водорода и увеличивает pH воды, или, другими словами, основание. Щелочь происходит от щелочи, которая относится к ионным соединениям (солям), содержащим щелочные или щелочноземельные металлы, которые при растворении в воде образуют ионы гидроксида. Щелочные соли очень распространены и легко растворяются. Из-за производимых ими гидроксид-ионов (которые увеличивают pH) все щелочи являются основаниями.Некоторые источники определяют любое растворимое основание как щелочь ⁵. Как таковые, растворимые основания можно описать как «основные» или «щелочные». Однако нерастворимые основания (такие как оксид меди) следует описывать только как основные, а не щелочные.
Щелочность и pH воды
Щелочность и pH напрямую связаны при 100% насыщении воздухом. Щелочность не относится к щелочам в отличие от щелочей ⁶. Хотя щелочность и pH тесно связаны, между ними есть явные различия. Щелочность воды или раствора — это количественная способность этого раствора буферизовать или нейтрализовать кислоту.Другими словами, щелочность — это показатель способности воды сопротивляться изменениям pH. Этот термин используется как синонимы кислотонейтрализующей способности (ANC) ⁷. Если водоем имеет высокую щелочность, это может ограничить изменения pH из-за кислотных дождей, загрязнения или других факторов ⁸. Щелочность ручья или другого водоема увеличивается за счет богатых карбонатами почв (карбонаты и бикарбонаты), таких как известняк, и уменьшается за счет оттока сточных вод и аэробного дыхания. Из-за присутствия карбонатов щелочность больше связана с жесткостью, чем с pH (хотя все же есть явные различия).Однако изменения pH также могут влиять на уровень щелочности (при снижении pH снижается и буферная способность воды) ⁶. pH и щелочность напрямую связаны, когда вода имеет 100% насыщение воздухом ⁹.
pH и щелочность напрямую связаны, когда вода имеет 100% насыщение воздухом ⁹.
Щелочность воды также играет важную роль в ежедневном уровне pH. В процессе фотосинтеза водорослями и растениями используется водород, что увеличивает уровень pH ¹⁰. Точно так же дыхание и разложение могут снизить уровень pH. Большинство водоемов способны нейтрализовать эти изменения благодаря своей щелочности, поэтому небольшие или локальные колебания быстро видоизменяются, и их может быть трудно обнаружить detect.
Единицы измерения pH и щелочности
Значения pH определяются по логарифмической шкале. Значения pHпредставлены в виде числа от 0 до 14 в качестве стандартной единицы pH. Эта единица эквивалентна отрицательному логарифму молярной концентрации ионов водорода (-log (H +)) в растворе. В зависимости от точности измерения значение pH может быть указано с точностью до одного или двух десятичных знаков.
Однако, поскольку шкала pH логарифмическая, попытка усреднить два значения pH была бы математически неверной.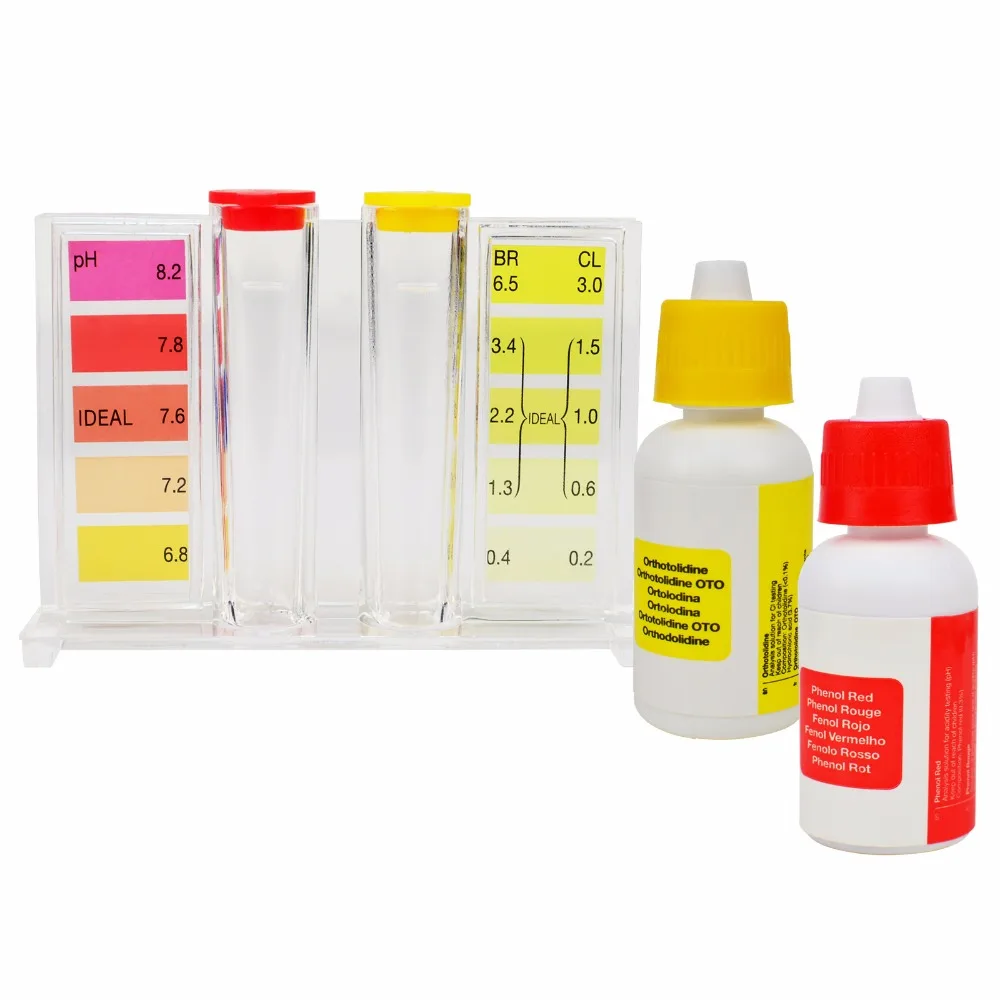 Если требуется среднее значение, оно может быть указано как медиана или диапазон, а не как простой расчет ¹⁰.
Если требуется среднее значение, оно может быть указано как медиана или диапазон, а не как простой расчет ¹⁰.
Щелочность может быть выражена в мг / л или в микроэквивалентах на литр (мэкв / л). Когда в мг / л, это относится к концентрациям карбоната (CO3 2-), бикарбоната (HCO3 —) или карбоната кальция (CaCO3), хотя карбонат кальция является наиболее распространенным ¹¹.
Щелочность 1 мг / л в пересчете на CaCO3 = 0,01998 мег / л щелочность
Щелочность 1 мг / л в пересчете на CaCO3 = 0,5995 мг / л щелочность в пересчете на CO3 2-
Щелочность 1 мг / л при CaCO3 = 1.2192 мг / л щелочность по HCO3 —
Почему важен pH?
Если pH воды будет слишком высоким или слишком низким, обитающие в ней водные организмы погибнут. pH также может влиять на растворимость и токсичность химических веществ и тяжелых металлов в воде ¹². Большинство водных существ предпочитают диапазон pH 6,5-9,0, хотя некоторые могут жить в воде с уровнем pH за пределами этого диапазона.
По мере того, как уровень pH выходит за пределы этого диапазона (вверх или вниз), это может вызвать стресс у систем животных и снизить показатели вылупления и выживаемости. Чем дальше значение pH выходит за пределы оптимального диапазона, тем выше уровень смертности. Чем более чувствителен вид, тем больше на него влияют изменения pH. Помимо биологических эффектов, экстремальные уровни pH обычно увеличивают растворимость элементов и соединений, делая токсичные химические вещества более «мобильными» и повышая риск поглощения их водными организмами ¹³.
Не только водные виды подвержены влиянию pH. Хотя люди имеют более высокую толерантность к уровням pH (уровни для питья колеблются от 4 до 11 с минимальным раздражением желудочно-кишечного тракта), все еще существуют проблемы ¹⁴. Значения pH выше 11 могут вызвать раздражение кожи и глаз, равно как и pH ниже 4. Значение pH ниже 2,5 вызовет необратимое повреждение кожи и внутренних органов ¹⁴. Более низкие уровни pH увеличивают риск мобилизации токсичных металлов, которые могут абсорбироваться даже людьми, и уровни выше 8.0 нельзя эффективно дезинфицировать хлором, что вызывает другие косвенные риски ¹⁴. Кроме того, уровни pH за пределами 6,5-9,5 могут повредить трубы и другие системы и вызвать коррозию, что еще больше повысит токсичность тяжелых металлов.
Значение pH ниже 2,5 вызовет необратимое повреждение кожи и внутренних органов ¹⁴. Более низкие уровни pH увеличивают риск мобилизации токсичных металлов, которые могут абсорбироваться даже людьми, и уровни выше 8.0 нельзя эффективно дезинфицировать хлором, что вызывает другие косвенные риски ¹⁴. Кроме того, уровни pH за пределами 6,5-9,5 могут повредить трубы и другие системы и вызвать коррозию, что еще больше повысит токсичность тяжелых металлов.
Даже незначительные изменения pH могут иметь долгосрочные последствия. Небольшое изменение pH воды может увеличить растворимость фосфора и других питательных веществ, что сделает их более доступными для роста растений ¹⁰.В олиготрофном озере или озере с низким содержанием питательных веществ для растений и высоким уровнем растворенного кислорода это может вызвать цепную реакцию. Благодаря более доступным питательным веществам, водные растения и водоросли процветают, увеличивая потребность в растворенном кислороде. Это создает эвтрофное озеро, богатое питательными веществами и растениями, но с низким содержанием растворенного кислорода. В эвтрофном озере другие организмы, живущие в воде, будут испытывать стресс, даже если уровень pH останется в оптимальном диапазоне.
Благодаря более доступным питательным веществам, водные растения и водоросли процветают, увеличивая потребность в растворенном кислороде. Это создает эвтрофное озеро, богатое питательными веществами и растениями, но с низким содержанием растворенного кислорода. В эвтрофном озере другие организмы, живущие в воде, будут испытывать стресс, даже если уровень pH останется в оптимальном диапазоне.
Факторы, влияющие на pH воды
Есть много факторов, которые могут повлиять на pH в воде, как естественные, так и искусственные.Большинство естественных изменений происходят из-за взаимодействия с окружающими породами (особенно карбонатными формами) и другими материалами. pH также может колебаться в зависимости от количества осадков (особенно кислотных дождей), сточных вод или горных стоков ¹³. Кроме того, концентрация CO2 может влиять на уровень pH.
Углекислый газ и pH
Уровни pH могут изменяться ежедневно из-за фотосинтеза и дыхания в воде. Степень изменения зависит от щелочности воды.
Степень изменения зависит от щелочности воды.Двуокись углерода — наиболее частая причина кислотности воды ¹⁵.Фотосинтез, дыхание и разложение — все это способствует колебаниям pH из-за своего влияния на уровень CO2. Крайность этих изменений зависит от щелочности воды, но часто наблюдаются заметные суточные (суточные) колебания ¹⁶. Это влияние более ощутимо в водоемах с высокой скоростью дыхания и разложения.
Хотя диоксид углерода существует в воде в растворенном состоянии (например, кислород), он также может реагировать с водой с образованием угольной кислоты:
CO2 + h3O <=> h3CO3
h3CO3 может затем потерять один или оба своих иона водорода. :
h3CO3 <=> HCO3 — + H +….HCO3 — <=> CO3 2- + H +
Высвободившиеся ионы водорода снижают pH воды¹⁵. Однако это уравнение может работать в обоих направлениях в зависимости от текущего уровня pH, работая как собственная буферная система. При более высоком pH эта бикарбонатная система сместится влево, и CO3 2- будет улавливать свободный ион водорода.
Эта реакция обычно минимальна, так как h3CO3 имеет низкую константу растворимости (закон Генри) ¹⁵. Однако по мере того, как уровни CO2 увеличиваются во всем мире, количество растворенного CO2 также увеличивается, и уравнение будет выполняться слева направо.Это увеличивает h3CO3, что снижает pH. Эффект становится все более очевидным в исследованиях pH океана с течением времени.
Общее изменение годовых уровней pH океана с 1700-х по 1990-е годы. (данные: Атлас Мирового океана 2009; фото предоставлено: Plumbago; Wikipedia Commons) Углекислый газ в атмосфере снижает pH осадков. Приведенные выше уравнения также объясняют, почему дождь имеет pH примерно 5,65 ¹⁵. Когда капли дождя падают в воздух, они взаимодействуют с молекулами углекислого газа в атмосфере.В результате в каплях дождя образуется h3CO3, что снижает уровень pH дождя ¹⁷. Уровень pH 5,65, хотя и является кислым, не считается кислотным дождем. Ожидается, что естественный, незагрязненный дождь или снег будет иметь уровень pH около 5,6 при стандартной концентрации CO2 в атмосфере 0,0355% ¹⁵.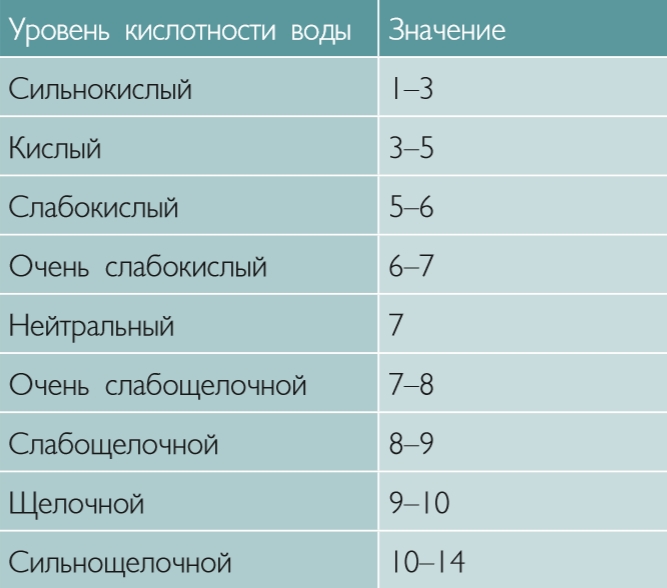 Кислотный дождь требует pH ниже 5,0 ²¹.
Кислотный дождь требует pH ниже 5,0 ²¹.
5,65 — это также pH воды, которая уравновешивается с воздухом и не контактирует с карбонатными материалами или известняком.
Влияние естественного pH
Карбонатные материалы и известняк — два элемента, которые могут нейтрализовать изменения pH в воде.Карбонат кальция (CaCO3) и другие бикарбонаты могут сочетаться с ионами водорода или гидроксила для нейтрализации pH¹⁸. Когда в почве присутствуют карбонатные минералы, буферная способность (щелочность) воды увеличивается, поддерживая pH воды близким к нейтральному даже при добавлении кислот или оснований. Дополнительные карбонатные материалы могут сделать нейтральную воду слегка щелочной.
Известняковые карьеры имеют более высокий уровень pH из-за карбонатных материалов в камне. Молния может снизить pH дождя. Как упоминалось ранее, незагрязненный дождь имеет слабокислый характер (pH 5,6). Уровень pH дождя также может быть понижен из-за вулканического пепла, сульфатредуцирующих бактерий на заболоченных территориях, взвешенных в воздухе твердых частиц от лесных пожаров и даже молний ¹⁹. Если дождь попадает в источник воды с плохой буферностью, он может снизить pH ближайшей воды из-за стока.
Если дождь попадает в источник воды с плохой буферностью, он может снизить pH ближайшей воды из-за стока.
Хвоя сосны или пихты также может снижать pH почвы и воды, протекающей по ней, поскольку они разлагаются ¹⁸. Интенсивный фотосинтез увеличивает pH воды, поскольку она удаляет CO2, хотя это изменение обычно является суточным ²⁰.
Искусственные факторы воздействия на pH
Загрязнения воздуха, почвы или непосредственно в воде могут влиять на pH. Антропогенные причины колебаний pH обычно связаны с загрязнением. Кислотный дождь — один из самых известных примеров человеческого влияния на pH воды. Любая форма осадков с уровнем pH менее 5,0 известна как кислотный дождь ²¹. Это осаждение происходит в результате реакции воды с оксидами азота, оксидами серы и другими кислотными соединениями, что снижает и без того слабокислый pH.Эти выбросы обычно происходят в результате горнодобывающих и плавильных работ или сжигания ископаемого топлива (сжигание угля и автомобили) ¹⁸. Чрезвычайно высокий уровень CO2 может еще больше снизить pH дождя ¹⁷.
Чрезвычайно высокий уровень CO2 может еще больше снизить pH дождя ¹⁷.
Загрязнение из точечных источников — распространенная причина, которая может повышать или понижать pH в зависимости от используемых химических веществ ¹⁸. Эти химические вещества могут поступать из сельскохозяйственных стоков, сточных вод или промышленных стоков. Добыча полезных ископаемых (особенно угля) вызывает кислотный сток и просачивание кислых грунтовых вод, если окружающая почва плохо забуферена ²².Сброс сточных вод, содержащих моющие средства и продукты на основе мыла, может привести к тому, что источник воды станет слишком простым.
Типичные уровни pH
Рекомендуемые минимальные уровни pH для водных организмов. Типичные уровни pH меняются из-за влияния окружающей среды, особенно щелочности. Щелочность воды зависит от наличия растворенных солей и карбонатов, а также от минерального состава окружающей почвы. Как правило, чем выше щелочность, тем выше pH; чем ниже щелочность, тем ниже pH ⁶. Рекомендуемый диапазон pH для большинства рыб составляет от 6,0 до 9,0 с минимальной щелочностью 20 мг / л, с идеальным уровнем CaCO3 от 75 до 200 мг / л²⁰.
Рекомендуемый диапазон pH для большинства рыб составляет от 6,0 до 9,0 с минимальной щелочностью 20 мг / л, с идеальным уровнем CaCO3 от 75 до 200 мг / л²⁰.
Океаническим организмам, таким как рыба-клоун и коралл, требуется более высокий уровень pH. Уровень pH ниже 7,6 приведет к разрушению коралловых рифов из-за недостатка карбоната кальция ³⁹. Чувствительные пресноводные виды, такие как лосось, предпочитают уровни pH от 7,0 до 8,0, сильно расстраиваясь и страдая от физиологических повреждений из-за поглощения металлов на уровнях ниже 6.0 ⁴⁰.
Экологические аспекты
Естественные осадки, как дождевые, так и снежные, имеют pH около 5,6 из-за контакта с CO2 и других атмосферных воздействий. Большинство злаковых и бобовых культур предпочитают почвы с pH 4,5-7,0, поэтому небольшая кислотность дождя может принести пользу карбонатным почвам ²³.
Кислотность окружающей среды также может влиять на pH воды. Это наиболее очевидно вблизи районов добычи полезных ископаемых, но эффект может возникать и естественным путем. Кислотный сток снижает щелочность воды и снижает pH ниже оптимального уровня.Это может быть терпимо для некоторых водных видов (например, лягушек), но не для большинства рыб. Некоторые лягушки и другие земноводные часто могут переносить уровень pH ниже 4,0 ²⁴. Кислые почвы в Амазонке приводят к тому, что многие озера и реки естественным образом имеют низкие значения pH ³⁸. Из-за растворенных гуминовых веществ от стока и поглощения источники «черной воды» могут иметь pH до 4,43. Источники «Клируотер» будут иметь немного более высокое, но все же кислое значение pH ³⁸. Вот почему рыбы-ангелы и дискусы из бассейна реки Амазонки могут вполне успешно развиваться в водах с уровнем pH всего 5.0 ²⁵.
Кислотный сток снижает щелочность воды и снижает pH ниже оптимального уровня.Это может быть терпимо для некоторых водных видов (например, лягушек), но не для большинства рыб. Некоторые лягушки и другие земноводные часто могут переносить уровень pH ниже 4,0 ²⁴. Кислые почвы в Амазонке приводят к тому, что многие озера и реки естественным образом имеют низкие значения pH ³⁸. Из-за растворенных гуминовых веществ от стока и поглощения источники «черной воды» могут иметь pH до 4,43. Источники «Клируотер» будут иметь немного более высокое, но все же кислое значение pH ³⁸. Вот почему рыбы-ангелы и дискусы из бассейна реки Амазонки могут вполне успешно развиваться в водах с уровнем pH всего 5.0 ²⁵.
Морская вода имеет pH около 8,2, хотя он может колебаться от 7,5 до 8,5 в зависимости от местной солености. Уровень pH будет увеличиваться с увеличением солености, пока вода не достигнет насыщения карбонатом кальция (CaCO3) ¹⁶. Океаны обычно имеют более высокую щелочность из-за содержания карбонатов и, следовательно, обладают большей способностью буферизовать свободные ионы водорода ²⁷.
Пресноводные озера, пруды и ручьи обычно имеют pH 6-8 в зависимости от окружающей почвы и коренных пород ²¹. В более глубоких озерах, где происходит расслоение (расслоение), pH воды обычно выше (7.5-8,5) у поверхности и ниже (6,5-7,5) на большей глубине ¹⁰. Некоторые штаты, такие как Аляска, пытаются поддерживать стандарт pH для качества воды. Стандарт качества воды Аляски требует уровней pH от 6,5 до 8,5 для защиты многих популяций лосося в штате.
Соображения по стратификации
Стратификация может привести к тому, что уровни pH в водоеме будут различаться выше и ниже границы. Стратификация обычно вызывается разницей температур в водоеме, где каждый слой воды не смешивается со слоями выше или ниже ³⁷.Эти слои разделены клиньями, известными как термоклины (температурные разницы) или хемоклины (химические градиенты). Хемоклины могут быть основаны на кислороде, солености или других химических факторах, которые не пересекают границу, таких как двуокись углерода. Из-за влияния СО2 на pH воды стратификация может привести к тому, что уровни pH будут различаться в зависимости от климата.
Различия в уровнях pH между слоями воды возникают из-за увеличения CO2 в результате дыхания и разложения ниже термоклина. В кратерных озерах, таких как озеро Ниос или озеро Моноун, pH быстро падает с поверхностного уровня примерно с 7 до 5.5 ниже 60 м (на термоклине и хемоклине) ²⁶. Это значительное падение происходит из-за насыщенного CO2, который накапливается в нижних слоях озера.
Приспособляемость
Хотя идеальные уровни pH для рыб составляют 7-8 (кровь рыбы имеет pH 7,4) ²⁰, большинство рыб могут адаптироваться к уровню pH окружающей среды (6,0-9,0), если нет резких колебаний . Резкое колебание считается сдвигом pH на 1,4 (вверх или вниз) ²². Для морской рыбы pH воды должен оставаться в пределах 7.5 и 8,5.
Необычные уровни pH и последствия
Каменные кораллы начинают обесцвечиваться и портиться по мере падения уровня карбоната и pH. Вредное воздействие становится заметным, когда pH воды падает ниже 5,0 или поднимается выше 9,6. Болезни из-за подкисления более выражены у морских рыб из-за их адаптации к более высокому pH. Когда pH ниже оптимального, рыба становится восприимчивой к грибковым инфекциям и другим физическим повреждениям ¹⁶. Когда pH воды падает, растворимость карбоната кальция снижается, что препятствует росту раковины у водных организмов ¹⁶.В целом, на воспроизводство рыб влияет уровень pH ниже 5,0, и многие виды (например, морская рыба или чувствительная пресноводная рыба, такая как малоротый окунь) покидают этот район ²¹. Рыба начинает умирать, когда pH падает ниже 4,0 ².
Болезни из-за подкисления более выражены у морских рыб из-за их адаптации к более высокому pH. Когда pH ниже оптимального, рыба становится восприимчивой к грибковым инфекциям и другим физическим повреждениям ¹⁶. Когда pH воды падает, растворимость карбоната кальция снижается, что препятствует росту раковины у водных организмов ¹⁶.В целом, на воспроизводство рыб влияет уровень pH ниже 5,0, и многие виды (например, морская рыба или чувствительная пресноводная рыба, такая как малоротый окунь) покидают этот район ²¹. Рыба начинает умирать, когда pH падает ниже 4,0 ².
Низкий уровень pH может способствовать растворению тяжелых металлов ¹². По мере увеличения уровня ионов водорода катионы металлов, таких как алюминий, свинец, медь и кадмий, попадают в воду, а не поглощаются осадком. По мере увеличения концентрации тяжелых металлов их токсичность также увеличивается.Алюминий может ограничивать рост и размножение, одновременно увеличивая уровень смертности при концентрациях всего 0,1-0,3 мг / л²². Кроме того, мобилизованные металлы могут поглощаться организмами во время дыхания, вызывая физиологический ущерб ²². Это особенно вредно для таких видов, как радужная форель ¹³.
Кроме того, мобилизованные металлы могут поглощаться организмами во время дыхания, вызывая физиологический ущерб ²². Это особенно вредно для таких видов, как радужная форель ¹³.
С другой стороны, высокие уровни pH могут повредить жабры и кожу водных организмов и вызвать смерть при уровнях выше 10,0. В то время как некоторые африканские цихлиды хорошо себя чувствуют при высоком уровне pH (до 9.5), большинство рыб их не переносят. Смерть может наступить даже при обычном уровне (9,0), если в воде присутствует аммиак ²¹. При низком и нейтральном уровнях pH аммиак соединяется с водой с образованием иона аммония:
Nh4 + h3O <=> Nh5 + + OH —
Водоросли, устойчивые к низкому pH, могут образовывать цветы, которые могут убить озеро. Аммоний, Nh5⁺, нетоксичен и не влияет на водные организмы. Однако при уровне pH выше 9 уравнение меняется на противоположное, и аммиак попадает в воду ²².Аммиак, Nh4, чрезвычайно токсичен для водных организмов, и по мере увеличения pH уровень смертности увеличивается с увеличением концентрации Nh4.
Со стороны экосистемы мхи могут начать вторгаться в водоем, когда pH воды падает ниже 5. В эвтрофных озерах могут преобладать водоросли, толерантные к pH, приводя уровни pH к дневным высоким и низким экстремальным значениям, образуя цветение водорослей, может убить озеро ¹⁶.
Щелочные и кислотные озера
По всему миру разбросано множество озер с необычным уровнем pH.Щелочные озера, также известные как содовые озера, обычно имеют уровень pH от 9 до 12. Это часто связано с высоким содержанием соли (хотя не все соленые озера имеют высокий pH). Эти озера имеют высокую концентрацию минералов, особенно растворенных солей: карбонатов и бикарбонатов натрия, кальция, магния ²⁸. В зависимости от озера также могут присутствовать бораты, сульфаты и другие элементы (обычно сильные основные ионы) ²⁹. Щелочные озера образуются, когда единственным выходом для воды является испарение, оставляя минералы для накопления ³.Эти минералы часто образуют колонны минеральных отложений, известные как колонны туфа. Многие щелочные озера являются коммерческим источником кальцинированной соды и поташа, в то время как другие являются популярными туристическими направлениями из-за их «волшебных» целебных свойств (из-за содержания минералов).
Многие щелочные озера являются коммерческим источником кальцинированной соды и поташа, в то время как другие являются популярными туристическими направлениями из-за их «волшебных» целебных свойств (из-за содержания минералов).
Печально известный пример щелочного озера — озеро Натрон в Танзании. Озеро Натрон имеет pH до 10,5 из-за высоких концентраций декагидрата карбоната натрия (кальцинированной соды) и бикарбоната натрия (пищевой соды), которые попадают в воду из окружающей почвы ³¹. Хотя озеро поддерживает процветающую экосистему, включая фламинго, щелочную тилапию и водоросли, устойчивые к pH, фотограф Ник Брант создал множество захватывающих изображений животных, погибших в этом озере ³¹. Тела этих животных сохраняются карбонатом натрия, очень похоже на древнеегипетский процесс мумификации.
Тела этих животных сохраняются карбонатом натрия, очень похоже на древнеегипетский процесс мумификации.
Кислотные озера обычно образуются около вулканов, где серная кислота, сероводород, плавиковая кислота, соляная кислота и диоксид углерода могут попадать в воду ³². В невулканических районах кислотные озера также могут образовываться после кислотных отложений в результате таких явлений, как кислотные дожди, загрязнение или кислотный сток в результате горных работ ³³. Как и их щелочные аналоги, кислотные озера не имеют выхода, кроме испарения, в котором концентрируются сульфаты и кислоты. Кислоты могут попадать в воду через атмосферную диффузию в результате сжигания угля, кислотных дождей или после извержения.В вулканических озерах кислоты могут попадать в воду через активную фумаролу или вулканический источник.
Отложения серы и железа на одном из кислых озер Даллола. Кислотные озера Даллола в Эфиопии — результат кислотного выщелачивания из близлежащих вулканов. Сера и железо в воде оставляют желтые и ржавые отложения у кромки воды.
При уровне pH ниже 5,0 немногие организмы могут жить в кислых озерах. Однако есть одно заметное исключение: ельца Осорезан, или японская ельца.Эта рыба процветает в кислых водах озера Осорезан, комфортно отдыхает при pH 3,5 и плавает в водах с нейтральным pH только для нереста ³⁴.
Подкисление океана
По мере увеличения содержания CO2 в атмосфере растворенный CO2 будет увеличиваться, а pH воды снизится. (данные: NOAA / ESRL и Гавайский университет; предоставлено SERC EarthLabs)Подкисление океана вызвано притоком растворенного диоксида углерода. Поскольку уровни CO2 в атмосфере увеличиваются из-за антропогенных причин, растворенный CO2 также увеличивается, что, в свою очередь, снижает pH воды.
Когда вода насыщается CO2, это не только снижает pH океана, но и истощает источники карбоната кальция ³⁵. Карбонат кальция, CaCO3, является необходимым ингредиентом для создания кораллов, раковин и экзоскелетов многих водных существ. По мере того, как уровень CO3² уменьшается, морским существам становится все труднее строить свои раковины.
Как упоминалось в разделе «Двуокись углерода и pH», дополнительный CO2 увеличивает количество ионов водорода в воде, снижая pH:
CO2 + h3O <=> h3CO3… h3CO3 <=> (H +) + HCO3⁻
При уровне pH от 6.4 и 10.33, некоторые из этих ионов водорода присоединяются к карбонатным ионам ²²:
(H +) + CO3 2- <=> HCO3 —
Таким образом, по мере увеличения уровня CO2 доступность карбоната, CO3 2- уменьшается, уменьшая количество ³, доступное для строительства из раковин и кораллов.
CO2 + h3O + CO3²⁻ <=> 2HCO3⁻
При pH в океане 8,3 уровень карбонатов достаточно высок для строительства кораллов. По мере увеличения CO2 и снижения pH уровень карбонатов быстро падает ниже оптимального уровня.Высокий уровень CO2 также затрудняет поддержание текущих скорлуп из-за более низкого уровня pH и конкуренции за карбонат ³⁵.
Кроме того, воздухонасыщение воды основано на парциальных давлениях из закона Генри. По мере увеличения уровня CO2 в воздухе растет и их парциальное давление. Это снижает парциальное давление кислорода, снижая уровень его насыщения и способствуя гипоксии (низкий уровень O2) ³⁵.
Это снижает парциальное давление кислорода, снижая уровень его насыщения и способствуя гипоксии (низкий уровень O2) ³⁵.
Хотя океаны никогда не станут «кислыми» (с pH менее 7), даже небольшое понижение pH вызывает стресс у морских организмов и увеличивает уровень смертности.pH является логарифмическим, что означает, что уменьшение на 0,1 эквивалентно почти 30% увеличению кислотности ³⁵.
Процитируйте эту работу
Fondriest Environmental, Inc. «pH воды». Основы экологических измерений. 19 ноября 2013 г. Web.
Дополнительная информация
pH
Стандарты Юты Допустимый диапазон pH 6. |
pH — это показатель кислотности или щелочности чего-либо. Измеряется по шкале от 0 до 14. Кислотные значения находятся в диапазоне от 0 до 7, где 0 является наиболее кислотным. Основные числа от 7 до 14 лет. Нейтральный pH равен 7 (примером может быть дистиллированная вода).В Шкала pH, как и шкала Рихтера, логарифмическая. Это означает, что каждая единица изменения (например, от 5 до 6) — это десятикратное изменение pH вещества. Вода с pH 5 в 10 раз кислотнее воды с pH 6.
Природные факторы, влияющие на pH:- Карбонат кальция — может сочетаться с дополнительными ионами водорода или гидроксила, которые изменяют pH воды.
 Когда
эти минералы присутствуют, pH воды не меняется так сильно, когда кислоты
или основания добавляются в воду. Мы называем это забуференной водой. Многие почвы на западе
содержат эти минералы. Водоразделы с небольшим количеством этих буферных минералов будут производить
плохо забуференная вода. Любая дополнительная кислота изменит pH этих вод.
Когда
эти минералы присутствуют, pH воды не меняется так сильно, когда кислоты
или основания добавляются в воду. Мы называем это забуференной водой. Многие почвы на западе
содержат эти минералы. Водоразделы с небольшим количеством этих буферных минералов будут производить
плохо забуференная вода. Любая дополнительная кислота изменит pH этих вод. - Сосновые или еловые леса — разлагающаяся хвоя этих деревьев увеличивает кислотность почвы и также влияет на кислотность близлежащих ручьев.
- Вода со столба под водой r — просачивается через почвы, и если почвы забуферены, pH может быть несколько
высшее (7-8).

- Осадки — когда осадки выпадают в воздух, они растворяют газы, такие как диоксид углерода. и образует слабую кислоту. Естественный, незагрязненный дождь и снег слабокислые. Осадки обычно имеют pH от 5 до 6.
- Времена года — осенью, когда листья и иголки падают в воду и разлагаются, это может повысить кислотность воды.
- Фотосинтез и дыхание — во время фотосинтеза растения удаляют углекислый газ из воды.Это может поднять
pH в воде. Поскольку растения фотосинтезируют при солнечном свете, pH
уровень воды будет максимальным в середине дня и минимальным накануне
Восход.

- Кислотный дождь — серная кислота (производится путем сжигания угля
предприятиями) и азотная кислота (производится автомобильными двигателями) являются основными источниками до кислотного дождя.К счастью, в Юте буферные почвы помогают уменьшить воздействие кислотный дождь. - Точечный источник загрязнения — сброс промышленных загрязняющих веществ непосредственно в воду может повлиять на pH воды.
 Изменение pH воды может изменить поведение других химических веществ в воде.
Измененный химический состав воды может повлиять на водные растения и животных.Например, аммиак
безвреден для рыб в кислой воде. Однако по мере увеличения pH аммиак становится
токсичен. Кроме того, более низкий pH приведет к появлению тяжелых металлов, таких как кадмий, свинец и хром.
раствориться легче. Многие тяжелые металлы становятся токсичными при растворении в воде.
Изменение pH воды может изменить поведение других химических веществ в воде.
Измененный химический состав воды может повлиять на водные растения и животных.Например, аммиак
безвреден для рыб в кислой воде. Однако по мере увеличения pH аммиак становится
токсичен. Кроме того, более низкий pH приведет к появлению тяжелых металлов, таких как кадмий, свинец и хром.
раствориться легче. Многие тяжелые металлы становятся токсичными при растворении в воде. - Горнодобывающая промышленность — камни могут подвергаться воздействию дождевой воды и вызывать кислотные стоки.Горный дренаж может ввести кислоты в водный путь, если он плохо забуферен, pH может достичь токсичных уровней.
| Общие вещества | Биологические эффекты |
Зачем заботиться о pH?
Вода с очень высоким или низким pH смертельна. Вода с относительно низким pH (кислая)
может снизить успешность вылупления икры рыб, вызвать раздражение жабр рыб и водных макробеспозвоночных (водяные клопы) и повредить мембраны. Особенно уязвимы амфибии,
возможно потому, что их кожа очень чувствительна к загрязнителям. Некоторые ученые считают
недавнее снижение численности амфибий во всем мире связано с низким уровнем pH, вызванным
кислотным дождем.
Вода с относительно низким pH (кислая)
может снизить успешность вылупления икры рыб, вызвать раздражение жабр рыб и водных макробеспозвоночных (водяные клопы) и повредить мембраны. Особенно уязвимы амфибии,
возможно потому, что их кожа очень чувствительна к загрязнителям. Некоторые ученые считают
недавнее снижение численности амфибий во всем мире связано с низким уровнем pH, вызванным
кислотным дождем.
Для получения дополнительной информации см. Общие сведения о вашем водоразделе: pH.Также проверьте реальные данные о pH, собранные волонтерами Utah Water Watch.
Щелочная вода: лечебный напиток или вся реклама?
Все мы знаем, что питье большого количества воды каждый день может помочь вашему телу развиваться и предотвратить болезни. Фактически, надлежащее увлажнение необходимо почти для каждой функции организма. Однако теперь продукт, получивший название щелочной воды, вызывает волну, и сторонники утверждают, что он может сбалансировать pH вашего тела, повысить энергию и предотвратить болезни.
Однако теперь продукт, получивший название щелочной воды, вызывает волну, и сторонники утверждают, что он может сбалансировать pH вашего тела, повысить энергию и предотвратить болезни.
Их теория: Кислая среда способствует размножению бактерий, поэтому, если вы измените свой рацион на более щелочной (менее кислый), вы избавитесь от вредных насекомых. К сожалению, эта теория не выдерживает критики, поскольку кислоты часто используются для уничтожения бактерий.
Так действительно ли полезны эти функциональные воды для здоровья? Здесь зарегистрированный диетолог-диетолог Келли Нол отвечает на часто задаваемые вопросы о последней тенденции в области h3O в Америке.
Q: Что такое щелочная вода?
A: Щелочь относится к части шкалы pH.Эта шкала от 0 до 14, более низкие числа более кислые, а более высокие числа более щелочные, а 7 — нейтральные. Большинство щелочных вод имеют pH 8 или 9, тогда как чистая вода имеет нейтральный pH 7. Идея состоит в том, что питьевая щелочная вода нейтрализует повышенную кислотность в организме.
Идея состоит в том, что питьевая щелочная вода нейтрализует повышенную кислотность в организме.
Q: Изменяет ли щелочная вода естественный уровень pH в организме?
A: Не совсем. В большинстве случаев уровень pH в крови составляет 7; он попадает прямо в середину шкалы pH.То, что вы едите и пьете, меняет только pH вашей мочи. Поэтому, когда вы пьете щелочную воду, вы изменяете pH всего содержимого унитаза, а не крови. Кроме того, когда щелочная вода, которую вы пьете, попадает в желудок, кислоты в кишечнике нейтрализуют ее. По сути, вы платите много денег, чтобы выпить что-нибудь, что не повлияет на кислотность вашего тела.
В. Является ли обычная водопроводная вода щелочной?
A: Чистая вода имеет pH 7, поэтому, как и ваша кровь, она нейтральна.Уровень pH воды из-под крана обычно колеблется в пределах 6,5-8,5. Он также содержит важные минералы, такие как кальций, магний, калий, бикарбонат и кремнезем. Фактически, в зависимости от того, откуда берется водопроводная вода, она может обеспечить от 1 до 20 процентов вашей дневной потребности в кальции и магнии. Жесткая вода более щелочная и содержит больше минералов, чем мягкая.
Фактически, в зависимости от того, откуда берется водопроводная вода, она может обеспечить от 1 до 20 процентов вашей дневной потребности в кальции и магнии. Жесткая вода более щелочная и содержит больше минералов, чем мягкая.
В: Может ли щелочная вода помочь уменьшить симптомы кислотного рефлюкса?
A: Есть несколько исследований, которые предполагают, что употребление щелочной воды инактивирует пепсин, фермент, ответственный за кислотный рефлюкс.Но эти исследования проводились в чашке Петри, а не на людях, поэтому на самом деле нельзя сказать, как щелочная вода повлияет на пациентов с кислотным рефлюксом.
Q: Если питьевая щелочная вода не имеет значения, как мы можем изменить pH нашего тела?
A: Человеческое тело — прекрасная и сложная машина. Если у вас есть дисбаланс в уровне pH, ваше тело исправит его, независимо от того, что вы пьете. Например, если ваша кровь станет слишком кислой, вы будете выдыхать больше углекислого газа. Почки также могут выводить избыток кислоты с мочой.
Почки также могут выводить избыток кислоты с мочой.
Q: Может ли пить щелочная вода вызывать проблемы?
A: Бутылка щелочной воды через день не сильно повлияет на ваше тело. Однако, если вы ежедневно выпиваете галлон щелочной воды, вашему организму приходится много работать, чтобы поддерживать свой pH, а это означает, что со временем ваше тело будет производить больше желудочного сока и пищеварительных ферментов. У людей, страдающих заболеванием почек или принимающих лекарства, изменяющие их функцию почек, минералы в щелочной воде могут начать накапливаться в организме.
Если вас беспокоит, что ваша диета слишком кислая, соблюдайте противовоспалительную диету и наполните тарелку фруктами и овощами. Как правило, продукты животного происхождения, кофеин, соль и сахар являются кислотообразующими, тогда как фрукты, овощи и цельнозерновые продукты более щелочные.
Чтобы записаться на прием к зарегистрированному диетологу в Henry Ford, посетите henryford. com или позвоните по телефону 1-855-434-5483 .
com или позвоните по телефону 1-855-434-5483 .
Дополнительные советы по питанию и фитнесу можно найти в разделах EatWell и MoveWell, поэтому подпишитесь, чтобы получать все самые свежие советы.
Келли Нол — зарегистрированный диетолог Центра укрепления здоровья и профилактики заболеваний Генри Форда.
Теги: Питание, Келли Нол
Почему так важен pH воды?
Возможно, вы слышали о недавних диетических увлечениях или специальных напитках, утверждающих, что они «высокощелочные».«Что это означает и как это связано с уровнем pH? Пристегните ремень безопасности и приготовьтесь к ускоренному курсу изучения pH и кислотности воды.
Что такое pH?
Согласно Википедии, в химии pH — это числовая шкала, используемая для определения кислотности или основности водного раствора. Шкала от 0 до 14. Если она расположена ниже по шкале, она более кислая. Если он расположен выше по шкале, он более щелочной или щелочной. Обработанные продукты и продукты, такие как йогурт, рыба и сыр, обычно более кислые, в то время как овощи, такие как свекла, болгарский перец и капуста, имеют высокую щелочность.
Шкала от 0 до 14. Если она расположена ниже по шкале, она более кислая. Если он расположен выше по шкале, он более щелочной или щелочной. Обработанные продукты и продукты, такие как йогурт, рыба и сыр, обычно более кислые, в то время как овощи, такие как свекла, болгарский перец и капуста, имеют высокую щелочность.
Какое отношение имеет pH к воде?
Чистая вода считается нейтральной — находится прямо в середине шкалы — с pH 7. К сожалению, не вся вода чистая и редко бывает на этом фактическом уровне. Так почему же уровень pH воды меняется? Есть много факторов, которые могут влиять на кислотность и щелочность воды. Первым и наиболее заметным из них является состав коренной породы и почвы, в которых находится вода. В зависимости от типа породы кислотность воды может быть нейтрализована.С другой стороны, рост растений и органический материал, расположенный рядом с водой, могут фактически повысить кислотность из-за выброса углекислого газа при разложении. Другие факторы включают сброс химикатов, кислотные осадки и дренаж угольных шахт.
в питьевой воде строго контролируется и должен поддерживаться Агентством по охране окружающей среды (EPA) в диапазоне 6,5–8,5. Однако, если не принимать во внимание меры предосторожности, употребление кислой или щелочной воды может быть вредным.Когда уровень pH воды ниже 7, она вызывает коррозию. Это означает, что он может содержать железо, медь, свинец или цинк из труб и различных других металлических приспособлений. У него будет горький и металлический привкус. Сильная щелочная вода не представляет опасности для здоровья, но вызывает эстетические проблемы. Произойдет образование накипи или осадка на трубах, приспособлениях, посуде и посуде. Вкус будет похож на вкус пищевой соды и будет иметь ощущение скользкости.
Итак, что произойдет, если ваше тело не сбалансировано?
Слишком щелочная или слишком кислая среда может нанести вред вашему здоровью.Значение pH воды заключается в поддержании баланса вашего тела и регулировании метаболических процессов. Диета с высоким содержанием кислоты приведет к увеличению веса, замедлению иммунного ответа и восприимчивости к болезням, а слишком щелочная диета приведет к неспособности усваивать основные питательные вещества. Наш организм постоянно работает над достижением сбалансированного уровня pH. Пища, которую мы едим, жидкости, которые мы пьем, даже эмоции, которые мы испытываем, — все это влияет на наш уровень pH.
Диета с высоким содержанием кислоты приведет к увеличению веса, замедлению иммунного ответа и восприимчивости к болезням, а слишком щелочная диета приведет к неспособности усваивать основные питательные вещества. Наш организм постоянно работает над достижением сбалансированного уровня pH. Пища, которую мы едим, жидкости, которые мы пьем, даже эмоции, которые мы испытываем, — все это влияет на наш уровень pH.
Натуральная родниковая вода Эльдорадо имеет средний уровень pH 7.33, почти высший балл по шкале. Это один из ближайших вариантов получения чистой воды, и ваше тело наверняка поблагодарит вас за это. Ознакомьтесь с нашими продуктами, мы будем рады помочь вам восстановить баланс вашего тела.
.


 5 до 9,0
5 до 9,0 Когда
эти минералы присутствуют, pH воды не меняется так сильно, когда кислоты
или основания добавляются в воду. Мы называем это забуференной водой. Многие почвы на западе
содержат эти минералы. Водоразделы с небольшим количеством этих буферных минералов будут производить
плохо забуференная вода. Любая дополнительная кислота изменит pH этих вод.
Когда
эти минералы присутствуют, pH воды не меняется так сильно, когда кислоты
или основания добавляются в воду. Мы называем это забуференной водой. Многие почвы на западе
содержат эти минералы. Водоразделы с небольшим количеством этих буферных минералов будут производить
плохо забуференная вода. Любая дополнительная кислота изменит pH этих вод.

 Изменение pH воды может изменить поведение других химических веществ в воде.
Измененный химический состав воды может повлиять на водные растения и животных.Например, аммиак
безвреден для рыб в кислой воде. Однако по мере увеличения pH аммиак становится
токсичен. Кроме того, более низкий pH приведет к появлению тяжелых металлов, таких как кадмий, свинец и хром.
раствориться легче. Многие тяжелые металлы становятся токсичными при растворении в воде.
Изменение pH воды может изменить поведение других химических веществ в воде.
Измененный химический состав воды может повлиять на водные растения и животных.Например, аммиак
безвреден для рыб в кислой воде. Однако по мере увеличения pH аммиак становится
токсичен. Кроме того, более низкий pH приведет к появлению тяжелых металлов, таких как кадмий, свинец и хром.
раствориться легче. Многие тяжелые металлы становятся токсичными при растворении в воде.