Что такое жесткость воды: уровень и методы определения
Жесткость – параметр качества воды
Жесткость питьевой воды – одна из качественных характеристик воды, которое обуславливается наличием в воде солей двух щелочноземельных металлов — кальция и магния. Жесткость имеет значение для оценки качества любой используемой воды, технической, питьевой и воды, используемой для нужд промышленных предприятий с заданными характеристиками.
Наибольшее влияние на уровень жесткости воды оказывает количество катионов кальция, несколько в меньшей степени – магния. Катионы стронция, железа и марганца также оказывают влияние на жесткость воды, однако их вклад в общую жесткость воды так мало, что на практике обычно пренебрегают их значениями.
Общая жесткость определяется суммой временной и постоянной жесткостью воды.
Постоянная жесткость воды – кальциевые и магниевые соли соляной, серной, азотной кислот, т.е. сильных кислот. Такие соли жесткости в воде при кипячении не выпадают в осадок и не кристаллизуются в виде накипи.
Временная жесткость воды – показатель, наличия в воде карбонатов и гидрокарбонатов кальция и магния, которые при кипячении и показателях рН больше 8,3, практически полностью выпадают в хлопьевидный осадок, кристаллизуются в виде накипи или образуют пленку на поверхности воды.
Как соли кальция и магния попадают в природную воду, ведь вода, выпадающая в виде осадков, как и талая вода, не содержат солей?
Это происходит следующим образом: вода, напитывается солями, содержащимися в известняках, гипсах и доломитах залегающих в толщах земли.
Это основной источник этих солей. Кроме этого, выветривание горных пород, также может оказывать влияние на карбонатную жесткости воды.
Согласно методам определения жесткости воды по гидрохимии считается:
- 0-4 мг-экв./л – мягкая вода
- 4-8 мг-экв./л – средней жесткости
- 8-12 мг-экв./л – жесткая вода
- Больше 12 мг-экв./л – очень жесткая
Это касается оценки общей минерализации воды, но для питьевой воды российский СанПиН определяет предельно допустимые концентрации 0-7 мг-экв/л.
Специалисты в области фильтрации условно делят жесткость питьевой воды так:
- 0-1,5 мг-экв/л – мягкая вода
- 1,5-2 мг-экв/л – оптимальная питьевая вода
- 2-5 мг-экв/л – жесткая вода
- 5-7 мг-экв/л – сверхжесткая вода
- Больше 7 мг-экв./л – не питьевая вода, за пределами рекомендованных значений.
Можно разделить природную воду на поверхностную и подземную.
Поверхностная вода обычно имеет меньшую жесткость, поскольку она разбавляется в значительной степени осадками и талыми водами. Этим объясняется и факт сезонных изменений показателей общей жесткости для поверхностных вод.
Состав подземных вод более постоянен, и обычно имеет большие значения, чем у поверхностной воды, по общей жесткости.
Питьевая вода должна иметь оптимальный состав по количеству солей жесткости.
Слишком много солей – риск возникновения мочекаменной болезни, заболеваний костей, суставов. Слишком мало солей – соли вымываются из организма, кости приобретают большую ломкость, возрастает риск заболеваний суставов, сосудов.
По мнению некоторых исследователей, в регионах с пониженным уровнем жесткости воды, также возрастает риск сердечнососудистых заболеваний. Это подтверждается статистикой по странам Европы и Северной Америке, исследованиям в российских регионах с разными средними показателями по жесткости воды.
Также жесткая вода образует накипь, что приводит к уменьшению сроков службы бытовой технике, преждевременному износу водонагревательного оборудования, портит сантехническое оборудование.
Вода, уровень жесткости которой меньше двух мг-экв/л способна сильнее, чем более жесткая вода оказывать на водопроводные трубы коррозийное воздействие, поскольку имеет более низкую щелочность.
Поэтому, в ряде случаев, особенно в теплоэнергетике, иногда приходится проводить дозирование карбонатной жесткости воды с целью достижения оптимального соотношения между коррозионной активностью воды, ее водородному показателю и содержанию кальция и магния.
В настоящее время ряд специалистов, ссылающиеся на данные ВОЗ, утверждают, что имеющаяся статистика не позволяет однозначно считать мягкую и жесткую воду опасной для здоровья человека. И все же имеющиеся данные подтверждают зависимость водно-солевого баланса в организме человека от этих факторов, а отсутствие нормативной доказательной базы на уровне Всемирной Организации Здравоохранения, не причина закрывать глаза на качество питьевой воды по количественным показателям солей жесткости — солей кальция и магния.
Закажите консультацию специалиста компании Гейзер
Остались вопросы? Мы всегда готовы предоставить консультацию по всем вопросам очистки воды!
TDS метр-измеряем жесткость воды из различных источников, в том числе природных.
Здравствуйте, сегодня речь пойдет о жесткости воды измеряемой с помощью TDS метра или солемера. Данный прибор уже неоднократно обозревался на сайте, но так как я проживаю в предгорьях Кавказа, была мысль пойти с этим прибором в поход и померить жесткость воды в горной реке, горном ручье, лесном роднике. Поэтому я иду в реальный поход а вас приглашаю в виртуальный. Ну и померяю дождевую, магазинную минеральную, бутелированную не минеральную и водопроводную воду. Интересно? Тогда читаем далее.Жёсткость воды — совокупность химических и физических свойств воды, связанных с содержанием в ней растворённых солей щёлочноземельных металлов, главным образом, кальция и магния (так называемых «солей жёсткости»).(wikipedia)
Вот поэтому этот прибор так же называют солемером. TDS расшифровывается и переводится как Total Dissolved Solids — общее содержание растворенных твердых веществ.
Жесткость воды это как раз то что отвечает за накипь в чайнике и камни в почках.
Пробежимся немного по самому прибору.
В низу под колпачком два электрода которые и опускаются в воду

На тыльной стороне находится клипса и калибровочный винт

В колпачке с верху встроен батарейный отсек на две батарейки типа LR44
Замер делается так: Включаем прибор, он показывает 000, опускаем электроды в воду и смотрим значение.
Индикация трехсегментная, если значение больше 999 то внизу появляется знак х10.
Прибор измеряет в американских единицах измерения ppm, у нас в России принята единица миллиграмм-эквивалент на литр, мг-экв/л.
1 мг-экв/л=50,05 ppm
Согласно Санитарным нормам и правилам за номером СанПиН 2.1.4.1074-01
максимально допустимая концентрация равна 7 мг-экв/л. или 350ppm
на это значение и будем опираться, так же приведу еще вот такую таблицу ей тоже можно верить
Данный прибор калибруется, специальной калибровочной жидкостью в которой значение содержания солей известно заранее, этот прибор уже откалиброван продавцом.
Температура воды при измерениях особой роли не играет так как в характеристиках прибора заявлено такое свойство:
Auto temperature compensation
Для начала проведем комнатно стаканные замеры
Питьевая водопроводная вода из крана
она же кипяченная, как видно немного меньше содержание солей, кипячение смягчает воду. 
дождевая вода, просто вышел на балкон и набрал сбегающую с крыши воду во время дождя.
Бутелированная вода из кулера, заявлено что талая, ледниковая, производителя специально не показываю.
газированная минеральная вода из магазина, почему такие показания не знаю эта вода добывается из скважины, она обогащена всякими элементами может быть по этому.
Ну а теперь в поход, первая у нас горная река Малая Лаба
вот так выглядит


вот такие показания
в процессе замеров пару раз закинул удочку, в надежде поймать форель, неповезло.
Зато попалась вот такая плотвичка.

Следующий это родник в лесу. У нас считается что в этом роднике очень чистая вода, много местных набирают эту воду для питья, и готовят только из нее. Даже ходит байка что кто то отвозил воду из него в какой то научно исследовательский институт, там сделали анализ и сказали что вода уникальная, может мертвого поднять, лично я не верю.
Меня отвлекли, поэтому сфотографировать забыл, показания были 60 ppm, в низу в видео этот родник есть.
Что характерно почти такие же как в реке в которой раннее замерил, река от родника протекает примерно в полукилометре, у меня есть подозрения что это одна и та же вода, только за счет фильтрации через почву, в роднике она выглядит кристально чистой.
Следующее на очереди место, это небольшой горный ручей с маленьким 2-х метровым водопадом.
Вот такие виды по пути к водопаду
А вот и сам водопад
Измерения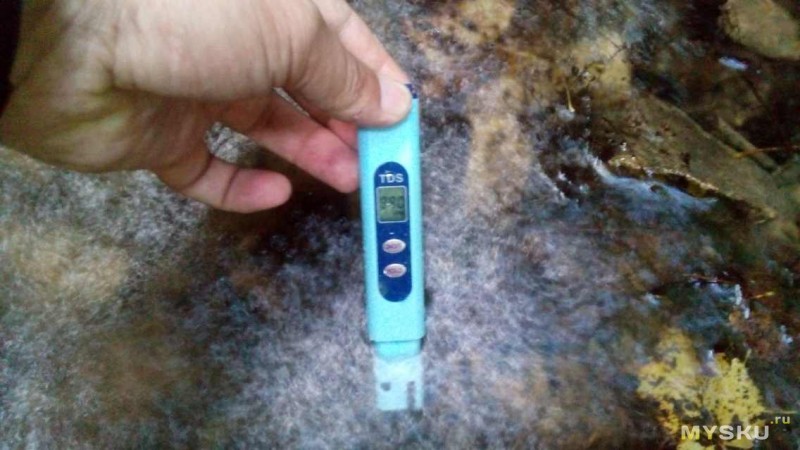
внизу брызги, вода разлетается во все стороны, поэтому замеры было делать не удобно и тем не менее померил и результат сильно удивил, на фото не получилось нормально снять но в итоге результат был за 1000 ppm, внизу с лева мигала надпись x10. Почему такие высокие показания в этом ручье я не знаю, выше он вытекает из пещеры возможно по этому.
В заключение скажу, что прибор в основном в быту необходим владельцам фильтрующих систем, что бы определять когда необходимо менять фильтрующий элемент.
Видео похода по водоемам на моем youtube канале, кому интересно обязательно подписывайтесь.
Так же видео распаковки.
До свидания.
единица измерения и способы понижения жесткости- Обзор +Видео
 В чем измеряется жесткость воды. Вода, поступающая к нам из крана, содержит множество примесей различных химических веществ. Их количество отвечает за уровень жесткости жидкости. Для определения качества воды, надо знать в чем измеряется данное свойство. За единицу измерения принято считать градус жесткости, который указывает насколько сильно жесткость превышает среднюю норму.
В чем измеряется жесткость воды. Вода, поступающая к нам из крана, содержит множество примесей различных химических веществ. Их количество отвечает за уровень жесткости жидкости. Для определения качества воды, надо знать в чем измеряется данное свойство. За единицу измерения принято считать градус жесткости, который указывает насколько сильно жесткость превышает среднюю норму.
Методы измерения должны знать не только инженеры, но и простые люди, чтобы при повышенном уровне, уметь смягчить жидкость.
Содержание статьи:
Отличия между жесткостью и мягкостью воды
Объем солевых примесей определяет количество находящихся в воде растворяемых веществ таких, как магний и кальций. Превысить норму примесей помогает попавший в гидрат железа, он в избытке содержится в водах, протекающий под землей.
Внимание! Воду считают жесткой, если в ней много примесей.
Количество соли влияет на свойство воды:
1.мягкая вода.
2.средняя вода
3. жесткая вода.
Дождевую воду либо перегоняемую жидкость считают мягкой, в ней очень мало минеральных примесей. Также показатель мягкости можно повысить, прокипятив воду, либо добавив в нее специальные химические добавки.
 Вода, имеющая среднюю жесткость, протекает в водопроводе, в родниках и скважинах.
Вода, имеющая среднюю жесткость, протекает в водопроводе, в родниках и скважинах.
Вода, отличается повышенной жесткостью в океанах и морях. Также жидкость, берущая начало в глубинных пластах породы, обогащенных минеральными веществами. В составе воды выделяют много разных солей, они могут достигать тридцати трех процентов общего количества жидкости.
Типы жесткости воды. Уровень жесткости в воде бывает:
1.постоянным, то есть показатель остается неизменным и зависит от количества в воде хлоридов и сульфатов.
2.временным, то есть на жесткость влияют присутствующие в воде бикарбонаты кальция с магнием. Показатель жесткости можно полностью понизить, если жидкость вскипятить.
3.общим, когда складывают постоянный и временный показатель.
Для определения уровня жесткости применяют специальные единицы измерения.
Единицы, измеряющие жесткость.
Перед тем, как посчитать жесткость воды, определяют в каком количестве в воде содержатся катионы магния и кальция.
Количество элементов измеряют такими единицами:
1.Моль на метр кубический (моль/м3). Единица измерения была принята и применялась в России до 2014 года.
2.Градусом жесткости (Ж). Новая единица измерения, которой пользуются в России после 2014 года.
3.Немецким градусом (dH). Данная единица применяется в европейских странах.
4.Французским градусом (FO). Единица принята для определения показателя в Европе.
5.Американским градусом (ppm CaCO3). Данной единицей пользуются в США.
Справка! Жесткость воды в России, выраженную молями, стали применять с 1952-го года. До этого общая жесткость определялась градусами, которые были равны единице измерения в Германии.
На территории России принята единица измерения в градусах, которая соответствует международным стандартам подсчета. Градус равняется 0.5 миллимоля на один литр воды. Сделать подсчет количества примесей в жидкости может каждый самостоятельно.
Почему появляется жесткость
Жидкость с поверхности земли испаряется и мелкими частичками попадает в атмосферу. В процессе конденсации жидкость вновь попадает на верхние слои почвы в виде различных осадков. На поверхности земли вода не подвергается влиянию примесей, она мягкая. Когда жидкость просачивается сквозь земную кору, она присоединяет растворимые вещества, в составе которых присутствует магний с кальцием. Поэтому жесткость воды повышается. По этой причине скважинная вода и подземная более жесткая. Воды на поверхности земли отличаются повышенной жесткостью зимой, но талые воды весной понижают ее уровень.
Внимание! Морская вода имеет постоянно высокий уровень жесткости, потому что содержит в больших количествах хлорид натрия.
Чтобы понизить содержание кальция с магнием в воде, применяют разные способы.
Как снизить показатель жесткости.
В борьбе с высокой концентрацией примесей в воде считаются эффективными такие методы, как:
1.химический способ позволяет снизить объем растворенных солей посредством погашенной извести. Если добавить соду в известь, то можно устранить постоянную жесткость.
2.кипячение способно избавить от временной жесткости. Во время кипячения отмечается образование осадка на дне емкости.
3.метод заморозки воды устранит постоянную жесткость. Мягкость будет достигнута при появлении 90 процентов льда, и остатка воды 10 процентов. Воду нужно слить, а лед растопить и использовать по необходимости.
4.метод перегонки представляет собой превращение прогретой воды в пар, который далее конденсируют.
5.метод электромагнитный. В данном случае применяют магнитное поле, метод хорошо подходит для использования в больших котельных.
6.метод катионного обмена считается самым эффективным. Воду пропускают сквозь катионный слой.
Каждый метод хорошо справляется с задачей по уменьшению уровня жесткости воды.
Внимание! Для уменьшения жесткости питьевой воды не применяют химический метод.
Жесткость и качество воды
Жесткая вода изменяет вкус воды. Порог, при котором соли отрицательно влияют на вкус, для кальция равен 2 – 6 мг – экв/л, для магния гораздо ниже. Если содержание ионов этих веществ в воде находится в пределах 1.6 – 3 мг – экв/л, то вода на вкус приятная.
 Человек может употреблять воду, в которой показатель жесткости достигает 10 мг – экв/л, но недолгое время, потому что употребление ионов кальция с магнием отрицательно сказывается на здоровье.
Человек может употреблять воду, в которой показатель жесткости достигает 10 мг – экв/л, но недолгое время, потому что употребление ионов кальция с магнием отрицательно сказывается на здоровье.
Внимание! Жесткую воду нежелательно использовать в нагревательном оборудовании.
Устройства, типа бойлера, электрочайника, стиральной либо посудомоечной машины, имеют встроенный для нагрева тэн, на котором появляется известковый налет, В результате перегрева тэна, приборы выходят из строя.
Чтобы избавится от накипи, надо использовать сухую лимонную кислоту, растворенную в воде. Данным раствором залить устройство и прокипятить. Далее нужно промыть оборудование и можно снова пользоваться.
Жесткая вода омрачает стирку, моющие средства в такой воде обильно вспениваются. Пена откладывает налеты на элементах в моющей и стиральной машинки, что также отрицательно сказывается на работе некоторых элементов устройства.
Жесткость и здоровье человека. Если долгое время пить жесткую воду, избыточное содержание соли приводят к отклонению функционирования внутренних органов:
1.системы ЖКТ. В желудке соли плохой воды соединяются с жирами животного происхождения, что нарушает выработке ферментов, поэтому нарушается перистальтика органа. У человека наблюдается зашлакованность организма, развитие дисбактериоза.
2.суставов. Некоторые соли в организме человека производят вещества неорганического происхождения, способствующие заменять собой суставную жидкость. В последствие это вызывает боли при движении, развивается артирит либо полиартрит.
3.работы сердца. Жесткая вода ухудшает работу сердечной мышцы, провоцируя аритмию.
4.кожи. Некачественная вода влечет старение кожи при наружном контакте и во время приема внутрь. Жесткая вода, взаимодействуя с моющим средством, образует пленку, которая остается на руках и приносит вред верхнему слою кожи.
5.почек. Из-за жесткой воды не образуются камни в почках. Они появляются, потому что в организме недостаточное количество кальция. Организм восполняет нехватку вымыванием из костей и дальнейшим оседанием внутри мочеполовой системы.
Внимание! Чтобы исключить вредное воздействие жесткой воды на организм, устанавливают многоступенчатые фильтры воды.
Методы, которые позволяют измерить жесткость воды. Для того, чтобы приборы работали долго, а организм не страдал от показателя жесткости. Уровень содержания примесей в воде надо уметь определять. Определить превышение жесткости на вкус возможно, если показатель сильно превышает норму.
Для измерения используют следующие способы:
1.Если при растворении мыла в воде, оно не пенится, значит, показатель жесткости высокий, пить такую воду нельзя.
2.Если на тэне электрического чайника за короткое время появляется накипь, значит, вода очень жесткая.
3.Наиболее точным методом считается применение специальных полосок. Метод эффективный, но требует вложения денег. Полоску опускают в проверяемую жидкость на пару секунд, и она через минуту изменит цвет. Далее цвет соотносят с данными таблицы, которая имеется в инструкции.
Выводы
Не всегда требуется точное знание жесткости воды в доме, но примерный уровень этого свойства воды стоит определять обязательно. Это продлит срок годности приборам, также примененные меры для смягчения показателя, продлят жизнь человека.
Высокотехничные предприятия и химическая промышленность требует знаний жесткости воды до миллиграмма, поэтому должны пользоваться профессиональными методами для вычисления. В случае необходимости вовремя принять меры.
Норма жесткости питьевой воды — как определить и формула расчета
Повышение внимания к норме жёсткости питьевой воды связано с повсеместным распространением стиральных и посудомоечных машин, поскольку определение расчётной загрузки моющих средств и частота очистки машин зависит от фактической степени жёсткости. Однако единицы измерения этого показателя в разных странах отличаются, а, кроме того, отличаются и составляющие для каждой из специфических единиц измерения.
Что такое жёсткая вода и что на неё влияет?
Степень жёсткости воды определяется как совокупность свойств, зависящих от содержания магния, кальция и других растворённых солей. Общий показатель складывается из постоянной и временной составляющей:
- Временная (карбонатная) устраняется кипячением благодаря способности ряда солей выпадать в осадок с образованием накипи. Характеризуется наличием бикарбонатов магния и кальция – при рН>8.3.
- Постоянная (некарбонатная) сохраняется при кипячении. Характеризуется наличием солей магния и кальция хлоридных, сульфатных и нитратных анионов.
На величину жёсткости влияют следующие факторы:
- интенсивность растворения гидропотоками горных пород (известняков, доломитов),
- использование подземных или поверхностных вод (поверхностные при прочих равных более «мягкие»),
- сезонные колебания для поверхностных ресурсов (показатель максимальной «мягкости» отмечается в периоды паводков и половодий с активным поступлением дождевых и талых «пополнений» в источники водоснабжения, а минимальная «мягкость» приходится на зимний период).
Единицы измерения, формулы и расчёты
В России единица измерения содержания солей по данному параметру называется «градус жёсткости» (°Ж), который с помощью распространённых онлайн-калькуляторов пересчитывается в единицы измерения, принятые в других странах (см. таблицу).
| Страна | Единицы измерения | Россия | Германия | Великобритания | Франция | США |
| Россия | 0Ж | 1 | 2.8 | 3.51 | 5 | 50.4 |
| Германия | 0DH | 0.357 | 1 | 1.25 | 1.78 | 17.84 |
| Великобритания | 0Clark | 0.285 | 0.8 | 1 | 1.43 | 14.3 |
| Франция | 0F | 0.20 | 0.56 | 0.70 | 1 | 10 |
| США | ppm | 0.02 | 0.056 | 0.070 | 0.10 | 1 |
Так 1°Ж = 2,8°DH = 3,51°Clark = 5°F = 50,04ppm.
Каждая величина соответствует следующим показателям для воды:
- 1°Ж = 20,04 мг Ca2+ или 12,15 Mg2+ в 1 дм3
- 1°DH = 10 мг CaO в 1 дм3
- 1°Clark = 10 мг CaCO3 в 0,7 дм3
- 1°F = 10 мг CaCO3 в 1 дм3
- 1 ppm = 1 мг CaCO3 в 1 дм3
1°Ж = 1 мг-экв/л (чаще используют в практике) = 1/2 моль/м3 = 20,04 миллиграмма ионов Ca2+ (или 12,16 миллиграмма ионов Mg2+)
Формула расчёта жёсткости воды при карбонатном типе:
- Ca2+ + 2HCO3— (при нагревании)= CaCO3↓ + H2O + CO2↑
- Mg2+ + 2HCO3— (при нагревании)= MgCO3↓ + H2O + CO2↑
Общая °Ж определяется как сумма временной и постоянной: Hобщ = Нкарб + Ннекарб
Нормативные требования
- Российские нормативы – СанПиН-ы 2.1.4.1074-01; ГН 2.1.5.1315-03 – определяют норму жёсткости питьевой воды в пределах 7°Ж с установлением нормативного значения для магния – в пределах 50 мг/л и не регламентируя его для кальция.
- Для бутилированного продукта, по СанПиН-ам 2.1.4.1116-02: °Ж находится в интервале 1,5-7 с показателями 25-130 мг/л/кальций, 5-65 мг/л/магний.
- Рекомендации ВОЗ для питьевой воды °Ж не регламентируют, определяя при этом норму 20-80 мг/л/кальций, 10-30 мг/л/магний, что ниже российских нормативных значений, однако фактические значения при водообеспечении, например, для Москвы, укладываются в рекомендации ВОЗ.
По данным московского водоканала, для Москвы (по сравнению с остальными крупными городами мира), характерны следующие показатели (см. таблицу):
| Жесткость, Ж | Кальций, мг/л | Магний, мг/л | |
| Москва | 2,0 — 5,5 | 46 | 11 |
| Париж | 5,0 — 6,0 | 90 | 6 |
| Берлин | 5,0 — 8,8 | 121 | 12 |
| Нью-Йорк | 0,3 — 0,4 | 6 | 1 |
| Сидней | 0,2 — 1,3 | 15 | 4 |
Если определять степень мягкости по 3 категориям, то деление соответствует следующим величинам:
- до 2°Ж – мягкая,
- в интервале 2-10°Ж – средне-жёсткая,
- свыше 10°Ж – жёсткая.
В некоторых случаях эта шкала детализируется, нередко со смещением, однако для конкретных ситуаций лучше применять не описательные, а точные значения градусов. Так жёсткость воды в аквариуме в норме составляет 3-15°Ж с разделением предпочитаемых интервалов для каждого вида рыб, моллюсков, водорослей. Например, раковина улиток остаётся в лучшем состоянии в жёсткой воде, а для живородящих рыб предпочтителен диапазон в 6-10°Ж. При этом следует учитывать, что содержание кальция в водной среде будет постепенно снижаться за счёт усвоения его обитателями аквариума.
В домашних условиях, помимо кипячения, применяют следующие способы смягчения:
- Реагентный – основан на добавлении кальцинированной соды или гашеной извести с выпадением в осадок нерастворимых соединений солей магния и кальция. Одним из самых эффективных реагентов считается ортофосфат натрия, способный снизить градус до 0,05°Ж.
- Мембранный – благодаря нанофильтрации и обратному осмосу полупронецаемой мембраны задерживаются ионы.
- Магнитный – благодаря магнитогидродинамическому резонансу карбонат кальция не кристаллизуется, а модифицируется в арагонит, который не откладывается на теплообменных поверхностях.
При этом различного типа аэраторные насадки на кран и экономители с поворотным механизмом (http://water-save.com/) благодаря постоянному механическому сдвигу шарниров в незначительной мере могут повлиять на образование накипи, однако ни остановить её образование, ни снизить значение °Ж не способны.
Читайте далее
Оставьте комментарий и вступите в дискуссию
Как определить жесткость воды в домашних условиях
Слишком жесткая вода может негативно влиять на состояние здоровья человека или животных, испортить кухонную технику, быстро загрязнять систему фильтрации. Поэтому перед человеком встает задача по определению уровня жесткости воды, которую нужно быстро решать в условиях быта. Для этого требуется знать, что же представляет собой жесткая вода, в каких единицах она измеряется, какие способы можно использовать, чтобы быстро определить степень жесткость воды.

Жесткость воды: что это такое?
Жесткой вода становится при повышенном содержании в ней минеральных солей. Чаще всего это соли кальция и магния, которые и принято называть солями жесткости. Говоря о таком параметре воды, различают жесткость:
- карбонатную или временную;
- некарбонатную или постоянную;
- общую.
Временная жесткость связана с гидрокарбонатами, которые прекрасно растворяются в воде. Когда вода подвергается кипячению, гидрокарбонаты разлагаются вновь на углекислый газ и карбонаты, а они в свою очередь проявляются накипью на стенках емкости.
Жесткость постоянная обусловлена наличием в жидкости хлоридов кальция и магния, сульфатов, фосфатов. Эти соли растворимы в воде, а потому не устраняются кипячением. Чтобы очистить жидкость от них, нужно использовать фильтры с обратным осмосом, ионообменной очисткой или электродиализом. Сумма значений временной и постоянной жесткостей дает общий показатель.
Когда требуется узнать жесткость воды?
Из-за жесткой воды возникает много негативных моментов:
- образуется много накипи в чайнике и кастрюлях;
- начинают плохо работать стиральная и посудомоечная машины, пароувлажнители, утюги с подачей пара;
- увеличивается расход стирального порошка;
- образуется известковый налет на мойках, ваннах, раковинах;
- забивается кран водопроводной трубы и лейка душа;
- снижается эффективность работы отопительных и водогрейных котлов;
- появляется неприятный осадок в приготовленном чае или кофе;
- плохо себя чувствуют некоторые аквариумные рыбки и растения.

Для человека слишком жесткая вода приносит вред в виде ломкости волос, «стягивания» кожи после водных процедур, развития мочекаменной болезни. Важно знать уровень жесткости воды, чтобы правильно программировать кофемашину на чистку, рассчитывать дозировку веществ от накипи для посудомоечной и стиральной машин, уберечь аквариумных рыбок от вымирания. Не менее важно определять степень жесткости воды, чтобы подобрать соответствующую систему фильтрации, которая не только очистит жидкость, но и убережет посуду от накипи.
В чем измеряется жесткость воды?
Показатель жесткости измеряется присутствием в воде ионов кальция и магния в определенном количестве. Согласно международной системе единиц, для измерения жесткости предусмотрены моли на метр кубический. На практике же в нашей стране используются такие единицы измерения: градус жесткости (ºЖ) и миллиграмм-эквиваленты на литр (мг-экв/л). 1мг-экв/л означает, что в 1 литре воды содержится 20,04мг кальция и 12,16мг магния. 1ºЖ = 1мг-экв/л.
По количеству содержания солей вода делится на:
- очень мягкую – до 1,5 мг-экв/л;
- мягкую – 1,5-4 мг-экв/л;
- средней жесткости – 4-8 мг-экв/л;
- жесткую – 8-12 мг-экв/л;
- очень жесткую – более 12 мг-экв/л.
Оптимально уровень жесткости для различного использования воды должен составлять 1-2 мг-экв/л. Водопроводная вода может иметь уровень жесткости в пределах 1,5-5 мг-экв/л, что обычно не требует применения специальных мер по корректировке этого показателя. Более жесткая вода обычно бывает в индивидуальных скважинах. Такая вода требует тщательной очистки и умягчения. По санитарным нормам жесткость питьевой воды из централизованного источника водоснабжения должна быть не более 7 мг-экв/л.
Как быстро и качественно определить уровень жесткости воды?

Чтобы точно узнать, насколько качественная вода течет из вашего крана, лучше отдать образец на анализ в специализированную лабораторию. В АНО «Испытательный центр «НОРТЕСТ» можно заказать анализ воды из любого источника. Наши специалисты проведут проверку воды на качественную и количественную составляющую, определят концентрацию солей жесткости, уровень железа, нитратов и прочих вредных веществ, которые могут содержаться в питьевой воде. Особенно стоит заказать анализ воды для проверки на жесткость тогда, когда необходимо подобрать систему фильтрации для загородного коттеджа.
Как примерно оценить уровень жесткости воды?
Чтобы получить некоторое представление о жесткости воды, можно обратиться к статистическим данным, которые отражают среднюю жесткость по определенному населенному пункту. Такой вариант можно использовать применительно как к городскому водопроводу, так и к индивидуальным скважинам, у которых нужно обязательно еще учитывать глубину.
Ообычно, водопроводная вода в городе имеет жесткость до 7 мг-экв/л, так как если этот показатель будет выше, то накипь быстро забивает трубы горячей воды. Такой вариант определения уровня жесткости весьма простой, но неточный, так как в городах может быть несколько источников воды, а скважинная вода может отличаться от дома к дому в широких пределах.
Подробная информация об услуге в разделеАнализ водыКакие способы определения степени жесткости применяются в быту?
Если нет возможности отправить образец воды на анализ, можно самостоятельно попытаться определить, жесткая ли вода поступает из водопроводного крана. Для этого подойдут следующие способы:
- Обратить внимание на накипь в чайнике. Если после кипячения воды на стенках чайника образуется накипь, а со временем ее становится все больше, то это говорит о том, что количество солей кальция и магния явно превышено, следовательно, вода жесткая.
- Провести такой опыт: на стекло нанести несколько капель дождевой, кипяченой и некипяченой водопроводной воды. Когда капли высохнут, можно сделать вывод о жесткости. Дождевая вода очень мягкая, так как практически не содержит соли кальция и магния. Осадок после испарения некипяченой воды даст представление об общей жесткости, а осадок, полученный после испарения кипяченой воды, позволит сделать вывод о временной жесткости. Если после испарения воды на стекле не остается никаких пятен, то вода чистая и ближе к мягкой.
- Использовать для оценки уровня жесткости мыло. Известно, что в жесткой воде мыло плохо пенится. Если намыливать руки, смочив их в воде, не получается достичь пены, то вода очень жесткая. Если пена появляется легко, то вода считается не очень жесткой. Когда образовалась хорошая пена, но она не смывается водой, то считается, что вода мягкая. Для определения уровня жесткости при помощи мыла можно приобрести специальную тестовую воду, на упаковке которой будет указана степень жесткости. К примеру, можно купить мягкую и сильно жесткую воду, взяв для испытания еще и воду из-под крана. В эти жидкости надо будет поместить небольшое количество мыла и вспенить. Затем посмотреть на образовавшуюся пену и замерить ее высоту в сантиметрах. Например, высота пены в мягкой воде при жесткости 1 мг-экв/л составит 10см, в жесткой воде при жесткости 15 мг-экв/л – 1см, а в вашем образце – 5см, то жесткость после вычислений составит примерно 8 мг-экв/л. Но это лишь примерное вычисление, которое даст общее представление об уровне жесткости воды, которая течет из водопровода.
- Провести еще один опыт с использованием мыла и теплой воды. Для него понадобится дистиллированная вода, хозяйственное мыло, весы, линейка, цилиндрический стакан, прозрачная литровая банка. Для выполнения опыта нужно отмерить 1г мыла и измельчить его, после чего сложить в стакан. Нагреть дистиллированную воду, но не кипятить, после чего ее нужно аккуратно перелить в стакан с мыльными стружками. Мыло будет растворяться. Затем в стакан требуется долить еще дистиллированной воды. Если используется мыло 60%, то доливать нужно до общей высоты жидкости в 6см, а если 72% – то до 7см. В каждом сантиметровом слое раствора получается количество мыла, которое достаточно для связывания в одном литре воды всех солей жесткости, если их концентрация составляет 1°dH (перевести градус в мг-экв/л можно по специальной таблице). После этих действий в банку нужно налить 0,5л воды из-под крана. Далее переливать раствор с мылом из стакана в банку, помешивая, пока в банке не станет видно белую пену. Ее появление укажет на то, что мыло связало соли кальция и магния. После этого нужно замерить высоту мыльного раствора, оставшегося в стакане, и вычесть из высоты, которая была исходной. Каждый сантиметр отправленного в банку раствора связал в 0,5л водопроводной воды соли жесткости, количество которых соответствует 2°dH. Если в банку было вылито 2см мыла, и в воде возникла пена, то жесткость обследуемой воды равна 4°dH. Приблизительно это составит 1,5 мг-экв/л.
- Определять уровень жесткости воды по вкусовым свойствам. Присутствующие в воде соли жесткости меняют ее вкус. Мягкая и жесткая вода сильно отличаются на вкус. Поэтому можно всей семьей провести дома опыт, изучая вкусовые характеристики воды разной степени жесткости. Для этого нужно приобрести в магазине мягкую и жесткую воду. Затем налить для дегустации в стакан приобретенную воду и взятую из-под крана. Такой вариант поможет примерно определить, к какому именно варианту ближе домашняя вода – к жесткой или мягкой воде, которая была куплена в магазине.
- Определить степень жесткости при помощи реагентов, приобрести которые можно в магазинах, предлагающих товары для аквариумов. В зависимости от производителя тесты при помощи реагентов несколько отличаются, но в общем надо действовать по одной схеме. Необходимо сначала налить в емкость воду в нужном количестве, добавить определенное количество раствора 1 и раствора 2, добавлять капли раствора 3 до тех пор, пока не изменится окраска с красноватого на фиолетовый. Далее потребуется подсчитать количество капель и по формуле узнать жесткость воды. В качестве реагентов могут выступать тест-полоски для определения жесткости. Чтобы узнать уровень жесткости надо нанести на бумагу реагент, который сменит воду при контакте с водой. Полоску нужно опустить в воду и следить за интенсивностью ее окрашивания, что будет связано с концентрацией веществ в жидкости. Такой способ имеет низкую точность, так как сложно интерпретировать результаты, определяя «на глаз» интенсивность окрашивания воды.
Зачастую для того, чтобы узнать уровень жесткости, применяется TDS-метр – прибор, измеряющий электропроводность воды. Но на данный показатель оказывает влияние не только наличие солей кальция и магния, но и другие параметры, что может вызвать некоторые затруднения в измерении уровня жесткости воды. Поэтому использовать этот прибор лучше профессионалам, которые смогут дать верный ответ относительно степени жесткости водопроводной воды в вашем доме.
Подробнее про жёсткость воды — Всё самое интересное!
Продолжаем раздел «Вода» и подраздел «Теоретические основы» статьёй Подробнее про жёсткость воды. Подробнее — потому что тема жёсткости воды уже всплывала на нашем интересном и полезном сайте в статье Жёсткая вода. Жёсткость воды вспоминается в первую очередь с накипью и умягчителем воды — прибором, который должен справляться с жёсткой водой и препятствовать образованию накипи.
Подробнее про жёсткость воды мы поговорим про жёсткость воды с точки зрения химии, разновидности жёсткости воды, единицы измерения жёсткости воды (в том числе в разных странах). Рассмотрим, откуда берётся жёсткость воды и как влияет жёсткость на качество воды.
Для начала немного про термины. В статье часто упоминаются слова «катионы» и «анионы». Катионы и анионы — это положительно и отрицательно заряженные ионы. Ион (др.-греч. ἰόν — идущее) — электрически заряженная частица, образующаяся в результате потери или присоединения одного или нескольких электронов. Соответственно, если потеря — то заряд частицы положительный. Если присоединение — то заряд частицы отрицательный (поскольку электрон имеет однозначно отрицательный заряд).

Жёсткость воды с точки зрения химии
Понятие жесткости воды принято связывать с катионами кальция (Са2+) и в меньшей степени магния (Mg2+). В действительности, все двухвалентные катионы в той или иной степени влияют на жесткость. Они взаимодействуют с анионами, образуя соединения (соли жесткости) способные выпадать в осадок. Одновалентные катионы (например, натрий Na+) таким свойством не обладают.
В данной таблице приведены основные катионы металлов, вызывающие жесткость, и главные анионы, с которыми они обЪединяются.
| Катионы | Анионы |
| Кальций (Ca2+) | Гидрокарбонат (HCO3—) |
| Магний (Mg2+) | Сульфат (SO42-) |
| Стронций (Sr2+) | Хлорид (Cl—) |
| Железо (Fe2+) | Нитрат (NO3—) |
| Марганец (Mn2+) | Силикат (SiO32-) |
На практике стронций, железо и марганец оказывают на жесткость столь небольшое влияние, что ими, как правило, пренебрегают. Алюминий (Al3+) и трехвалентное железо (Fe3+) также влияют на жесткость, но при уровнях рН, встречающихся в природных водах, их растворимость и, соответственно, «вклад» в жесткость ничтожно малы. Аналогично, не учитывается и незначительное влияние бария (Ва2+).
Разновидности жесткости воды.
Различают следующие разновидности жёсткости воды:
Общая жесткость. Определяется суммарной концентрацией ионов кальция и магния. Представляет собой сумму карбонатной (временной) и некарбонатной (постоянной) жесткости.
Карбонатная жесткость. Определяется наличием в воде гидрокарбонатов и карбонатов (при рН>8.3) кальция и магния. Данный тип жесткости почти полностью устраняется при кипячении воды и поэтому называется временной жесткостью. При нагреве воды гидрокарбонаты распадаются с образованием угольной кислоты и выпадением в осадок карбоната кальция и гидроксида магния.
Некарбонатная жесткость. Обусловлена присутствием кальциевых и магниевых солей сильных кислот (серной, азотной, соляной) и при кипячении не устраняется (постоянная жесткость).
Единицы измерения жёсткости воды.
В мировой практике используется несколько единиц измерения жесткости, все они определенным образом соотносятся друг с другом. В России Госстандартом в качестве единицы жесткости воды установлен моль на кубический метр (моль/м3). На Украине используется как моль/м3, так и мг-экв/л (миллиграмм эквивалент на литр). Численно эти значения совпадают. Кстати, л и дм3 — это одно и тоже, литр и дециметр кубический.
Кроме этого в различных странах широко используются такие единицы жесткости, как немецкий градус (do, dH), французский градус (fo), американский градус, ppm CaCO3.
Соотношение этих единиц жесткости представлено в следующей таблице:
| Единицы жесткости воды | ||||
| Моль/м3 (мг-экв/л) | Немецкий градус, do | Французский градус, fo | Американский градус | ppm (мг/дм3)СаСО3 |
| 1.000 | 2.804 | 5.005 | 50.050 | 50.050 |
Примечание:
- Один немецкий градус соответствует 10 мг/дм3 СаО или 17.86 мг/дм3 СаСО3 в воде.
- Один французский градус соответствует 10 мг/дм3 СаСО3 в воде.
- Один американский градус соответствует 1 мг/дм3 СаСО3 в воде.
Чтобы не заморачиваться пересчётами вручную, можно создать табличку пересчёта единиц жёсткости. Которую, кстати сказать, вы можете скачать по ссылке Таблица пересчёта единиц измерения жёсткости воды.
Откуда берётся жёсткость воды
Ионы кальция (Ca2+) и магния (Mg2+), а также других щелочноземельных металлов, обуславливающих жесткость, присутствуют во всех минерализованных водах. Их источником являются природные залежи известняков, гипса и доломитов. Ионы кальция и магния поступают в воду в результате взаимодействия растворенного диоксида углерода с минералами и при других процессах растворения и химического выветривания горных пород. Источником этих ионов могут служить также микробиологические процессы, протекающие в почвах на площади водосбора, в донных отложениях, а также сточные воды различных предприятий.
Жесткость воды колеблется в широких пределах и существует множество типов классификаций воды по степени ее жесткости. Ниже в таблице приведены целых четыре примера классификации. Две классификации из российских источников — из справочника «Гидрохимические показатели состояния окружающей среды» и учебника для вузов «Водоподготовка». A две — из иностранных: нормы жесткости немецкого института стандартизации (DIN 19643) и классификация, принятая Агентством по охране окружающей среды США (USEPA) в 1986.
Таблица наглядно иллюстрирует гораздо более «жесткий» подход к проблеме жесткости за границей. И не без причины, о чём — ниже.

Обычно в маломинерализованных водах преобладает (до 70%-80%) жесткость, обусловленная ионами кальция (хотя в отдельных редких случаях магниевая жесткость может достигать 50-60%). С увеличением степени минерализации воды содержание ионов кальция (Са2+) быстро падает и редко превышает 1 г/л. Содержание же ионов магния (Mg2+) в высокоминерализованных водах может достигать нескольких граммов, а в соленых озерах — десятков граммов на один литр воды.
В целом, жесткость поверхностных вод, как правило, меньше жесткости вод подземных. Жесткость поверхностных вод подвержена заметным сезонным колебаниям, достигая обычно наибольшего значения в конце зимы и наименьшего в период половодья, когда обильно разбавляется мягкой дождевой и талой водой. Морская и океанская вода имеют очень высокую жесткость (десятки и сотни мг-экв/дм3).
Как влияет жёсткость на качество воды
С точки зрения применения воды для питьевых нужд, ее приемлемость по степени жесткости может существенно варьироваться в зависимости от местных условий. Порог вкуса для иона кальция лежит (в пересчете на мг-эквивалент) в диапазоне 2-6 мг-экв/л, в зависимости от соответствующего аниона, а порог вкуса для магния и того ниже. В некоторых случаях для потребителей приемлема вода с жесткостью выше 10 мг-экв/л. Высокая жесткость ухудшает органолептические свойства воды, придавая ей горьковатый вкус и оказывая отрицательное действие на органы пищеварения.
Всемирная Организация Здравоохранения не предлагает какой-либо рекомендуемой величины жесткости по показаниям влияния на здоровье. В материалах ВОЗ говорится о том, что хотя ряд исследований и выявил статистически обратную зависимость между жесткостью питьевой воды и сердечно-сосудистыми заболеваниями, имеющиеся данные не достаточны для вывода о причинном характере этой связи. Аналогичным образом, однозначно не доказано, что мягкая вода оказывает отрицательный эффект на баланс минеральных веществ в организме человека.
Вместе с тем, в зависимости от рН и щелочности, вода с жесткостью выше 4 мг-экв/л может вызвать в распределительной системе водопровода отложение шлаков и накипи (карбоната кальция), особенно при нагревании. Именно поэтому нормами Котлонадзора вводятся очень жесткие требования к величине жесткости воды, используемой для питания котлов (0.05-0.1 мг-экв/л).
Кроме того, при взаимодействии солей жесткости с моющими веществами (мыло, стиральные порошки, шампуни) происходит образование «мыльных шлаков» в виде пены. Это приводит не только к значительному перерасходу моющих средств. Такая пена после высыхания остается в виде налета на сантехнике, белье, человеческой коже, на волосах (неприятное чувство «жестких» волос хорошо известное многим). Главным отрицательным воздействием этих шлаков на человека является то, что они разрушают естественную жировую пленку, которой всегда покрыта нормальная кожа и забивают ее поры.
Признаком такого негативного воздействия является характерный «скрип» чисто вымытой кожи или волос. Оказывается, что вызывающее у некоторых раздражение чувство «мылкости» после пользования мягкой водой является признаком того, что защитная жировая пленка на коже цела и невредима. Именно она и скользит. В противном случае, приходится тратиться на лосьоны, умягчающие и увлажняющие кремы и прочие хитрости для восстановление той защиты кожи, которой нас и так снабдила природа.
Вместе с тем, необходимо упомянуть и о другой стороне медали. Мягкая вода с жесткостью менее 2 мг-экв/л имеет низкую буферную емкость (щелочность) и может, в зависимости от уровня рН и ряда других факторов, оказывать повышенное коррозионное воздействие на водопроводные трубы. Поэтому, в ряде применений (особенно в теплотехнике) иногда приходится проводить специальную обработку воды с целью достижения оптимального соотношения между жесткостью воды и ее коррозионной активностью.
Вот мы и узнали подробнее про жёсткость воды. Осталось определиться со способами борьбы 🙂

По материалам http://dino-trade.ru/index.php/2010-01-21-11-16-24/205-2010-10-31-16-41-39
Жесткость воды
Жесткость воды
Жесткость воды (Н) — наиболее важный параметр качества воды при ее очистке и подготовке перед подачей на системы паро–водогрейного оборудования котельных и систем охлаждения.
Главными ионами, обуславливающими жесткость воды, являются ионы кальция и магния. Их суммарная концентрация, выраженная количеством миллиграммов–эквивалентов в 1 л воды (мг–экв/л), называется общей жесткостью (Но).
Общая жесткость рассчитывается как сумма концентраций эквивалентов ионов кальция и магния в 1 литре воды: Hо = [Ca2+]/20,04 + [Mg2+]/12,16, мг–экв/л.
Также наиболее распространенной единицей выражения жесткости является Немецкий градус жесткости, равный 0,357 градусу жесткости, применяемому в России.
Соотношения между такими единицами измерения жесткости, как Немецкий градус, Hо мг–экв/л и Hо мкг–экв/л приведены ниже:
| Немецкий градус, G, мг–экв/л | Hо мг–экв/л | Hо мкг–экв/л |
|---|---|---|
| 1 | 0,357 | 357 |
| 2,8 | 1 | 1000 |
| 0,0028 | 0,001 | 1 |
Относительные величины жесткости и щелочности природных вод делят их на два типа: Нещелочные, где Но > Що, и Щелочные, где Ноо.
Нещелочные воды, где Но > Що, наиболее распространены. В них различают: Но – жесткость общую; Нк – жесткость карбонатную, обусловленную бикарбонатами кальция и магния; Ннк – жесткость некарбонатную, с преобладающими в воде хлоридами и сульфатами кальция и магния;
НСа – жесткость кальциевую, в основном составляют соединения кальция;
HMg – жесткость магниевую, аналогично – соединения магния.
При этом имеет место быть следующее соотношение: Hо = Hк + Ннк = НCa + HMg.
Для вод, где Ноо, понятие карбонатной и некарбонатной жесткости смысла не имеет, т.к. Но3— ]. В таких водах различают общую жесткость, кальциеву, магниевую и щелочность.
Для щелочных вод, учитывая высокую концентрацию HCO3—, при расчетах водоподготовки следует принимать Нк = Но, а Ннк = 0.
Умягченные воды (прошедшие через систему водоочистки и водоподготовки, конденсат или питательная вода) характеризуются лишь общей жесткостью или остаточной.
При анализе воды, если он выполнен правильно, то должно соблюдаться равенство, в котором сумма всех положительных зарядов, обусловленных наличием в воде катионов, равна сумме отрицательных зарядов, обусловленных соответственно анионами: [Na+]/22,997 + [Ca2+]/20,04 + [Mg2+]/12,16 + [NH4+]/18,04 = [Cl—]/35,456 + [SO42-]/48,03 + [NO3—]/62,008 + Що, при том что эквивалентная концентрация суммы ионов SiO32-, HSiO3—, CO32- и HCO3— входят в общую щелочность (Що). Железо и алюминий по своим свойствам в виде ионов могут присутствовать лишь только в сильнокислой среде или при отсутствии в воде растворенного кислорода (в этом случае в воде железо находится в виде растворенного двухвалентного железа) и в данном случае не учитываются.
В быту слишком жесткая вода вызывает раздражение кожи, в ней плохо пенится и смывается мыло, на поверхностях приборов, используемых для кипячения или нагрева воды (чайники, бойлеры, тены в стиральных машинках), образуются накипные отложения.
При использовании воды в котельных, на ТЭЦ, в циркуляционных системах охлаждения к ней предъявляются особые требования по жесткости. Так, на ТЭЦ жесткость воды должна составлять не более 0,5 мкг–экв/л, что достигается последовательным ее обессоливанием на Н-катионитных и ОН-анионитных фильтрах.
Для питьевой же воды Санкт-Петербурга с ПДК по жесткости не более 7 мг–экв/л, жесткость исходной Невской воды составляет не более 0,8 мг–экв/л, что определяет ее как мягкую и не требующую специальной обработки для умягчения перед подачей потребителю.
Присутствие в котловой воде катионов Mg2+ и Ca2+ и анионов OH—, CO32-, SO42-, PO43-, SiO32-, при некоторых условиях образуют труднорастворимые соединения, как-то: CaCO3, CaSO4, CaSiO3, Ca3(PO4)4 и Mg(OH)2, MgSiO3, Mg(PO4)2.
Эти труднорастворимые соединения, в разных условиях образуют накипные или шламовые отложения, что становится причиной ухудшения работы котлового оборудования, зарастания труб, отсеков, а в конечном итоге – выводом оборудования из строя.
- Для умягчения воды есть различные методы, такие как:
- термический;
- реагентный;
- термохимический;
- умягчение воды диализом;
- метод магнитной обработки;
- катионирование.
Наиболее широкое распространение, как в промышленности, так и в быту получил метод катионного обмена, т.е. катионирование воды.
Более подробно каждый метод умягчения воды будет рассмотрен в следующей статье.
Статью подготовил:
Руководитель ПТО
OOO «CАТ»
Макаров Василий А.
8-905-282-32-19
Нужна консультация? Свяжитесь с нами!
Телефон: +7 905 282 32-19
Email: [email protected]