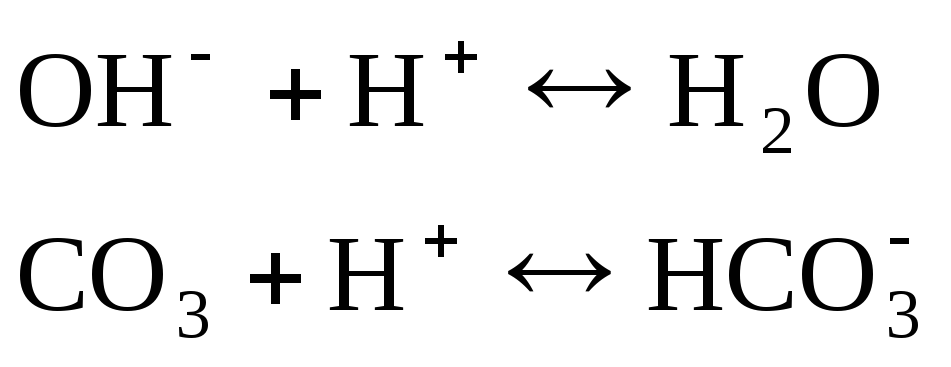Жесткость воды
Общей жесткостью (Жо) называют суммарную концентрацию ионов кальция и магния, выраженную в эквивалентных единицах (мг-экв./кг). Общую жесткость подразделяют на кальциевую ( ЖСа2+) и магниевую ( ЖMg2+). Часть общей жесткости, эквивалентная содержанию бикарбонатов и карбонатов кальция и магния, называется карбонатной жесткостью ( Жк). Некарбонатная жесткость обусловлена кальциевыми и магниевыми солями серной, соляной, кремниевой и азотной кислот ( Жнк).Таким образом, общая жесткость равна сумме кальциевой и магниевой жесткости с одной стороны, и сумме карбонатной и некарбонатной жесткостей с другой.
Жесткость природных вод не является вредной для здоровья человека, скорее наоборот, так как кальций способствует выводу из организма кадмия, отрицательно влияющего на сердечно-сосудистую систему. Однако, повышенная жесткость делает воду непригодной для хозяйственно-бытовых нужд, поэтому согласно ГОСТ 2874-82 норма общей жесткости – 7мг-экв./кг, а допустимая величина – 10 мг-экв./кг.
Щелочность воды
Щелочностью называется содержание веществ, обусловливающих при диссоциации или в результате гидролиза образование гидроксид-ионов ( ОН—). В практике водоснабжения определяют формы щелочности: гидратную, карбонатную, бикарбонатную или другие формы, обусловленные анионами слабых кислот. Так, бикарбонатная щелочность включает все бикарбонаты, которые присутствуют в данной воде, т.е. бикарбонаты натрия, калия, магния, кальция и др. В водах с высокой цветностью щелочность зависит ещё от содержания в ней гуматов (солей сложных органических кислот, переходящих в воду из почв и ила). Органические кислоты относятся к слабым электролитам, поэтому способны придавать воде щелочной характер.
ЦЕЛЬ РАБОТЫ: изучение показателей, определяющих качество природных и сточных вод, норм качества питьевой воды по ГОСТу, знакомство с методами лабораторного контроля качества и овладение практическими навыками проведения анализов воды.
Приложение.
Методики аналитического контроля
1.Определение жесткости
В коническую колбу вместимостью 250 мл отмеривают 100 мл исследуемой воды, добавляют 5 мл аммиачного буферного раствора и 7…8 капель индикатора – хром кислотный темно-синий. При этом раствор окрашивается в розовый цвет и его сразу же титруют 0,1 н раствором трилона Б при интенсивном перемешивании до изменения розовой окраски в синюю. Замечают по делениям бюретки объем раствора трилона Б, затраченного на титрование.
Если на титрование затрачено больше 10 мл раствора трилона Б, то опыт следует повторить, взяв для определения меньший объем пробы (50 мл) и довести пробу до 100 мл дистиллированной водой.
Общая жесткость вычисляется по формуле, мг-экв/кг
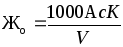
где с– нормальность раствора трилона Б;
А – объем раствора трилона Б, мл;
V– объем анализируемой пробы, мл.
2.Определение концентрации ионов кальция
В коническую колбу вместимостью 250 мл отмеряют 100 мл исследуемой пробы, или меньший объем, разбавленный до 100 мл, добавляют 2 мл 2н раствора NaOH и 10…15 мг сухой смеси индикатора мурексида, титруют 0,1 н раствором трилона Б при энергичном помешивании до перехода малиновой окраски в сине-фиолетовую. Замечают по делениям бюретки объем раствора, затраченного на титрование. Содержание ионов кальция или кальциевую жесткость рассчитывают по формуле, мг-экв/кг
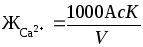
где с– нормальность раствора трилона Б;
К – поправочный коэффициент к нормальности раствора трилона Б;
А – объем раствора трилона Б, мл;
V– объем анализируемой пробы, мл.
Взаимосвязь pH, CO2, щелочности и жесткости в пруду
Качество воды в пруду изменяется под действием нескольких химических веществ. Концентрация углекислого газа, pH, щелочность и жесткость взаимосвязаны и оказывают серьезное влияние на продуктивность пруда, уровень стресса, здоровье рыб, количество доступного кислорода и токсичность аммония и некоторых металлов. Большинство характеристик воды не постоянны. Концентрация углекислого газа и pH подвержены ежедневным флуктуациям. Щелочность и жесткость относительно стабильны, однако могут меняться с течением времени, обычно в течение недель и месяцев. Их стабильность зависит от pH или минерального состава толщи воды и донной породы.
pH и углекислый газ
О том, является ли вода кислой или щелочной говорит водородный показатель – pH. Он обозначает концентрацию ионов водорода в воде и представляет собой её отрицательный десятичный логарифм — -log[H+]. Вода считается кислой, если pH ниже 7 единиц, и щелочной – если более 7. Значения pH, как правило, колеблются от 0 до 14 единиц. В аквакультуре диапазон кислотности составляет – 6.5-9.0.
Рыбы и другие позвоночные имеют кровь со значением pH 7.4. Кровь рыб находится в тесном контакте с водой (граница раздела – 1-2 клеточных слоя). В пруду рекомендуется поддерживать диапазон, близкий к pH крови рыб – 7.0-8.0. Если водородный показатель упадет ниже 5 единиц или поднимется выше 10 (т.е. низкая щелочность, вместе с активным фотосинтезом водорослей), рыба почувствует себя плохо и погибнет.
Значения pH в пруду варьируют в течение дня. Ночью концентрация растворенного кислорода снижается, потому что останавливается фотосинтез, растения и животные дышат и расходуют кислород. При плотной посадке концентрация углекислого газа становится высокой в результате дыхания. Свободный CO2 реагирует с водой, приводя к возникновению угольной кислоты (H2CO3), и pH снижается:
H2O + CO2 = H2CO3 = H+ + HCO3—
В таблице обобщены относительные изменения концентрации растворенного кислорода, CO2 и pH в течение 24 часов
| Время | Растворенный кислород | Растворенный углекислый газ | pH |
| День | Возрастает | Снижается | Возрастает |
| Ночь | Снижается | Возрастает | Снижается |
Углекислый газ редко напрямую оказывает токсическое влияние на рыб. Однако его высокие концентрации снижают pH и, вследствие снижения pH в крови жабр, ограничивают возможность крови рыб переносить кислород. При заданной концентрации кислорода (например, 2 мг/л) рыба может задохнуться, когда уровень CO
Высокие значения концентрации углекислого газа практически всегда обусловлены низкими концентрациями растворенного кислорода (высокая дыхательная активность). Для повышения низких значений кислорода проводится аэрация воды. Она же помогает снизить высокий уровень CO
Щелочность
Общая щелочность характеризует количество оснований, присутствующих в воде. Как правило, в пруду присутствуют карбонаты, бикарбонаты, гидроксиды, фосфаты и бораты. Карбонаты и бикарбонаты самые распространенные и наиболее важные компоненты щелочности. Этот показатель измеряется по количеству кислоты (H
Карбонатная-бикарбонатная щелочность (и жесткость) поверхностных и колодезных вод создается преимущественно в ходе взаимодействия растворенного в воде CO2 и извести грунта. Дождевая вода имеет естественную кислую реакцию, потому что насыщена атмосферным углекислым газом. Как только она проходит сквозь почву, каждая капля насыщается CO
CaCO3 + H2O + CO2 = Ca+2 + 2HCO3—
CaMg(CO3)2 + 2H2O + 2CO2 = Ca+2 + Mg+2 + 4HCO3—
В результате, возрастают щелочность, кислотность и жесткость воды.
Щелочность, pH и концентрация углекислого газа
В воде с умеренной или высокой щелочностью (хорошая буферная емкость) и схожим уровнем жесткости, pH был нейтральным или слегка основным (7.0 – 8.3) и не колебался в широких пределах. Более высокие концентрации CO2 (т.е. угольная кислота) или другие кислоты требуют для снижения pH больше оснований, которые могли бы нейтрализовать или буферизировать кислоту.
В таблице можно видеть взаимосвязь между щелочностью, pH и концентрацией CO2
Изменения pH в течение 24 часов в воде с высокой и низкой щелочностьюЗначения фактора для расчета концентрации углекислого газа в воде с известным pH, температурой и щелочностью (Tucker (1984). При pH выше 8.4 концентрация CO2 незначительнаЧисло (фактор), отмеченный в таблице и соответствующий определенным значениям pH и температуры, умножается на значение щелочности (мг/л CaCO3). Результат этого уравнения позволяет оценить концентрацию CO2 (мг/л).
Например, в пруду с сомами pH = 7.2, температура = 25°C, и общая щелочность = 103 мг/л. Значение фактора = 0.124. Концентрация углекислого газа равна = 0.124 x 103 мг/л щелочности = 12.8 мг/л CO2.
Для минимизации ошибки этих расчетов необходимо в течение 30 минут регистрировать pH. Вследствие нескольких источников погрешности предпочтительно прямое измерение концентрации углекислого газа при помощи химических тестов.
Щелочность, pH и фотосинтез
Основания, обуславливающие щелочность, влияют и нейтрализую кислоты. Карбонаты и бикарбонаты могут реагировать с кислотами и щелочами, и буферизировать (минимизировать) изменения pH среды. Кислотность воды с высокими буферными свойствами колеблется в пределах 6.9-9 единиц. В воде с низкими буферными свойствами pH может достигать угрожающе низких (углекислый газ и угольная кислота образуются вследствие дыхания) или угрожающе высоких значений (высокая активность фотосинтеза).
Фитопланктон представляет собой микроскопические или около микроскопические водные растения, ответственные за продукцию значительной части кислорода в пруду и реализацию фотосинтеза. При стабильном значении pH около 6.5 или выше, щелочность улучшает продуктивность фитопланктона, потому что повышает доступность нутриентов (растворимые фосфаты). Щелочность выше 20 мг/л захватывает CO2 и увеличивает его концентрацию, доступную для фотосинтеза.
Так как фитопланктон использует CO2 в фотосинтезе, pH в воде возрастает со снижением концентрации углекислого газа и угольной кислоты. Кроме того, фитопланктон и другие растения переводят бикарбонаты (HCO3—) в углекислый газ для фотосинтеза и высвобождает карбонаты:
2HCO3— + фитопланктон = CO2 (фотосинтез) + CO3-2 + H2O
CO3-2 + H2O = HCO3— + OH— (сильное основание)
Высокие значения pH также могут обуславливать снижение концентрации H+:
CO3-2 + H+ = HCO3— или
HCO3— + H+ = H2O + CO2
Высвободившийся при посредничестве растительной биомассы карбонат из бикарбоната, может вызывать значительное возрастание pH (выше 9) в периоды активного фотосинтеза фитопланктона. Этот подъем pH наблюдается при низкой щелочности воды (20-50 мг/л) или в воде с умеренной и высокой карбонатной щелочностью (75-200 мг/л) и жесткостью менее 25 мг/л. Высокая бикарбонатная щелочность в мягкой воде обусловлена карбонатами натрия и калия, более водорастворимыми, чем карбонаты кальция и магния, влияющими на жесткость. Если присутствуют кальций, магний и образующийся фотосинтетический карбонат, когда pH выше 8.3, формируется известняк. Пруды с щелочностью ниже 20 мг/л обычно не имеют вспышек роста водорослей и, соответственно, вызванного фотосинтезом, резкого подъема pH.
Жесткость
Жесткость является важным показателем воды при культивировании рыб. В гидрохимическом анализе он обычно присутствует. Жесткость определяется по концентрации двухвалентных ионов — кальцием, магнием и/или железом. Она может включать смесь двухвалентных солей, но кальций и магний всегда преобладают.
Традиционно, жесткость измеряется в ходе химического титрования. Жесткость образцов воды выражается в миллиграммах на литр в эквиваленте карбоната кальция (мг/л CaCO3). Кальциевая карбонатная жесткость основной индикатор количества двухвалентных солей, который не проводит различий между кальцием, магнием и солями других двухвалентных элементов.
Часто жесткость путают с щелочностью (общая концентрация оснований). Путаница возникает из-за того, что оба параметра измеряются в мг/л эквивалента CaCO3. Если известняк ответственен за оба параметра, жесткость и щелочность, их концентрация будет схожей. Однако, если в растворе, где на щелочность влияет NaHCO3, жесткость будет низкой, а щелочность, напротив, высокой. Кислые, подземные и колодезные воды могут иметь низкую или высокую жесткость и очень низкую щелочность (либо вообще не иметь её).
Кальций и магний важны для протекания ряда биологических процессов в организме рыб (формирование костей и чешуи, свертывании крови и других метаболических реакциях). Рыбы способны абсорбировать кальций и магний непосредственно из воды или с кормом.
Кальций наиболее важный двухвалентный элемент в культуральной воде. Присутствие свободного (ион) кальция в воде помогает снизить потери других солей (т.е. натрия и калия) из внутренних жидкостей рыб (крови). Натрий и калий входят в состав крови рыб. Они участвуют в реализации ряда процессов, в том числе, деятельности сердца, иннервации и мышечной деятельности. Исследования показали, что кальций окружающей среды также требуется для ре-абсорбции потерянных солей натрия и калия. В воде с низкой концентрацией кальция моет наблюдаться утечка значительных количеств натрия и калия в воду. Для вторичного впитывания этих элементов затрачивается энергия тела. Для некоторых видов рыб (Sciaenops ocellatus, Morone saxatilis) для выживания важно высокое значение кальциевой жесткости.
Рекомендуемый диапазон свободного кальция в культуральной воде составляет 25-100 мг/л (65-250 мг/л CaCO3). Канальный сом толерантен к низкой концентрации кальция до тех пор, пока его корм содержит минимальный уровень кальция, однако скорость его роста низкая. Аналогично, радужная форель переносит низкие концентрации кальция (10 мг/л), если pH выше 6.5. Для выращивания Sciaenops ocellatus, Morone saxatilis или раков желательна концентрация свободного кальция 40-100 мг/л (100-250 мг/л CaCO3), что соответствует концентрации кальция в крови рыб (100 мг/л Ca или 250 мг/л CaCO3). Жесткость источников воды для этих видов должна быть проверена.
Низкая карбонатная жесткость надежный индикатор низкого содержания кальция. Однако высокая жесткость необязательно отражают высокую концентрацию этого элемента.
Карбонатная жесткость 100 мг/л включает 40 мг/л свободного кальция (делим CaCO3 на 2.5), в случае, если она обусловлена лишь присутствием кальция. Аналогично, если значение карбонатной жесткости 100 мг/л и представлена свободным магнием, концентрация магния составляет 24 мг/л (делим CaCO3 на 4.12). Эти факторы (2.5 и 4.12) связаны с молекулярной массой CaCO3 и различиями массы атомов магния и кальция. Там, где жесткость обусловлена присутствием известняка, значение CaCO3 обычно отражает смесь свободного кальция и магния. Но магния все равно преобладает в смеси.
Известняк может использоваться в сельском хозяйстве для повышения концентрации кальция (и карбонатной-бикарбонатной жесткости) в областях с кислой водой или почвой. Однако при pH 8.3 или выше известняк не растворяется. Мягкую, щелочную воду можно обогатить кальцием с помощью гипса (CaSO4) или CaCl2. Большие объемы обработки могут привести к серьезным расходам, и более практичным будет поиск другого источника воды.
Влияние pH, щелочности и жесткости на токсичность аммония и металлов
Аммоний становится более токсичным при возрастании pH. Высокие концентрации токсичной неионизированной формы аммония (NH3) формируются в основной воде, тогда как NH4+ преобладает в кислой воде. Так как щелочность повышается с ростом pH, аммоний становится более ядовитым в воде с высокой общей щелочностью. Жесткость обычно не связана с токсичностью аммония.
Металлы, такие как медь и цинк, более распространены в быту (в бассейнах, сантехнике и CuSO4). Они становятся лучше растворяются в кислой воде. Растворимость или свободная ионизированная форма этих металлов токсична для рыб. Высокая общая щелочность повышает pH и доступность оснований, которые способствуют образованию менее токсичных нерастворимых форм меди и цинка. Высокие концентрации кальция и магния (жесткость) блокируют эффекты меди и цинка в местах их токсического влияния. Поэтому, эти металлы более ядовиты для рыб в мягкой, кислой воде с низкой общей щелочностью.
В идеале, пруд с аквакультурой должен иметь pH 6.5-9.0, умеренную или высокую щелочность (75-200 мг/л, но не менее 20 мг/л) и кальциевую карбонатную жесткость 100-200 мг/л CaCO3. Многие принципы химизма абстрактны (буферизация, карбонатный-бикарбонатный) и их сложно понять. Но фундаментальное понимание взаимосвязи pH, CO2, щелочности и жесткости необходимо для эффективного управления аквакультурой.
——
www2.ca.uky.edu/wkrec/interactionsphetc.pdf
William A. Wurts and Robert M. Durborow. Interactions of pH, Carbon Dioxide, Alkalinity and Hardness in Fish Ponds. Southern Regional Aquaculture Center. SRAC Publication No. 464. 2012.
Определение общей щелочности и карбонатной жесткости воды » Блог о самостоятельном туризме
Жесткость воды зависит от присутствия в ней растворимых солей кальция и магния. Различают карбонатную (устранимую) жесткость и постоянную. Карбонатная жесткость обусловлена присутствием в растворе бикарбонатов кальция и магния Са(НСО3)2 и Mg(НСО3)2. Постоянная жесткость воды обусловлена присутствием в воде других растворимых солей кальция и магния (сульфатов). Сумма постоянной и карбонатной жесткости составляет общую жесткость воды. Общая щелочность воды обусловлена присутствием ионов ОН—, СОз2-, НСОз—.
Определение основано на титровании раствора, содержащего NaOH и Na2CO3, стандартным раствором хлорводородной кислоты с двумя индикаторами – фенолфталеином и метиловым оранжевым, применяемыми последовательно. При титровании раствора, содержащего эти вещества, хлорводородной кислотой в присутствии фенолфталеина происходят следующие реакции:
HCl+NaOH= NaCl +H2O
HCl+ Na2CO3 =NaCl + NaHCO3
Следовательно по фенолфталеину оттитровывается вся щелочь и карбонат до бикарбоната и обесцвечивание фенолфталеина указывает на то, что обе реакции полностью завершились, и вместо исходных веществ в растворе имеются NaCl и NaHCO3. Бесцветный раствор, содержащий эти продукты реакции, имеет слабощелочную реакцию, при добавлении метилового оранжевого он окрашивается в желтый цвет, и если продолжать титрование кислотой, будет происходить следующая реакция:
HCl + NaHCO3= NaCl+H2CO3= NaCl+CO2+H2O
Следовательно, по метиловому оранжевому оттитровывается бикарбонат. Изменение желтой окраски на розовую свидетельствует о том, что реакция полностью закончилась.
Разность объемов хлорводородной кислоты (VHClм-о— VHClф-ф), затраченных на титрование смеси с метиловым оранжевым и фенолфталеином, соответствует половине количества карбоната натрия, присутствующего в растворе. Удваивая эту разность, получают объем кислоты [2(VHClм-о— VHClф-ф)], эквивалентный количеству всего карбоната. Вычитая указанную разность из объема VHClф-ф, израсходованного на титрование смеси с фенолфталеином, находят объем кислоты, эквивалентный количеству гидроксида натрия.
У подавляющего большинства природных вод ионы НСОз— связаны только с ионами кальция и магния. Поэтому в тех случаях, когда щелочность по фенолфталеину равна нулю, можно считать, что общая щелочность воды равна ее карбонатной жесткости.
Порядок выполнения работы. 1. Из общего раствора объемом 100 мл исследуемой воды, отбирают 20 мл пипеткой или цилиндром в коническую колбу вместимостью 100 мл.
2. Добавляют 2-3 капли раствора фенолфталеина и быстро титруют кислотой. До 12-15 мл титрование проводят быстро, перемешивая раствор, а под конец титрант добавляют по каплям до обесцвечивания. Записывают отсчет по бюретке (VHClф-ф),
3. Прибавляют в колбу 2 капли метилового оранжевого и продолжают титрование до перехода окраски из желтой в оранжевую. Производят второй отсчет по бюретке (VHClм-о).
Определение карбонатной жесткости воды. Жесткость воды
Жесткость подразделяют на постоянную и временную, она же карбонатная, она же устранимая жесткость связана с присутствием в воде наряду с Ca 2+ и Mg 2+ гидрокарбонатных или бикарбонатных анионов (HCO 3). Временную жесткость можно устранить кипячением — отсюда и ее название. При кипячении воды гидрокарбонатные анионы вступают в реакцию с этими катионами и образуют с ними очень мало растворимые карбонатные соли, которые выпадают в осадок.
Ca 2+ + 2HCO — 3 = CaCO 3 v+ H 2 O + CO 2 ^
Метод определения карбонатной жесткости путем титрования пробы воды соляной кислотой измеряют вовсе не жесткость так таковую, то есть не концентрацию Ca 2+ и Mg 2+ , а щелочность — концентрацию в растворе гидрокарбонатных ионов.
Если строго следовать определению карбонатной жесткости, то ее корректное измерение должно быть основано на кипячении заданного объема воды с последующим взвешиванием образовавшегося осадка (накипи), но на практике это трудно выполнимо. Поэтому поступают иначе.
Определение карбонатной жесткости воды приводится путем ее титрования соляной кислоты. Титрование — добавление в исследуемую пробу раствора реагента, концентрация которого заранее известна. По расходу этого реагента — он взаимодействует с тем веществом, содержание которого хотят определить, рассчитывают концентрацию определяемого вещества. Для аквариумных нужд удобно пользоваться 0,05 M раствором соляной кислоты. А также необходим индикатор метиловый оранжевый, который нужен для того, чтобы установить момент окончания титрования.
> Проведение анализа
Точно отмеряют 50 мл исследуемой воды и добавляют несколько капель раствора метилового оранжевого.
При титровании в растворе произойдут следующие реакции:
Сравним это и приведенное выше уравнение, которое показывало, что происходит с гидрокарбонатами кальция при кипячении. Как и при кипячении конечными продуктами этих реакций являются вода и углекислый газ. Только кальций здесь участия не принимает, так как ионы водорода, которые образуются в растворе при добавлении туда HCl вступают в реакцию не с ионами кальция, а именно с гидрокарбонатными ионами.
Кислоту удобно набрать в шприц до отмеченного заранее деления и из него дозировано добавлять в раствор. Сначала порции кислоты могут быть большими, но к концу титрования надо быть аккуратным и осторожным. Цвет может поменяться даже от одной капли. Способность раствора реагировать с ионами водорода по мере добавления кислоты будет постепенно уменьшаться и, наконец окажется почти совсем исчерпанной — кончатся гидрокарбонатные ионы и последняя капля кислоты резко сместит рН, так как связывать возникающие при ее диссоциации в воде ионы водорода уже будет «некому». При величине рН меньшей 4 гидрокарбонатных ионов в растворе уже нет. Индикатор при этом значении рН изменит цвет раствора с желтого на оранжевый. Тут титрование надо прекратить. Лучше проделать эту процедуру несколько раз, точно засекая какой объем кислоты был израсходован. Затем вычислить средний объем пошедший на титрование кислоты. Зная этот объем рассчитывают карбонатную жесткость по формуле:
Жесткость карбонатная (мг-экв/л.) = (1000*С кислоты * V кислоты) / V воды
С кислоты — концентрация кислоты в молях,
V кислоты — объем раствора кислоты, использованный при титровании (мл)
V воды — объем пробы воды, взятой для титрования (мл.)
Если С кислоты = 0,05 M, а V воды = 50 мл, то жесткость карбонатная (мг-экв/л.) = (1000*0,05*V кислоты)/50 = V кислоты
То есть титрование 50 мл воды 0,05 M соляной кислоты, то в этом случае карбонатная жесткость в мг-экв./л. Будет численно равна объему кислоты (в мл.), израсходованному для титрования. Например, если на титрование ушло 1,5 мл. раствора кислоты, то карбонатная жесткость воды 1,5 мг — экв./л. Для перевода в градусы KH значение в мг-экв/л. Надо умножить на 2,804.
1,5*2,804 = 4,2 ?KH
На самом деле этим методом мы определили щелочность воды, то есть ее способность связывать ионы водорода, которые образуются при диссоциации в воде соляной кислоты.
Гидрокарбонатный ион может поступать в воду не только при растворении карбонатов кальция и магния, но и при растворении иных солей. Всем известная питьевая сода являет собой пример такого соединения NaHCO 3 . Если внести питьевую соду в аквариум, то растворившись она даст ионы натрия и гидрокарбоната. Гидрокарбонатные ионы присоединяют к себе ионы водорода, поэтому вода в аквариуме от внесения питьевой соды становится менее кислой или приобретает щелочную реакцию, но это зависит от дозы. Небольшие ее добавки застрахуют от неожиданных скачков рН. Решить достаточно соды внесено или нет можно измерив щелочность. Зная щелочность вы можете оценить насколько вода в аквариуме способна противостоять закислению, то есть оценить буферность. Если щелочность пресной воды низкая (менее мг/экв/л), то ее буферность невелика. Такая вода может резко скиснуть, например при неожиданной остановке фильтра. Интервал значений щелочности 1,2-2 мг-экв/л пригоден для большинства рыб и растений. Буферность воды при этом будет вполне достаточной для поддержания стабильной активной реакции воды рН. Обычно щелочность аквариумной воды как раз и оказывается в указанном интервале или даже имеет еще большие значения 3 мг-экв/л и выше (в этом случае возможны проблемы с выращиванием многих растений и нашествия водорослей). В регионах с мягкой слабокислой водой она может быть очень низкой. Если вносили в аквариум соду, чтобы поднять и стабилизировать рН, то не нужно удивляться если «карбонатная жесткость» вдруг превысит общую. Если вносили в воду аквариума NaHCO 3 , то есть не связанные с кальцием и магнием гидрокарбонатные ионы, то естественно их будет больше, чем ионов Ca 2+ и Mg 2+ . Вот в этом и состоит суть парадокса, когда формула:
Общая жесткость = Постоянная жесткость + Временная жесткость не выполняется из-за того, что временная больше общей.
термический давление водный динамический
Жесткость воды
Жесткость воды обусловлена присутствием в ней растворенных солей кальция и магния. Если в воде растворены гидрокарбонаты этих металлов Са(НСО 3) 2 и Mg(HCO 3) 2 , то жесткость называется карбонатной или временной. Остальные соли кальция и магния (хлориды, сульфаты, силикаты и др.) вызывают некарбонатную или постоянную жесткость воды.
Общ
Тут есть жесткость воды — Стр 16

Таблица 4.8. Характеристика вод по минерализации
| Группа воды |
| Единицы измерения, г/кг |
|
|
|
| ||
| Пресные |
| До 1 |
|
| Солоноватые |
| Более 1 до 25 |
|
| Соленые |
| Более 25 до 50 |
|
|
|
|
|
|
| Рассолы |
| Более 50 |
|
Жесткость
Жесткость воды обусловливается наличием в воде ионов кальция (Са2+), магния (Mg2+), стронция (Sr2+), бария (Ва2+), железа (Fe3+), марганца (Mn2+). Но общее содержание в природных водах ионов кальция и магния несравнимо больше содержания всех других перечисленных ионов – и даже их суммы. Поэтому под жесткостью понимают сумму количеств ионов кальция и магния – общая жесткость, складывающаяся из значений карбонатной (временной, устраняемой кипячением) и некарбонатной (постоянной) жесткости (рис.3).
Рис. 4.3. Общая жесткость
Первая вызвана присутствием в воде гидрокарбонатов кальция и магния, вторая наличием сульфатов, хлоридов, силикатов, нитратов и фосфатов этих металлов. Однако при значении жесткости воды более 9 ммоль/л нужно учитывать содержание в воде стронция и других щелочноземельных металлов.
По стандарту ИСО 6107-1-8:1996, включающему более 500 терминов, жесткость определяется, как способность воды образовывать пену с мылом.
Международные своды нормативов качества воды не нормируют жесткость воды – только отдельно содержание в воде ионов кальция (Са2+) и магния (Mg2+): нормы качества питьевой воды Всемирной организации здравоохранения (ВОЗ), такие же нормы Европейского Союза (ЕС), стандарты ИСО, а также Национальные нормы питьевой воды США. По значению общей жесткости природные воды делят на группы – таблица 4.9.
Таблица 4.9.Классификация воды по жесткости
| Группа воды |
|
| Единица | измерения, |
| |
|
|
|
| ||||
|
|
|
| ммоль/л |
|
| |
| Очень мягкая |
|
| До 1,5 |
|
|
|
| Мягкая |
|
| Более 1,5 до 4,0 |
|
| |
| Средней жесткости |
|
| Более 4 | до 8 |
|
|
| Жесткая |
|
| Более 8 | до 12 |
|
|
|
|
|
|
|
|
| |
| Очень жесткая |
|
| Более 12 |
|
| |
|
|
|
|
|
|
|
|
Щелочность
150
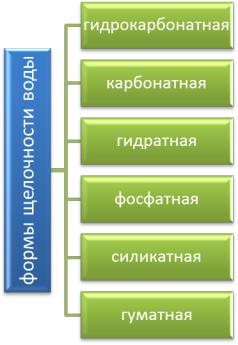
Щелочностью воды называется суммарная концентрация содержащихся в воде анионов слабых кислот и гидроксильных ионов (выражена в ммоль/л), вступающих в реакцию с соляной или серной кислотами с образованием хлористых или сернокислых солей щелочных и щелочноземельных металлов. Виды щелочности приведены на рис. 4.4.
Рис. 4.4. Виды щелочности
Щелочность природных вод, рН которых обычно < 8,35, зависит от присутствия в воде бикарбонатов, карбонатов, иногда и гуматов.
Щелочность других форм появляется в процессах обработки воды. Так как в природных водах почти всегда щелочность определяется бикарбонатами, то для таких вод общую щелочность принимают равной карбонатной жесткости.
Органические вещества
Спектр органических примесей очень широк (рис. 4.5.)
Группа растворенных примесей: гуминовые кислоты и их соли – гуматы натрия, калия, аммония; некоторые примеси промышленного происхождения; часть аминокислот и белков;
Группа нерастворенных примесей: фульвокислоты (соли) и гуминовые кислоты и их соли – гуматы кальция, магния, железа; жиры различного происхождения; частицы различного происхождения, в том числе микроорганизмы.
Гуминовые кислоты (С60Н52О24(СООН)4, С-52-58%, Н-3,3-4,8%, О2-34-39%), которые в водоёмах в основном присутствуют в коллоидной степени дисперсности. Водород карбоксильных групп СООН способен замещаться катионитами, образуя соли — гуматы. Гуминовые кислоты замещаются катионами, образую соли – гуматы. Гуминовые кислоты могут образовывать с железом и алюминием комплексные соединения.
151
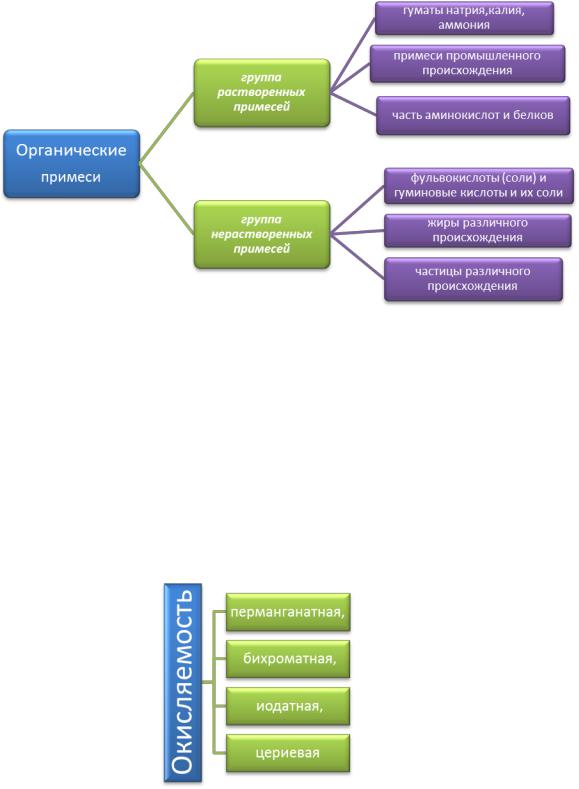
Рис. 4.5.Примеси в воде
Коллоидные соединения фульвокислот (С-45-48%, Н-5,2-6%, О2-43-48%). Легко растворяются в воде и щелочах. Они образуют с натрием, калием, кальцием, аммонием и двухвалентным железом растворимые в воде соли.
Присутствие органических веществ в природных водах обуславливает их цветность, ослабление прозрачности, иногда запах, специфический привкус, биологическое потребление кислорода. Наиболее окрашенными являются гуминовые кислоты, наименееистинно растворённые фульвокислоты.
Органические вещества затрудняют реагентную очистку воды из-за сорбции коллоидов на частицах шламового фильтра осветлителей, препятствует их укрупнению и осаждению.
Рис. 4.6.Виды окисляемости
Повышенное содержание органических веществ отрицательно отражается и на работе анионитовых фильтров установок по химическому обессоливанию воды.
Величина, характеризующая содержание в воде органических и минеральных веществ, окисляемых одним из сильных химических окислителей при определенных условиях,
называется окисляемостью.
152
Существует несколько видов окисляемости воды (рис.4.6.): перманганатная, бихроматная, иодатная, цериевая. Окисляемость выражается в миллиграммах кислорода, эквивалентного количеству реагента, пошедшего на окисление органических веществ, содержащихся в 1 л воды
Рис. 4.7. Соотношение органических и неорганических примесей в поверхностных и подземных водах
Окислители могут действовать и на неорганические примеси, например, на ионы Fe2+, S2- NO2-, но соотношение между этими ионами и органическими примесями в поверхностных водах существенно сдвинуто в сторону органических примесей, то есть «органики» в решающей степени больше (рис.4.7.). В подземных водах (артезианских) это соотношение – обратное, то есть органических примесей гораздо меньше, чем указанных ионов. Для природных малозагрязненных вод рекомендовано определять перманганатную окисляемость (перманганатный индекс)
Окисляемость перманганатная измеряется мгО/л, если учитывается масса иона кислорода в составе перманганата калия, пошедшего на окисление «органики», или мг KMnО4/л, если оценивается количество перманганата калия, пошедшего на окисление «органики» – таблица
4.10.
Таблица 4.10. Характеристика вод по перманганатной окисляемости
| Величина окисляемости |
|
| Единица измерении, мгО/л |
| |
|
|
|
| |||
| Очень малая |
|
| До 4 |
|
|
| Малая |
|
| Более 4 | до 8 |
|
| Средняя |
|
| Более 8 | до 12 |
|
| Высокая |
|
| Более 12 до 20 |
| |
|
|
|
|
|
| |
| Очень высокая |
|
| Более 20 |
| |
Водородный показатель (рН)
Величина pH – один из важнейших показателей качества воды для определения ее стабильности, накипеобразующих и коррозионных свойств, прогнозирования химических и биологических процессов, происходящих в природных водах. Если рассматривать воду без примесей, то физическая сущность рН может быть описана следующим образом.
153
Вода, хотя и весьма незначительно (приблизительно одна миллионная часть молекул), диссоциирует на ионы водорода H+ и гидроксила ОНпо уравнению:
Н2О=Н+ + ОН-
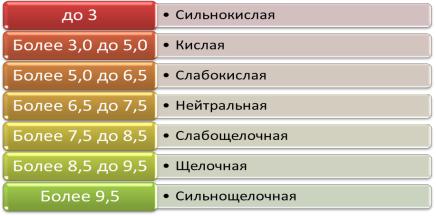
Воду в зависимости от рН рационально делить на семь групп (рис.4.8.).
Рис. 4.8. Классификация воды по значению рН
Тяжелые металлы
Тяжелые металлы выделяются из общей группы металлов по специфической вредности для живых организмов.
Понятие «тяжелые металлы» не относится к строго определенным. Разные авторы в составе группы тяжелых металлов указывают разные химические элементы. В экологических публикациях в эту группу включают около 40 элементов с атомной массой более 50 атомных единиц.
Н.Ф. Реймерс относит к тяжелым металлы с плотностью более 8 г/см3, выделяя при этом подгруппу благородных металлов. Таким образом, к собственно «тяжелым» отнесены медь, никель, кадмий, кобальт, висмут, ртуть, свинец.
Группа специалистов, работающая под патронажем Европейской экономической комиссии ООН и занимающаяся мониторингом выбросов в окружающую природную среду тяжелых металлов, включает в эту группу также цинк, мышьяк, селен, сурьму. Есть и другие классификации.
Питьевая вода, подаваемая водопроводом, не должна содержать более 0,05 мг/л мышьяка, 1 мг/л меди, 5 мг/л цинка и 0 ,1 мг/л свинца.
4.2.1. Требования к качеству питьевой воды
Запах и привкус при температуре 20ºС должны быть не более 2 баллов;
Цветность по платиново-кобальтовой шкале должна быть не более 20º;
Мутность — не более 1,5 мг/л;
Содержание железа — не более 0,3 мг/л;
Содержание марганца — не более 0,3 мг/л;
154
Содержание фтора — 0,7-1,5 мг/л;
Общая жесткость воды должна быть не более 7 мг-экв/л.
Вводе допускается содержание:
свинца — не более 0,1 мг/л,
мышьяка — 0,05 мг/л,
меди — 1 мг/л,
цинка — 5 мг/л,
полиакриламида — 2 мг/л,
нитратов — 10 мг/л,
остаточного алюминия — 0,5 мг/л.
Общее число бактерий при посеве 1 мл неразбавленной воды, определяемое числом колоний, 24-часового выращивания при 37ºС должно быть не более 100, а число кишечных палочек в 1 л воды — не более 3 (коли-титр не менее 300). Активная реакция рН при осветлении и умягчении воды должна быть не менее 6,5 и не более 8,5. При хлорировании воды должны отсутствовать хлорфенольные запахи. Оптимальная температура хозяйственно-питьевой воды 7-10ºС. Предельно допускаемая температура воды 35ºС.
(https://www.riigiteataja.ee/akt/13256473)
4.2.2. Требования к качеству воды для промышленных нужд
Существует три основных вида потребления технической воды на промышленных предприятиях:
от 70 до 90% воды используется на промышленных предприятиях в качестве хладоагента, охлаждающего продукцию в теплообменных аппаратах, или для защиты отдельных элементов установок и машин от чрезмерного нагрева. Эта вода нагревается, но не загрязняется охлаждающей продукцией.
от 5 до 13% технической воды используется для очищения продукции или сырья от примесей, а также в качестве транспортирующей среды. Эта вода загрязняется и нагревается, если материалы, с которыми она контактирует, имеют повышенную температуру.
от 10 до 20% технической воды теряется за счет испарения или входят в состав произведенной продукции.
Качество воды, используемой на производстве, устанавливается в зависимости от назначения воды и требований технологического процесса с учетом перерабатываемого сырья, применяемого оборудования и готового продукта производства. Вода должна быть безвредна для здоровья человека при возможном контакте с ней и не должна обладать отрицательными органолептическими свойствами при открытой системе водоснабжения. В табл. 4.11 приведены примерные требования к качеству воды, используемой в системах оборотного водоснабжения промышленных предприятий. Эти требования имеют условный характер, так как они в значительной степени зависят от типа теплообменного оборудования, температуры
155
воды, темпера туры охлаждаемого продукта или оборудования, характера взвешенных и растворенных веществ и др.
Таблица 4.11. Нормативы качества воды, используемой для охлаждения
|
| Охлаждающие |
|
|
| Охлаждающие |
| ||
|
| системы |
|
|
|
| системы |
|
|
Показатели |
| водоснабжения |
| Показатели |
| водоснабжения |
| ||
|
| Прямоточ | Оборот- |
|
|
| Прямо- | Оборот- |
|
|
| ного | ного |
|
|
| точного | ного |
|
Содержание, мг/л |
|
|
|
| SO2- | 680 | 200 |
| |
А1 3+ |
| — | 0,1 |
| Si02 |
| 50 | 50 |
|
Мn 2+ |
| — | 0,5 |
| Жесткость | 16 | 2,6 |
| |
|
|
|
|
| общая мг-экв/л |
|
|
|
|
Са 2+ |
| 200 | 50 |
| Щелочность |
| 10 | 0,4 |
|
|
|
|
|
| общая, мг-экв/л |
|
|
|
|
Mg2+ |
| — | 500 |
| Солесодержание | 1000 | 500 |
| |
|
|
|
|
| мг/л . |
|
|
|
|
Сl- |
| 600 | 24 |
| рH |
| 5-8,3 | 6,5-8,5 |
|
Для охлаждения действующих агрегатов, например конденсаторов паровых турбин тепловых электростанций, холодильников доменных и мартеновских печей и т. д. Эта вода должна быть освобождена от избытка взвешенных веществ, которые, осаждаясь, засоряют охлаждающие устройства. Содержание взвеси в воде, направляемой в холодильники на металлургических заводах, должно отвечать более строгим требованиям, которые дифференцируются в зависимости от типа холодильника. Отложение взвеси в холодильниках приводит к их засорению, снижению теплопередачи и прогоранию. Это может привести к недовыплавке металла из-за простоев, связанных с ремонтом холодильников. Взвесь загрязняет также трубки конденсаторов паровых турбин тепловых электростанций и сопла брызгальных бассейнов для охлаждения воды.
Используемая для охлаждения жидких и конденсации газообразных продуктов в теплообменных аппаратах и для охлаждения оборудования вода не должна создавать механических и солевых отложений, коррозии металла и биологических обрастаний теплообменного оборудования; не должна разрушать конструктивные материалы сооружений систем водоснабжения.
При использовании жесткой воды на стенках паровых котлов образуется твердая накипь, что приводит к снижению теплопроводности стенок и перерасходу топлива. Присутствие в воде растворенного кислорода и углекислоты служит основной причиной коррозии стали. В паровых котлах вследствие высокой температуры воды явления коррозии усиливаются. Реакция питательной воды для котлов должна быть слабощелочной, так как кислая вода вызывает коррозию
Для питания котлов. Вода должна быть в большей или меньшей степени (в зависимости от типа котлов) освобождена от взвеси, солей жесткости и растворенного кислорода. Питательная вода для современных котлов высокого давления (барабанных и прямоточных) должна быть полностью умягчена, обескремнена, обескислорожена; она должна иметь минимальный плотный остаток.
156

Для очистки выпускаемого продукта, например для протравления стали, очистки текстиля, пищевых продуктов и т. д., когда вода подлежит той или иной предварительной обработке в зависимости от ее технологического назначения.
Для перемещения материала. Вода используется, например, в бумажной промышленности для транспортирования сырой бумажной массы в виде водной суспензии к бумажной материи.
Как составная часть выпускаемой продукции, например на консервных заводах, в
производстве пива и т. д. Для этих предприятий вода подвергается такой же тщательной очистке, как и в городских водопроводах.
Для устранения промышленных отбросов, например для разбавления и нейтрализации израсходованных кислот и щелочей. Качество воды, применяемой для этих целей, не имеет существенного значения.
В зависимости от изменения качества воды в процессе ее использования оборотное водоснабжение подразделяется на:
«чистые циклы» — для воды, которая при использовании только нагревается;
«грязные циклы»- для воды, которая только загрязняется;
«смешанные циклы»- для воды, которая при использовании одновременно и нагревается, и загрязняется.
Для промышленных предприятий 1-й группы техническая вода регламентируется предельной температурой используемой воды. Оптимальное значение около 150С.
Вода, используемая как среда для отмывания и гидротранспортировки материалов, освобождается только от грубодисперсной смеси. Это относится к потребителям 2-й группы.
Для потребителей 3-й группы вода должна быть химически очищенной и общее содержание солей в ней не должно превышать 100…2000 мг/кг в зависимости от давления вырабатываемого пара.
Практически все потребители технической воды не предъявляют особых требований к ее цвету, запаху, привкусу и содержанию бактерий.
Для тушения пожаров и внутренних возгораний используется вода практически любого качества.
Так, для подпитки охлаждающих систем оборотного водоснабжения вместо речных вод можно использовать биологически очищенные сточные воды с доочисткой их на фильтрах с зернистой загрузкой, иногда с применением коагулянтов. Нормативы качества воды, используемой для охлаждения, приведены таблице 4.12.
Таблица 4.12. Нормативы качества воды, используемой для охлаждения
| Показатели |
|
|
| Размерность |
|
| Охлаждающие системы |
| |
|
|
|
|
|
|
| ||||
|
|
|
|
|
|
|
| водоснабжения |
| |
|
|
|
|
|
|
|
| Прямоточного | Оборотного |
|
| А1 3+ |
|
|
| мг/л |
| — | 0,1 |
| |
| Мn 2+ |
|
|
| мг/л |
|
| — | 0,5 |
|
|
| 157 |
|
|
|
| ||||

Са 2+ | мг/л | 200 | 50 |
Mg2+ | мг/л | — | 500 |
Сl- | мг/л | 600 | 24 |
SO2- | мг/л | 680 | 200 |
Si02 | мг/л | 50 | 50 |
Жесткость общая | мг-экв/л | 16 | 2,6 |
Щелочность общая | мг-экв/л | 10 | 0,4 |
Солесодержание | мг/л | 1000 | 500 |
рH | — | 5-8,3 | 6,5-8,5 |
В системах оборотного водоснабжения карбонатная жесткость воды, используемой как хладоноситель, не должна превышать Жк 2,8…3,0 мг-экв/л, а допустимая концентрация взвеси принимается в зависимости от скорости движения воды в охлаждающих аппаратах. Эти потребители не допускают повышения содержания показателей приведенных в таблице
4.13
Таблица 4.13. Нормативы качества воды, используемой для охлаждения
| Показатели |
|
| Размерность |
|
| Содержание |
|
|
|
|
|
|
| |||
|
|
|
|
|
|
|
|
|
| механических |
|
| мг/л |
|
| Не более 50…100 |
|
|
|
|
|
|
| |||
| примесей |
|
|
|
|
| ||
|
|
|
|
|
|
|
| |
| сульфатов |
|
| мг/л |
|
| Не более 40 мг/л |
|
|
|
|
|
|
|
|
| |
|
|
|
|
|
|
|
|
|
| сероводорода |
|
| мг/л |
|
| Не более 0,5 |
|
|
|
|
|
|
|
|
| |
|
|
|
|
|
|
|
|
|
| масла |
|
| мг/л |
|
| Не более 1…2 |
|
|
|
|
|
|
|
|
| |
|
|
|
|
|
|
|
|
|
| кислорода |
|
| мг/л |
|
| Не более 4…6 |
|
|
|
|
|
|
|
|
| |
|
|
|
|
|
|
|
|
|
| сухого остатка |
|
| мг/кг |
|
| Не более 1000 |
|
|
|
|
|
|
|
|
| |
|
|
|
|
|
|
|
|
|
Охлаждающая вода не должна содержать сероводорода и железа и должна обладать карбонатной жесткостью, не превышающей 2-7 мг-экв/l.
4.2.3. Требования к качеству технологической воды
Воду, применяемую для очистки выпускаемого продукта, а также как средство перемещения материала, подвергают различной обработке в зависимости от технологии производства. В кожевенном производстве жесткая вода вызывает перерасход дубильных веществ, в текстильном — понижает качество тканей, делая их грубыми, и затрудняет их окраску. Ряду производств, например отбельно-красильным фабрикам, нужна вода с низкой цветностью. Содержание в воде железа недопустимо при производстве целлюлозы и особенно вискозы, так как вызывает появление желтых ржавых пятен на выпускаемой продукции. Еще более высокие требования предъявляются к воде, используемой в некоторых химических производствах. Так, при изготовлении люминофоров и полупроводников общее содержание солей (в воде не должно превышать 0,2 мг/л, в том числе железа не более 0,05 мг/л).
Цементные заводы. Вода в производстве расходуется на охлаждение оборудования (компрессоров, подшипников вращающихся печей, мельниц), приготовление шлама, охлаждение клинкера в холодильнике, охлаждение отходящих газов, а также на нужды
158
котельной и поливку территории. Система водоснабжения – оборотная и с повторным использованием сточных вод.
Известковые заводы. В производстве вода используется для охлаждения цилиндров компрессоров, подшипников агрегатов, балок печей, очистки аспирационного воздуха в циклонах. При мокром способе производства извести вода расходуется также на приготовление шлама. В производстве известняковой муки вода используется только для охлаждения подшипников шахтных мельниц. Система водоснабжения прямоточная и оборотная. К воде, используемой для технологических нужд (приготовление шлама), специальные требования не предъявляются.
Заводы гипса. Вода в производстве гипса расходуется только на охлаждение компрессоров и подшипников шахтных мельниц. Система водоснабжения – оборотная и прямоточная.
Предприятия силикатного (автоклавного) бетона. Вода расходуется на приготовление бетона, алюминиевой суспензии, отделку изделий, мокрое пылеулавливание, охлаждение конденсата и оборудования и другие цели.
Система водоснабжения – оборотная и прямоточная. Имеются три водопроводные сети: оборотной, свежей технической и питьевой воды.
Предприятия силикатного кирпича. Вода в производстве кирпича расходуется на приготовление технологического пара и силикатной массы, охлаждение оборудования, мокрую очистку аспирационного воздуха и другие цели. Система водоснабжения – оборотная и прямоточная.
159
2. Общая щелочность воды
Общая щелочность воды обусловлена суммой содержащихся в воде ионов HCO3–, CO32–, OH– и других солей слабых кислот, вступающих в реакцию с сильным. Щелочность, обусловленная присутствием сильных оснований (гидратов), называется гидратной. Щелочность, обусловленная присутствием ионов HCO3–, CO32–, называется бикарбонатной или карбонатной. Для природных вод характерна бикарбонатная щелочность. Щелочность выражается в мг-экв/л. Практически щелочность природных вод соответствует концентрации гидрокарбонатных ионов HCO3–, если в воде отсутствуют карбонаты CO32–.
Определение общей щелочности основано на реакции образования нейтральных солей при титровании воды соляной кислотой. Ионы оттитровывают соляной кислотой в присутствии индикатора фенолфталеина, они обуславливают щелочность воды по фенолфталеину. При этом протекают следующие реакции:
| . . |
Ион HCO3– оттитровывают соляной кислотой в присутствии индикатора метилоранжа. При этом происходит реакция
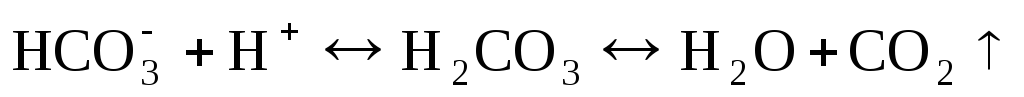 .
.
Если щелочность по фенолфталеину равна нулю, то общая щелочность обусловлена только HCO3– и равна карбонатной жесткости, так как в природных водах ионы HCO3– связаны только с ионами Са2+ и Mg2+.
Ход определения. К 100 мл исследуемой воды, отмеренной цилиндром в коническую колбу, приливают 2–3 капли фенолфталеина. Если окраска не появилась, то в ту же колбу добавляют 2–3 капли метилоранжа и титруют 0,1 н – раствором соляной кислоты до перехода окраски из соломенно-желтой в оранжевую. Если же окраска по ф/ф появилась, то раствор надо оттитровать соляной кислотой 0,1 н до исчезновения окраски и затем уже ввести индикатор метилоранж. Суммарное количество кислоты, пошедшее на титрование и есть общая щелочность воды. Титрование нужно вести на белом фоне. Общую щелочность воды находят по формуле:
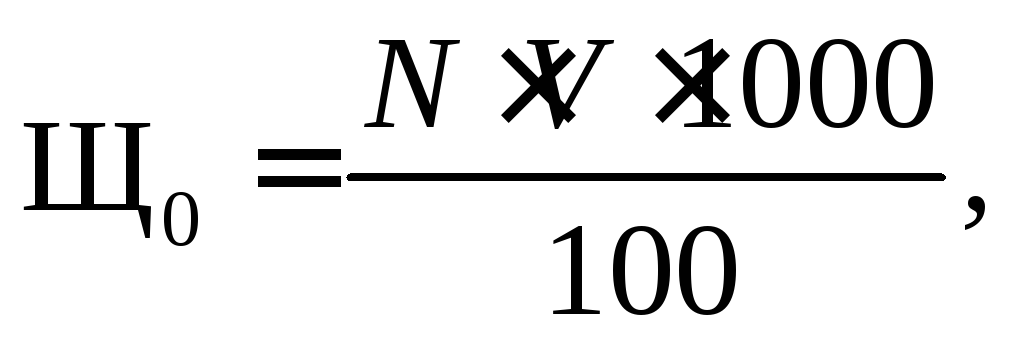 мг-экв/л, (1.1)
мг-экв/л, (1.1)
где V – количество кислоты, израсходованной на титрование 1000 мл воды, мл;
N – нормальность раствора кислоты.
3. Общая жесткость воды
Жесткостью воды называется суммарная концентрация в ней ионов кальция и магния, выраженная в мг-экв/л. Различают жесткость общую, карбонатную и некарбонатную. Карбонатной жесткостью называют часть общей жесткости, обусловленную содержанием в воде бикарбонатов кальция и магния. Некарбонатная жесткость обусловлена содержанием в воде, главным образом, сульфатов и хлоридов кальция и магния. Общая жесткость подразделяется на кальциевую и магниевую. Общая жесткость воды определяют комплексонометрическим методом. Метод основан на способности реактива (трилона Б) образовывать с ионами кальция и магния устойчивые комплексные соединения. Индикатор хромоген черный образует с ионами кальция и магния малодиссоциированный комплекс розово-малинового цвета, а в их отсутствие окрашен в голубой цвет с зеленоватым оттенком.
Соединения кальция и магния с индикаторами более диссоциированы, чем комплексы их с трилонами Б, поэтому при добавлении трилона Б магний и кальций из комплексов с хромогеном переходят в соединении с трилоном. Окраска раствора становится голубой. Индикатор меняет свою окраску и от рН среды, поэтому в титруемый раствор добавляют буферную смесь из NH4Cl + NH4OH, поддерживающую постоянное значение рН ~ 10.
Ход определения. В колбу на 250 мл наливают 100 мл воды, добавляют 5 мл аммиачного буферного раствора с рН 10 и 5–10 кристаллов сухого индикатора хромогена черного. Содержимое колбы тщательно перемешивают до появления розово-малинового цвета. Титрование проводят медленно 0,1 н раствором трилона Б при интенсивном перемешивании до появления сине-голубого окрашивания.
Общая жесткость воды рассчитывается по формуле:
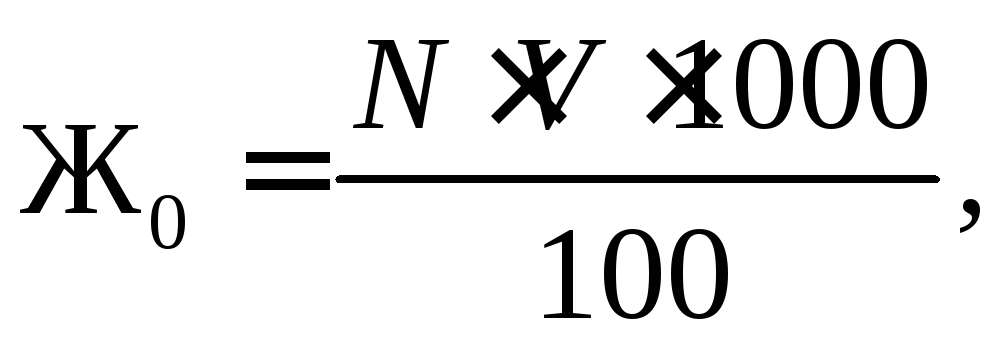 мг-экв/л, (1.2)
мг-экв/л, (1.2)
где V – количество раствора трилона Б, израсходованного на титрование, мл;
N – нормальность раствора трилона Б.
а) определение кальциевой жесткости
В коническую колбу емкостью 250 мл вносят 100 мл исследуемой воды. Затем прибавляют 2 мл 2н раствора NaOH, на кончике ложечки вносят в колбу немного сухого индикатора мурексида и медленно титруют 0,1н раствором трилона Б при энергичном перемешивании до перехода окраски от красной до лиловой.
Расчет содержания иона Ca2+ в воде производится по формуле:
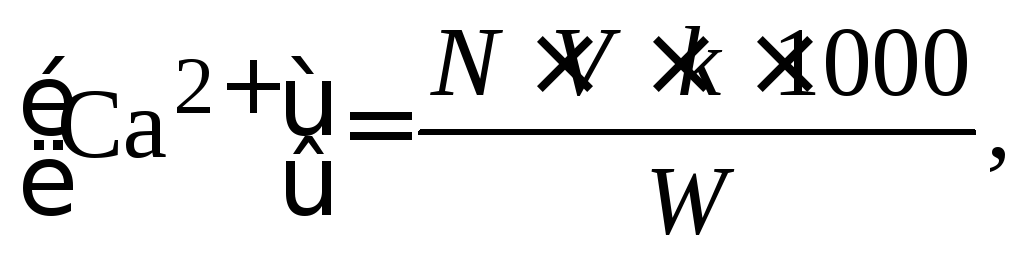 (1.3)
(1.3)
где V – количество раствора трилона Б в мл, израсходованное на титрование;
k – поправочный коэффициент к титру раствора трилона Б; N – нормальность раствора трилона Б; W – объем исследуемой воды в мл, взятой для анализа.
б) определение магниевой жесткости
Магний [Mg2+] определяется методом расчета с использование результатов титрования при определении общей жесткости и кальциевой комплексонометрическим методом с трилоном Б.
Содержание ионов магния Mg2+ в мг-л вычисляются по формуле:
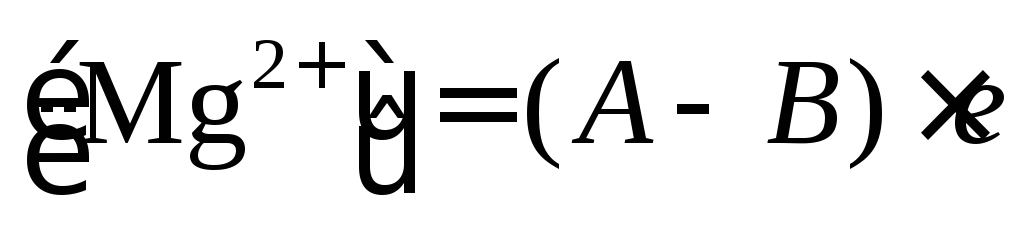 ,
мг/л, (1.4)
,
мг/л, (1.4)
где А – общая жесткость воды, мг-экв/л; В – кальциевая жесткость воды, мг-экв/л; е – эквивалент магния, мг/л.
Тема №3: основные показатели качества воды
Характеристика природных вод.
Природная вода всегда содержит некоторое количество различных примесей.
Различают следующие виды природных вод:
Атмосферная – содержит кислород О2, азот N2, углекислый газ СО2, а в промышленных центрах пыль и другие загрязняющие вещества.
Подземная вода почти всегда прозрачна, свободна от взвешенных частиц, но содержит растворенные минеральные соли, характер которых зависит от того, какие подпочвенные слои вода омывала.
Поверхностные воды содержат минеральные и органические вещества, химический состав их не постоянный и зависит:
1)от химического состава питающего водоема поверхностных вод,
2)от времени года – зимой жесткость воды повышается, летом – уменьшается.
3)от количества атмосферных осадков (чем больше осадков, тем меньше жесткость)
Солесодержание от 200 до 1500 мг/кг. Солесодержание морских вод доходит до 15000-20000 мг/кг, а вода океанов имеет концентрацию различных солей около 35000 мг/кг.
Физические свойства воды.
Вода – прозрачная жидкость без цвета, запаха и вкуса.
Температура кипения = 100˚С, температура замерзания = 0˚С. При +4˚С вода имеет максимальную плотность.
Примеси в природной воде могут находиться в трех состояниях:
А) истинно-растворенном (диаметр частиц менее 1нм- нанометр=1/млн мм)
Б) коллоидно-растворенном (диаметр частиц от 1 до 100 нм)
В) грубодисперсном (диаметр частиц более 100 нм)
Основные показатели качества воды.
Совокупность свойств воды, обусловленная содержанием в ней примесей органического и минерального происхождения называется качеством воды.
Основными показателями качества природных вод являются: жесткость, щелочность, сухой остаток, окисляемость, прозрачность и др.
1.Прозрачность выражается в сантиметрах высоты столба воды, налитой в специальный стеклянный цилиндр, сквозь который еще возможно чтение стандартного шрифта (прозрачность по шрифту) или наблюдение крестообразно расположенных черных полосок толщиной 1мм на белом матовом фоне на дне цилиндра (прозрачность по кресту). Прозрачность приблизительно характеризует концентрацию взвешенных веществ.
2.Жесткость
воды –
суммарное содержание в воде катионов
кальция 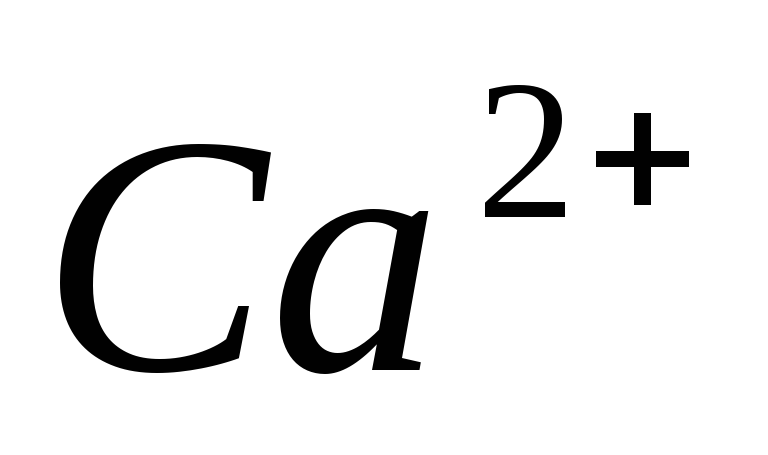 и
магния
и
магния 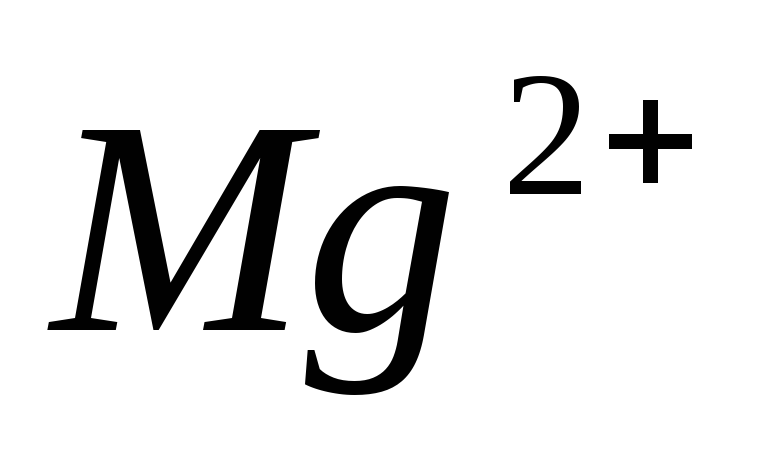 ,
выраженное в мг-экв/кг или мкг-экв/кг.
,
выраженное в мг-экв/кг или мкг-экв/кг.
1мг-экв/кг=1000мкг-экв/кг
Различают карбонатную (временную), некарбонатную (постоянную) и общую жесткость.
Карбонатная (временная) жесткость характеризуется присутствием в воде бикарбонатов кальция Ca(HCO3)2 и магния Mg(HCO3)2.
Эти соли при нагревании или кипячении воды в открытом сосуде распадаются, превращаясь в слаборастворимые соли – карбонат кальция СаСО3 и гидрат окиси магния Mg(OH)2, выпадающие в осадок.
Некарбонатная жесткость характеризуется содержанием в воде солей кальция и магния, которые удерживаются в ней после кипячения в открытых сосудах. Поэтому она называется постоянной жесткостью.
Солями постоянной жесткости являются:
Сернокислый кальций CaSO4,
сернокислый магний MgSO4,
хлористый кальций CaCl2,
хлористый магний MgCl2
и другие соли кальция и магния.
Общая жесткость воды равна сумме карбонатной (постоянной) и некарбонатной (временной) жесткости
Жо=Жк+Жнк
В зависимости от общей жесткости воды делятся на:
1) мягкие – до 3 мг-экв/кг
2)средние – от 3 до 6 мг-экв/кг
3)жесткие – от 6 до 9 мг-экв/кг
4)очень жесткие – свыше 9 мг-экв/кг
3.Щелочностью
воды называется общее содержание в ней
гидрат-ионов 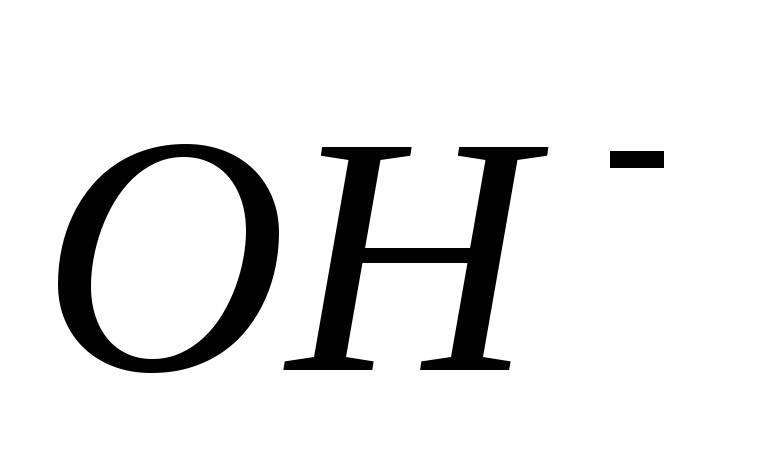 ,
бикарбонат-ионов
,
бикарбонат-ионов 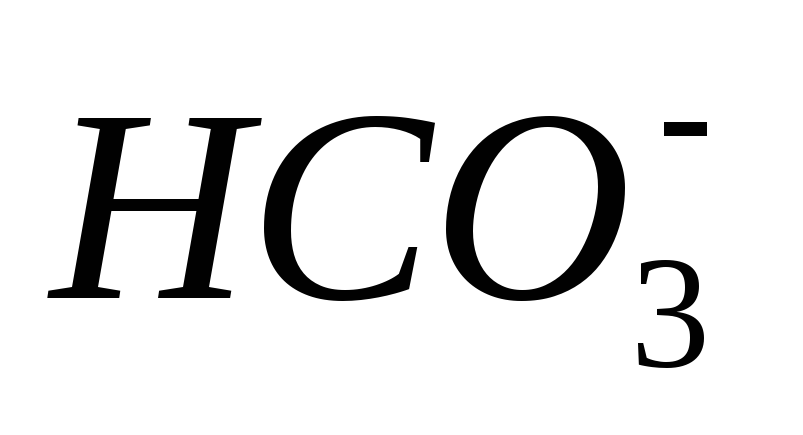 ,
карбонат – ионов
,
карбонат – ионов 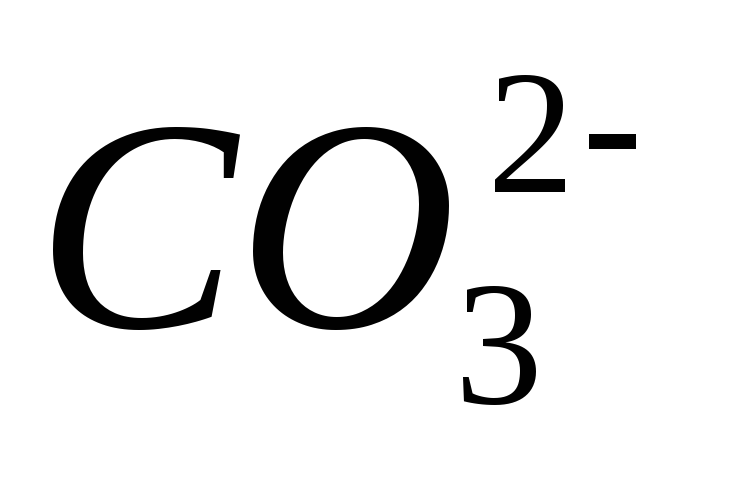 ,
сульфат-ионов
,
сульфат-ионов 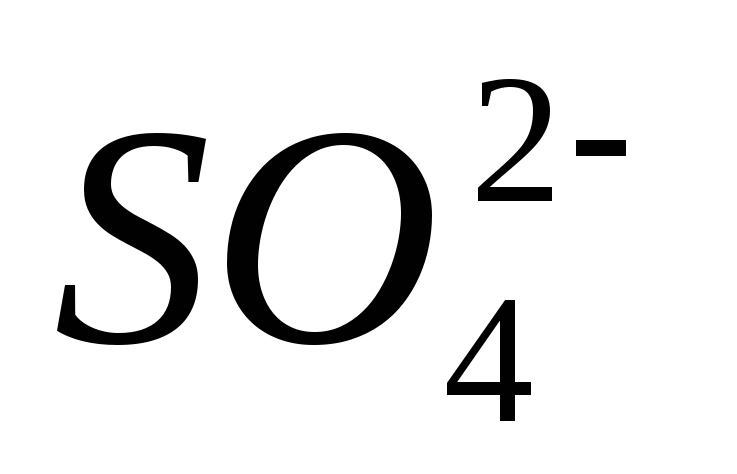 и др.
и др.
В зависимости от того, какой анион присутствует в воде, щелочность называют: бикарбонатной Щб, карбонатной Щк, гидратной Щг.
Единицы измерения: мг-экв/кг
4.Сухим остатком (общим солесодержанием) воды называется суммарное количество нелетучих веществ, присутствующих в воде в коллоидно- и истинно-растворенном состоянии, выраженное в мг/кг.
Сухой остаток определяют путем выпаривания 1л профильтрованной воды и последующего высушивания сухих веществ при температуре 102-110˚С до постоянной массы.
Следовательно, в понятие сухого остатка не входят растворенные в воде газы и взвешенные (грубодисперсные) вещества.
5.Окисляемость воды обычно выражается количеством мг кислорода, необходимых для окисления в определенных условиях органических веществ, содержащихся в 1 кг воды.