Жёсткость воды | Фильтр Сити
О жёсткости воды начали говорить задолго до того, как появились централизованные системы водоснабжения. Жёсткая вода была проблемой древних цивилизациях, но не такой обширной как в современном обществе.
Жёсткость воды является традиционным показателем способности воды реагировать с мылом и другими моющими средствами. Люди стали замечать, что при контакте с мылом в одной воде образуется много пены, а в другой мало.
Если после стирки одежды или ткани они становились:
- Сухими и жёсткими на ощупь — говорили, что вода жёсткая.
- Пушистыми и эластичными — говорили, что вода мягкая.
Сегодня под жесткостью воды понимается совокупность определенных химических и физических свойств воды. Жёсткость или мягкость воды является следствием содержащихся в ней солей главным образом, магния и кальция. Такие соли также называют «соли жёсткости».
Для определения уровня жёсткости водопроводной воды в России используется показатель °Ж (градус жесткости).
- Мягкую воду — до 2 °Ж
- Воду средней жёсткости — от 2 до 10 °Ж
- Жёсткую воду — более 10 °Ж
Согласно действующим в России санитарным правилам и гигиеническим нормативам жёсткость водопроводной воды не должна превышать 7 °Ж.
В других странах мира используются другие единицы измерения жёсткости воды. В инструкции к бытовой технике могут использоваться °DH (Германия), °Clark (Великобритания), °F (Франция), Ppm (США) и другие единицы измерения жёсткости воды.
Используя «калькулятор жесткости» можно перевести °Ж в другие значения жесткости воды и наоборот. Это позволит более эффективно использовать бытовую технику, например, загружать нужное количество стирального порошка в стиральную машину исходя из реального содержания солей кальция и магния в воде.
Максимальное допустимое значение 7 °Ж соответствует:
- 19,6 °DH
- 24,6 °Clark
- 35 °F
- 350,3 Ppm
Чем мягче будет вода, тем меньше моющих средств необходимо добавлять в стиральную машину, моющий пылесос, посудомоечную машину или другую бытовую технику.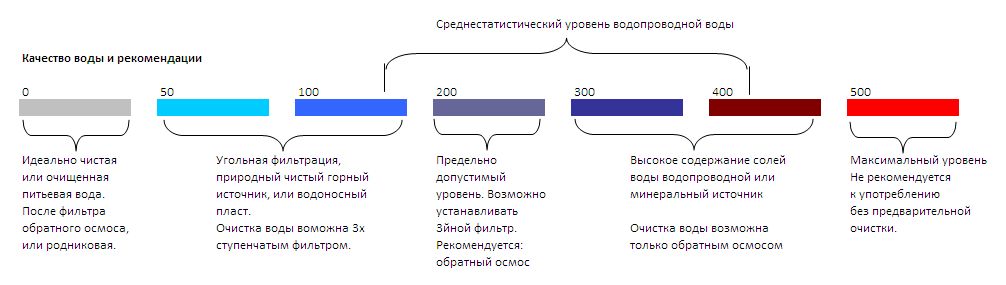
Чем выше будет показатель жёсткости воды, тем быстрее будет образовываться накипь в нагревательных и отопительных приборах. И если очищение накипи в чайнике или кастрюле не вызывает больших проблем, то этого никак нельзя сказать по отношению к твердым отложениям внутри бытовой техники.
Даже при толщине слоя накипи в 1 мм:
- Уменьшается передача теплоты.
- Увеличивается расхода электричества или топлива.
- Образуются трещины и вздутия на нагревающих поверхностях.
Когда жесткая вода нагревается, накипь образуется очень быстро. В тоже время твердые отложения могут образовываться в холодной воде, хотя и не очень быстро. Если такая вода поступает длительное время, уменьшается пропускная способность водопровода и изнашиваются движущиеся части клапанов, насосов или счетчиков воды.
Жёсткая вода вредна для бытовой техники и водопровода, и этот очевидный факт. Существует мнение что жесткая вода оказывает вредное воздействие на организм человека, но это распространенное заблуждение.
Избыточное потребление водопроводной воды в повышенным содержанием кальция, магния и других микроэлементов может быть вредным для здоровья, но как правило только теоретически.
Если вода содержит очень много магния (250 мг/л), ее постоянное потребление оказывает временный слабительный эффект. Обычно организм быстро адаптируется к высокому содержанию магния и его излишек естественным образом выводится.
В водопроводной воде обычно содержится магния до 30 мг/л и кальция до 50 мг/мл. По этому показателю водопроводная вода соответствует бутилированной воде, продающейся в магазинах.
По содержанию магния, вода из-под крана никак не может сравниться с некоторыми лечебными минеральными водами. В одном литре минеральной воды может содержаться более 250 мг магния и/или кальция.
И магний, и кальций являются важными минералами и полезны для здоровья человека. Рекомендуемые суточные нормы потребления микроэлементов составляют:
- Магний 400 мг
- Кальций 1200 мг
Даже если вода является жесткой, она не может быть богатым источником магния, кальция и других полезных для организма микроэлементов.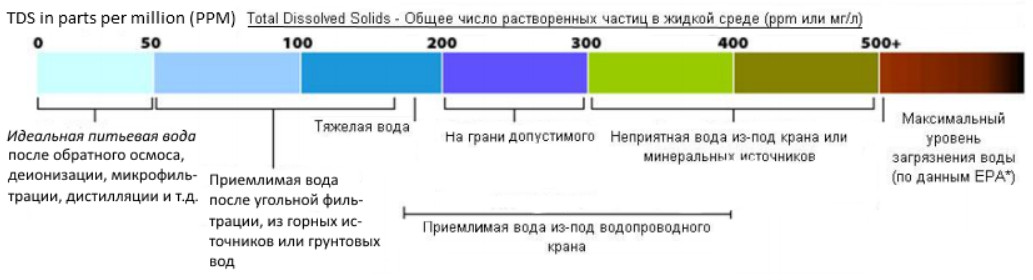
Для очистки воды от солей жесткости используются различные методы и технологии. Некоторые из них известны с древних времен, а другие появились сосем недавно.
Кипячение является самым старым методом умягчения воды. При нагревании воды из нее удаляются соли жесткости и оседают в виде накипи. Интенсивное удаление солей кальция и магния происходит при нагреве воды от 120 до 150 °С.
По сути бойлер, чайник или другие приборы с нагревающимися поверхностями выполнят роль смягчителя воды. Однако вода полностью не очищается от солей жесткости и при это сильно изнашивается бытовая техника.
Современное глубокое умягчение воды выполняется несколькими методами. Как правило все они основаны на использовании:
Бытовые фильтры колбово-картриджного типа снабжены обратноосмотической мембраной. Такие мембраны позволяют эффективно устранять соли жёсткости, бактерии, вирусы, органические и другие примеси.
Поры обратноосмотической мембраны удаляют до 99,9% всех примесей, содержащихся в водопроводной воде. Умягчение воды улучшает ее качество и позволяет продлить жизнь бытовым приборам.
Как правило такие фильтры не занимают много места и легко устанавливаются под мойкой. Недостатком таких фильтров является постепенное очищение воды. Для устранения этого недостатка, фильтры снабжены баком, в котором очищенная вода накапливается.
При выборе модели фильтра необходимо обращать внимание на его производительность и размер накопительного бака. При максимальном потреблении воды, большие накопительные баки (12 литров) способны заполняются очищенной водой до 10 раз в сутки.
Системы водоподготовки засыпного типа содержат ионообменные смолы в качестве наполнителя. Частички смолы задерживают ионы кальция и магния и способны очистить даже самую жесткую воду.
После очистки определенного количества воды, ионообменные смолы нуждаются в восстановлении. Для этого используются регенерирующий агенты, например, на основе поваренной соли.
Автоматические установки умягчения воды способны сами определить оставшийся ресурс наполнителя и в случае необходимости запустить процесс регенерации. Ионообменные смолы восстанавливаются без или с минимальным участием человека.
Установки умягчения воды среднего размера (345x1450x360 мм) способны за один час очистить 1-2 м³ воды. Большие установки умягчают воду в промышленных масштабах.
Системы водоподготовки засыпного типа идеально подходят для установки в:
- Коттеджах или частных домах
- Заведениях общественного питания
- Офисах и небольших предприятиях
- Учебно-образовательных и медицинских центрах
При выборе систем умягчения воды следует обращать внимание на их размеры и производительность. Если вода нуждается в дополнительной обработке, следует выбирать установки, выполняющие несколько методов очистки.
Кроме удаления из воды солей жесткости, бытовые умягчители засыпного типа регулируют кислотность, удаляют механические примеси и производят обезжелезивание воды.
Перед тем как окончательно определиться с выбором умягчителя воды, рекомендуется сделать анализ воды. Основываясь на результатах анализа воды можно будет приобрести систему очистки, которая лучше всего подойдет именно для Вас.
МУП Новгородский Водоканал | Что такое жесткость воды и в чем она измеряется?
Очень часто в адрес нашей интернет-приемной поступают вопросы о жесткости воды в нашем городе. В данном материале рассмотрим подробнее, что такое жесткость воды и в чем она измеряется.
Жесткость воды принято связывать с катионами кальция (Са2+) и в меньшей степени магния (Mg2+)
Откуда берётся жёсткость воды? Ионы кальция и магния, а также других щелочноземельных металлов, обуславливающих жесткость, присутствуют во всех минерализованных водах. Их источником являются природные залежи известняков, гипса и доломитов. Ионы кальция и магния поступают в воду в результате взаимодействия растворенного диоксида углерода с минералами и при других процессах растворения и химического выветривания горных пород. Источником этих ионов могут служить также микробиологические процессы, протекающие в почвах на площади водосбора, в донных отложениях, а также сточные воды различных предприятий.
Их источником являются природные залежи известняков, гипса и доломитов. Ионы кальция и магния поступают в воду в результате взаимодействия растворенного диоксида углерода с минералами и при других процессах растворения и химического выветривания горных пород. Источником этих ионов могут служить также микробиологические процессы, протекающие в почвах на площади водосбора, в донных отложениях, а также сточные воды различных предприятий.
В целом, жесткость поверхностных вод, как правило, меньше жесткости вод подземных. Жесткость поверхностных вод подвержена заметным сезонным колебаниям, достигая обычно наибольшего значения в конце зимы и наименьшего в период половодья, когда обильно разбавляется мягкой дождевой и талой водой. Морская и океанская вода имеют очень высокую жесткость.
В мировой практике используется несколько единиц измерения жесткости, все они определенным образом соотносятся друг с другом.
С 1 января 2014 года в России введен межгосударственный стандарт ГОСТ 31865-2012 «Вода. Единица жесткости». По новому ГОСТу жесткость выражается в градусах жесткости (°Ж). 1 °Ж соответствует концентрации щелочноземельного элемента, численно равной 1/2 его миллимоля на литр (1 °Ж = 1 мг-экв/л). В разных странах использовались (иногда используются до сих пор) различные внесистемные единицы — градусы жёсткости.
Единица жесткости». По новому ГОСТу жесткость выражается в градусах жесткости (°Ж). 1 °Ж соответствует концентрации щелочноземельного элемента, численно равной 1/2 его миллимоля на литр (1 °Ж = 1 мг-экв/л). В разных странах использовались (иногда используются до сих пор) различные внесистемные единицы — градусы жёсткости.
Жесткость водопроводной воды в Великом Новгороде составляет от 1,7 до 2,5 градусов жесткости.
С точки зрения применения воды для питьевых нужд, ее приемлемость по степени жесткости может существенно варьироваться в зависимости от местных условий. Порог вкуса для иона кальция лежит (в пересчете на мг-эквивалент) в диапазоне 2—6 мг-экв/л, в зависимости от соответствующего аниона, а порог вкуса для магния и того ниже. Высокая жесткость ухудшает органолептические свойства воды, придавая ей горьковатый вкус и оказывая отрицательное действие на органы пищеварения
Нормативные требования и рекомендации
Рекомендации всемирной организации здравоохранения (ВОЗ) для питьевой воды: кальций – 20-80 мг/л; магний – 10-30 мг/л. Для жесткости какой-либо рекомендуемой величины не предлагается.
Для жесткости какой-либо рекомендуемой величины не предлагается.
Российские нормативные документы (СанПиН 2.1.4.1074-01 и ГН 2.1.5.1315-03) для питьевой воды регламентируют: кальций – норматив не установлен; магний – не более 50 мг/л; жесткость — не более 7°Ж.
Норматив физиологической полноценности бутилированной воды (СанПиН 2.1.4.1116-02): кальций – 25-130 мг/л; магний – 5-65 мг/л; жесткость – 1,5-7°Ж.
При установке и запуске бытовой водонагревательной техники иностранного производства требуется информация о жесткости воды. Для перевода значения жесткости к единицам измерения страны-производителя техники ниже приведена таблица перевода значений жесткости:
Страна | Россия | Германия | Великобритания | Франция | США |
Единица измерения жесткости | 1°Ж | 1°dH | 1°e | 1°TH | 1ppm |
Коэффициент перевода значений жесткости из °Ж в единицы измерения жесткости других стран (*) | 1 | 0,3566 | 0,2848 | 0,1998 | 0,0200 |
(*) – для перевода в другие единицы измерения необходимо значение жесткости, выраженное в °Ж, умножить на соответствующий коэффициент из приведенной выше таблицы.
Жесткость воды колеблется в широких пределах и существует множество типов классификаций воды по степени ее жесткости. Ниже в таблице приведены целых четыре примера классификации. Две классификации из российских источников — из справочника «Гидрохимические показатели состояния окружающей среды» и учебника для вузов «Водоподготовка». A две — из иностранных: нормы жесткости немецкого института стандартизации (DIN 19643) и классификация, принятая Агентством по охране окружающей среды США (USEPA).Жесткость воды колеблется в широких пределах и существует множество типов классификаций воды по степени ее жесткости. Ниже в таблице приведены целых четыре примера классификации. Две классификации из российских источников — из справочника «Гидрохимические показатели состояния окружающей среды» и учебника для вузов «Водоподготовка». A две — из иностранных: нормы жесткости немецкого института стандартизации (DIN 19643) и классификация, принятая Агентством по охране окружающей среды США (USEPA).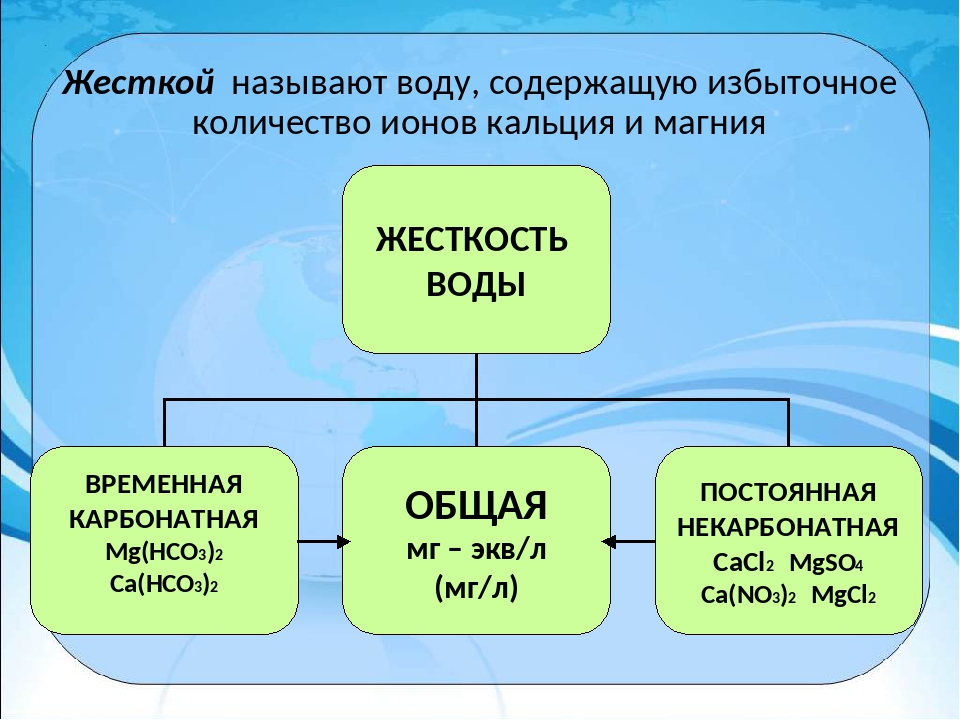
Жесткость общая | Cоли (ионы) кальция и магния, химия жесткости воды
Жесткость – определенные свойства воды, обусловленные концентрацией растворимых солей (ионов) кальция и магния.
Жесткость связывают прежде всего с катионами (положительными ионами) кальция (Са2+) и магния (Mg2+). На самом деле, все двухвалентные положительные ионы (например, металлы) в разной степени оказывают влияние на жесткость воды. Взаимодействуя с анионами, они образуют химические соединения, способные выпадать в осадок (соли жесткости). К примеру, одновалентные катионы (Na+), не обладают способностью к таким реакциям.
В таблице представлены основные катионы, обуславливающие жесткость, и соответствующие им анионы:
Однако практически стронций, железо и марганец не оказывают значимого влияния на величину жесткости, поэтому ими можно пренебречь. Алюминий (Al3+) и железо в трехвалентной форме (Fe3+) также способны увеличить жесткость, однако при уровнях кислотности рН природных вод они практически нерастворимы, а значит, их влияние мало. Также можно не учитывать и “вклад” бария (Ва2+).
Алюминий (Al3+) и железо в трехвалентной форме (Fe3+) также способны увеличить жесткость, однако при уровнях кислотности рН природных вод они практически нерастворимы, а значит, их влияние мало. Также можно не учитывать и “вклад” бария (Ва2+).
Виды жесткости
Можно выделить следующие виды жесткости:
Общая жесткость. Обусловлена суммарным содержанием катионов кальция и магния. Является суммой двух других видов жесткости: карбонатной (временной) и некарбонатной (постоянной).
Карбонатная жесткость. Характеризуется наличием карбонатов и гидрокарбонатов кальция и магния при уровне кислотности рН>8.3. Такая жесткость устраняется при нагреве и кипячении воды, а потому носит название временной. Нагревание воды вызывает распад гидрокарбонатов на угольную кислоту и осадок в виде карбоната кальция или гидроксида магния.
Некарбонатная жесткость. Определяется наличием солей сильных кислот на основе кальция и магния (серной, азотной, соляной). Такой тип жесткости называется постоянным, так как не устраняется при кипячении.
Такой тип жесткости называется постоянным, так как не устраняется при кипячении.
Единицы измерения
Существует несколько единиц измерения жесткости, которые можно перевести друг в друга. Так, в России в основном применяется единица моль на кубический метр (моль/м3), которая идентична значению мг-экв/л. Также в мировой практике получили распространение такие единицы измерения жесткости: американский градус, ppm CaCO3, французский градус (fo), немецкий градус (do, dH). В таблице показано соотношения этих единиц между собой:
Градус жесткости — Справочник химика 21
Прежде жесткость было принято выражать в особых условных единицах, называемых градусами жесткости . В настоящее время в СССР введено выражение жесткости 4uj aom миллиграмм-эквивалентов растворимых солей кальция и магния в 1 л воды. [c.304] Градус жесткости (°Ж)—единица измерения жесткости воды, соответствующая содержанию 0,01 г СаО в 1 л воды. [c.259]
[c.259]
При расчете ионитовых фильтров содержание отдельных катионов и анионов обычно выражают величиной, эквивалентной градусам жесткости.. [c.28]
До 1952 года жесткость воды измерялась градусами жесткости, показывающими, сколько граммов СаО содержится в 100 л воды (содержание магния и других двухвалентных металлов пересчитывалось на эквивалентное содержание оксида кальция). В настояшее время в РФ жесткость воды принято выражать суммой мг-экп ионов Са2+ и Mg2+, содержащихся в I л воды. I мг-экв жесткости отвечает содержанию 20.04 мг/л Са2+ или 12.16 мг/л Mg2+. I градус жесткости равен 0.357 мг-экв ионов кальция или магния. [c.186]
Жесткость воды раньше выражали в градусах. Немецкий градус жесткости соответствует содержанию 1 г окиси кальция в 100 л воды, французский — содержанию 1 е углекислого кальция в 100 л воды. [c.339]
Такой способ выражения жесткости воды соответствует истинному состоянию этих элементов в водном растворе. До 1952 г. в СССР было принято выражать жесткость воды в условных единицах, так называемых градусах жесткости, причем 1 градус соответствует 0,357 мг-экв/л. В других странах сейчас еще при- [c.66]
До 1952 г. в СССР было принято выражать жесткость воды в условных единицах, так называемых градусах жесткости, причем 1 градус соответствует 0,357 мг-экв/л. В других странах сейчас еще при- [c.66]
Степень жесткости воды количественно выражается числом мг-экв в основном ионов Са + и Mg +, а также и других ионов, обусловливающих жесткость воды, вместе взятых на 1 л воды . Эту меру можно назвать советским градусом жесткости. [c.194]
Жесткость воды принято выражать в градусах. Один градус жесткости отвечает 0,337 мг-экв/л, что в пересчете на СаО и MgO составляет 10 и 7,2 мг/л соответственно. [c.48]
До 1952 г. в СССР для оценки жесткости природных вод применялись так называемые градусы жесткости, которые определялись числом граммов СаО в 100 л природной воды. Один градус по этой шкале соответствовал 1 г СаО в 100 л воды или 0,01 г СаО в 1 л. Позже в СССР введен новый стандарт определения жесткости (ГОСТ 6055—51). Согласно этому стандарту, 1) Жесткостью воды называется содержание в ней растворимых солей кальция и магния, выраженное в миллиграмм-эквивалентах а литр воды. 2) Один миллиграмм-эквивалент жесткости отвечает содержанию 20,04 мг/л Са++ или 12,16 мг/л Mg++. 3) Для измерения малых жесткостей принимается тысячная доля миллиграмм-эквива-лента — микрограмм-эквивалент в литре воды . [c.177]
Согласно этому стандарту, 1) Жесткостью воды называется содержание в ней растворимых солей кальция и магния, выраженное в миллиграмм-эквивалентах а литр воды. 2) Один миллиграмм-эквивалент жесткости отвечает содержанию 20,04 мг/л Са++ или 12,16 мг/л Mg++. 3) Для измерения малых жесткостей принимается тысячная доля миллиграмм-эквива-лента — микрограмм-эквивалент в литре воды . [c.177]
Природная вода имеет 10 градусов жесткости (по старой шкале). Выразить ее в новых единицах жесткости (по новой шкале) — в мг-экв/л. [c.187]
Для перехода от градусов жесткости к выражению жесткости в мг-экв л надо число градусов умножить на 0,357. Например, если жесткость воды равна 10°, то в мг-экв л она составит 10-0,357=3,57 лжесткость воды, равная 3,57 мг-экв л, будет соответствовать 3,57.2,8=10° (см. задачу 1 на стр. 324). [c.302]
Решение. Один градус жесткости по старой шкале соответствует содержанию 1 г СаО в 100 л воды. Следовательно, 10 градусов жесткости соответствуют 10 г СаО в 100 л, а в 1 содержится 10 100= =0,1 г или 100 мг СаО. [c.325]
Следовательно, 10 градусов жесткости соответствуют 10 г СаО в 100 л, а в 1 содержится 10 100= =0,1 г или 100 мг СаО. [c.325]
Напомним, что жесткость воды принято измерять в градусах. Одному градусу жесткости соответствует содержание двухзарядных катионов, в количестве 1 ммоль (0,5 Са=+ или 0,5 Мд=+) на 1 л воды. [c.89]
Пример 2. При определении жесткости воды получены следующие результаты Xi (в градусах жесткости) для 10 параллельных проб [c.101]
До 1951 г. жесткость воды характеризовали в градусах жесткости. 1 град жесткости соответствовал содержанию 10 мг СаО или 7,19 жг MgO в 1 воды. Например, если содержание всех солей кальция и магния в 1 л воды эквивалентно 30 мг СаО, то жесткость воды будет составлять 3 градуса жесткости. [c.316]
Для пересчета градусов жесткости в мг-экв/л составляем следующее соотношение [c.316]
Сравнение градусов жесткости [c. 339]
339]
Наименование единиц мг-эке/л мкг-зкв/л Градус жесткости [c.339]
До 1952 г. в СССР и в некоторых других странах применялись градусы жесткости. За границей градусами жесткости пользуются и до настоящего времени. 1 мг-экв/л соответствует 2,804 немецкого градуса, 5,005 — французского, 3,511—английского, 50,045— американского. [c.250]
Жесткость воды выражают в градусах. Каждому градусу жесткости, принятому в СССР, соответствует содержание СаО в количестве 10 мг/л или эквивалентное ему количество MgO — 7,1 мг/л. В СССР при оценке жесткости воды в градусах считают воду, имеющую жесткость меньще 10°, мягкой от 10 до 20° — средней жесткости от 20 до 30° —жесткой выще 30° — очень жесткой. [c.163]
До 1952 г. жесткость воды в СССР измерялась градусами жесткости, показывающими, сколько граммов окиси кальция содержится в 100 воды, причем содержание магния и других двухвалентных металлов пересчитывалось на эквивалентное количество СаО. В переводе на современные единицы жесткости 1 градус жесткости равняется 0,357 мг-экв ионов кальция или магния. [c.239]
В переводе на современные единицы жесткости 1 градус жесткости равняется 0,357 мг-экв ионов кальция или магния. [c.239]
В СССР Ж. в. выражают в ммоль экв/л карбонатная жесткость отвечает той части катионов Са и Mg , к-рая эквивалентна содержащимся в воде анионам H O , некарбонатная-аннонам SO , NO3 и до. (1 ммоль экв/л соответствует 20,04 мг/л катионов Са или 12,16 мг/л катионов Mg ). В др. странах для выражения Ж в. часто используют т. наз. градусы жесткости. Напр., 1° жесткости немецкий, соответствующий 0,01 г СаО в 1 л воды, равен 0,357 ммоль экв/л. [c.145]
По оценке качества воды в градусах жесткости образец воды содержит 10° временной и 10° постоянной жесткости (1° жесткости соответствует 10 мг СаО в 1 л воды). Жесткость вызвана только катионами Fe » [c.177]
Выразим это содержание РеО в градусах жесткости. В пересчете на РеО 1° жесткости составляет [c.194]
Один градус жесткости соответствует содержанию в воде солей жесткости (главным образом Са и М5) в количестве, эквивалентном 10 мг СаО в 1.1. [c.67]
З.2.1.1. Сравнение градусов жесткости [c.153]
Величину ж.в. выражают в молярных ( экв ) долях в-в на 1 литр воды или мг/дм а также т.н. градусами жесткости (напр., 10 мг СаО в 1 дм воды). Условно воду считают мягкой (до 55 мг/дм СаО), средней жесткости и жесткой (более 275 мг/дм СаО). [c.78]
В других странах жесткость выражают в градусах жесткости. Например, Г жесткости выражает содержание сотых долей грамма окиси кальция в 1 л воды. 1 мг-экв жесткости соответствует 2,8° немецкой шкалы, 3,5° — английской и 5,0° — французской. [c.59]
Результаты определения жесткости выражаются в миллиграмм-эквивалентах на 1 л воды или в немецких градусах жесткости (° Н). Другие единицы измерения, применяемые для выражения жесткости воды, приведены в табл. 8, пользуясь которой можно произвести пересчет. [c.71]
Единицы измерения жесткости воды мг-экв/л Градусы жесткости [c.33]
АНГЛИЙСКИЙ ГРАДУС ЖЕСТКОСТИ, см. Жесткость воды. [c.53]
В СССР до 1951 г. пользовались для измерения жесткости не мецким градусом жесткости, но в 1951 г. установлена новая еди» ница измерения жесткости, выраженная в миллиграмм-эквивален-i тах на литр воды. По ГОСТ 6055—61 1 мг-экв жесткости соответствует содержанию 20,04 мг/л Са + или 12,16 мг/л Mg2+. [c.187]
ЖЕСТКОСТЬ воды — свойство природной воды, обусловленное присутствием в ней растворенных солей кальция и магния. Жесткость воды подразделяется ка карбонатную (временную), обусловленную концентрацией гидрокарбонатов кальция и магния, и некарбонатную (постоянную), обусловленную концентрацией всех других растворенных в воде солей кальция и магния (хлоридов, сульфатов и др.). Суммарное содержание всех солей кальция и магния называется общей жесткостью, которую определяют комплексонометричоским титрованием. Ж. в. можно снизить известковым, содовым, фосфатным, натронным или ионообменным способами, карбонатную Ж. в. — также кипячением. В СССР Ж. в. выражают в миллиграмм-эквивалентах на литр, в некоторых других странах — в т. наз. градусах жесткости. По общепринятой классификации очень мягкая вода в среднем содержит О—1,5 мг-экв/л a или Mg + мягкая [c.96]
И карбонатная, и некарбонатная жесткость воды оценивается суммарным числом содержащихся в одном литре миллиэквиналентов Са и IЛ.g (мэкв/л). За рубежом пользуются условными градусами жесткости , величины которых в отдельных странах ралзичны (1 мэкв/л соответствует 2,8 немецким, 3,5 английским, 5 французским илн 50 американским градусам). [c.394]
Правда, до 1952 г. в СССР жесткость воды оценивалась с помощью так называемых градусов жесткости, которые измерялись числом граммов СаО в 100 л природной воды. При этом все соли кальция и магния пересчитывались на СаО. Один градус по этой шкале соответствовал содёржанию 1 г СаО в 100 л воды или 0,01 г СаО в 1 л. Современная шкала жесткости — в мг-экв л — более рациональна. [c.302]
Жесткость воды обусловливают присутствующие в ней соли кальция и магния. С увеличением их содержания жесткость воды увеличивается. Жесткость воды выражают в милиграмм-эквива-лентах ионов кальция или магния на 1 л (1 дм ) воды (мг-экв/л) (мг-экв/дм ). Жесткость в 1 мг-экв/л соотв ствует содержанию 20,04 мг ионов Са или 12,16 мг ионов Мя в 1 л врцы. Иногда пользуются старым выражением жесткости — в немещсих градусах 1 немецкий градус жесткости соответствует содержанию 10 мг СаО в 1 л воды, то есть 1 мг-экв равен 2,004. [c.259]
Для перевода мс-экв л в градусы жесткости полученную величину жесткости в мг-экв л умножают на 2,8 4,22X2,8=11,8°. [c.262]
Жесткость воды перевод. Единицы измерения жесткости воды
Единицы измерения жесткости воды
Для численного выражения жёсткости воды указывают концентрацию в ней катионов кальция и магния. Рекомендованная единица СИ для измерения концентрации — моль на кубический метр (моль/м3), однако, на практике для измерения жёсткости чаще используется миллимоль на литр (ммоль/л). В России для измерения жёсткости чаще используется нормальная концентрация ионов кальция и магния, выраженная в миллиграмм-эквивалентах на литр (мг-экв/л). Один мг-экв/л соответствует содержанию в литре воды 20,04 миллиграмм Ca2+ или 12,16 миллиграмм Mg2+ (атомная масса делённая на валентность).
В разных странах используются различные внесистемные единицы — градусы жёсткости:
По величине общей жёсткости различают воду мягкую (до 2 мг-экв/л), средней жесткости (2-10 мг-экв/л) и жёсткую (более 10 мг-экв/л). В целом, жесткость поверхностных вод меньше жесткости вод подземных. Жесткость поверхностных вод подвержена заметным сезонным колебаниям, достигая обычно наибольшего значения в конце зимы и наименьшего в период половодья, когда обильно разбавляется мягкой дождевой и талой водой. Морская и океанская вода имеют очень высокую жесткость (десятки и сотни мг-экв/дм3).
Термическое умягчение воды. Химическая прочность и стойкость плохо-растворимых солей жесткости (соли двух валентных катионов в основном кальция (Са2+) и магния (Mg2+)) уменьшается при повышении температуры жидкости. При росте температуры воды до 120-200 °С с большой жесткостью, например, 17 мг экв/л, соли жесткости выпадают в осадок и таким образом, снижается карбонатная жесткость воды в 620-3700 раз. Типичный пример термического умягчения воды чайник, при кипячении жесткой воды образуется накипь, и жесткость воды понижается.
Реагентное умягчение воды. При этом способе очистки воды ионы Ca+2 и Mg+2 связываются различными веществами в нерастворимые соединения. В качестве реагентов для умягчения воды в системах охлаждения двигателей могу быть использованы каустическая сода NaOH, тиофосфат натрия NaPO4 12h3O, хромпик K2CrO7 или Na2CrO7, порошок Трилон Б и т.д.
Безреагентное умягчение воды — магнитное воздействие. Магнитная обработка воды применяется с середины прошлого века. Данный метод очистки воды не умягчает воду, не снижает ее жесткость, а предотвращает выпадение накипи, карбонатных отложений. Данный метод используется, где умягчение воды не является самоцелью. Но данный метод нашел ограниченное применение в водоподготовке и применяется только при водоподготовке технической воды в редких случаях.
Рис. 1 — Ионообменные смолы-ионный обмен
При небольших превышениях жесткости воды применяют натрий — катионитовую смолу или другие разновидности ионообменных смол. При прохождении жесткой воды через катионообменную смолу происходит обмен катионов Ca+2 и Mg+2 на катионы Na+, которые входят в состав смолы, таким образом, катионы Ca+2 и Mg+2 остаются на смоле, а катионы Na+ переходят в умягчаемую воду. Со временем все катионы Na+ обмениваются на катионы жесткости, катионообменная смола теряет способность умягчать воду и ее необходимо регенерировать. Для этого смола промывается раствором поваренной соли NaCl, в результате чего происходит процесс, обратный умягчению: катионы натрия переходят в состав смолы, при этом вытесняя катионы кальция и магния в промывную воду, сливаемую в дренаж (канализацию). После этого обогащенная натрием смола становиться вновь готовой к умягчению.
Рис. 2 — Умягчение воды на установках обратного осмоса и нанофильтрации
Обратным осмосом называют метод разделения растворов. Если раствор (очищаемую воду) подать под давлением 3-8 МПа на полупроницаемую мембрану, то вода профильтруется через поры, а растворенное вещество останется. Данный эффект достигается из-за маленького размера пор мембран обратного осмоса и нанофильтрации 0,001 мкм — 0,0001 мкм, через которые не просачиваются молекулы включающие в свой состав ионы жесткости.
Эффективность обратного осмоса оценивают по селектив-ности мембраны — способности удерживать ионы и молекулы разного размера, а также по удельной производитель-ности единицы поверхности. Сегодня синтезированы полимерные мембраны с широким диапазоном размеров пор и высокой механической прочностью.
Одним из наиболее важных показателей качества воды является жесткость, численное значение которой зависит от концентрации в воде ионов кальция и магния (см. приложение 1).
Жесткость — показатель, определяющий содержание в воде катионов накипеобразователей кальция и магния. Величина жесткости в исходной воде определяет выбор схем химводоочисток (ХВО), наличие того или иного оборудования и режимов его работы. Эксплуатационное обеспечение норм жесткости является основой нормальной (безнакипной) работы нагревательных и испарительных поверхностей котлов.
Именно жесткость в значительной степени обусловливает возникновение шлама в воде и отложений (накипи) на внутренних поверхностях труб котлов и в проточной части турбин.
Различают следующие формы жесткости: общую Ж 0 , кальциевую Ж Са, магниевую Ж М g , карбонатную (временную) Жк и некарбонатную (постоянную) Жнк.
Общая жесткости Ж 0 представляет собой сумму карбонатной и некарбонатной жесткостей, т.е. суммарную концентрацию и воде катионов Са 2+ и Mg 2+ . Соли кальция и магния могут находиться в виде следующих соединений: СaS0 4 , MgSO 4 , хлористых – СаСl 2 , MgCI 2 , азотистых — Са(NО 3) 2 , Mg(NО 3) 2 , кремнекислых СаSiO 3 , MgSiO 3 , фосфорно- кислых — Са(РО 4) 2 , Mg(PO 4) 2 , двууглекислых — Са(НСО 3) 2 , Mg(НСО 3) 2 .
Жесткость измеряется в миллиграмм-эквивалентах на один 1 кг раствора (мг-экв/кг). Например, величина 1 мг-экв/кг жесткости соответствует содержанию 20,04 мг/кг иона Са 2+ или 12,16 мг/кг иона Мg 2+ . Тогда общая жесткость воды, выраженная в эквивалентных единицами суммарной концентрации катионов Са и Мg, определяется из уравнения:
Ж 0 = Са 2+ / 20, 04 + Мg 2+ / 12,16
Карбонатная жесткость Жк обуславливается совместным приcутствием в воде ионов Са 2+ , Mg 2+ и НСО 3 в виде бикарбонатов (двууглекислых солей) — Са (HCO 3) 2 и Mg(НСО 3) 2 .
Если воду нагревать выше 45 0 С, то находящиеся в ней бикарбонаты будут разлагаться с выделением углекислоты СО 2 и плохо растворимых углекислых кальция и магния — СаСО 3 и MgСО 3 , поэтому эта жесткость называется временной.
Соли, определяющие некарбонатную жесткость, будут постепенно кристаллизоваться и выделяться в виде твердых отложений. На поверхностях нагрева таким образом появляется накипь. Накипь, имея малый коэффициент теплопроводности, снижает эффективность теплообмена в котельных установках, ведет к перегреву металла поверхностей нагрева вплоть до его разрушения. Откладываясь внутри труб, она нарушает гидродинамический режим работы поверхностей нагрева котлов и тепловых сетей. При грубых нарушениях водно-химического режима по нормам жесткости возможно полное закупоривание труб с выходом котельного агрегата из строя.
Величина карбонатной жесткости равна выраженной в эквивалентных единицах концентрации в воде анионов бикарбонатов Са и Mg:
Жк = НСО 3 Ї / 61,02
где НСО 3 — концентрация в воде бикарбонатов кальция и магния, мг/кг;
61,02 — их эквивалентная масса, мг/мг-экв.
Некарбонатная жесткость Жп вызывается присутствием солей, в который Са и Mg связаны с анионами сильных кислот — соляной, серной, азотной и др. Эти соли при нагревании не разлагаются, а выделяются только при выпаривании раствора. Некарбонатная жесткость определяется из выражения:
Жнк = Жо — Жк
Установлена следующая классификация общей жесткости:
Ж 0 Ж 0 = (1,5…3,0) мг-экв/л — средняя;
Ж 0 = (3,0…6,0) мг-экв/л — повышенная;
Ж 0 = (6,0…12,0) мг-экв/л — высокая;
Ж 0 > 12,0 мг-экв/л — очень высокая.
В настоящее время все большую актуальность приобретает проблема очистки, или правильнее сказать подготовки воды. Причем не только воды для питья и приготовления пищи, но и той, которая используется в быту — для стирки, мытья посуды и т.д. Существует проблема, общая как для домов с автономной системой водоснабжения, так и для городских квартир. Имя этой проблемы — жесткость воды . И если на качество питьевой воды жесткость хоть и влияет, но не столь сильно, то для современной бытовой техники, автономных систем горячего водоснабжения и отопления, новейших образцов сантехники необходимость борьбы с жесткостью крайне актуальна.
Жёсткая вода — достаточно интересный термин. Что же он обозначает? От чего зависит? Давайте разберёмся — ведь эти данные действительно могут пригодиться, причём во многих областях: от стирки и мытья посуды, до чистоты в доме, экономии на электроэнергии и газе и многих других.
Итак, вы наливаете воду в чайник, кипятите и так раз пятьдесят. Что образуется на стенке чайника? Образуется накипь. Такой себе прочный налёт, который можно соскребать ножом (с большим трудом) .
Видели ли вы на упаковках для стиральных порошков надписи: если вода меньше 20 d, то сыпать 1 мерную ложечку; если вода больше 20 d, то полторы-две. Вот эти 20 d — единицы измерения жёсткости воды. Во многих городских квартирах этот показатель выше, чем 20 d. Соответственно, расход порошка в 1,5-2 раза выше, чем в мягкой воде. Кстати, для очень мягкой воды порошка требуется в десятки раз меньше, чем обычно. Чем не экономия?
Единицы измерения
Для численного выражения жёсткости воды указывают концентрацию в ней катионов кальция и магния. Рекомендованная единица СИ для измерения концентрации — моль на кубический метр (моль/м³), однако, на практике для измерения жёсткости чаще используется миллимоль на литр (ммоль/л).
В России для измерения жёсткости чаще используется нормальная концентрация ионов кальция и магния, выраженная в миллиграмм-эквивалентах на литр (мг-экв/л). Один мг-экв/л соответствует содержанию в литре воды 20,04 миллиграмм Ca2+ или 12,16 миллиграмм Mg2+ (атомная масса делённая на валентность).
Иногда указывают концентрацию, отнесённую к единице массы, а не объёма, особенно, если температура воды может изменяться или если вода может содержать пар, что приводит к существенным изменениям плотности
В разных странах использовались (иногда используются до сих пор) различные внесистемные единицы —
В СССР до 1952 года использовали градусы жёсткости, совпадавшие с немецкими. С 1 января 2005 года в России введен ГОСТ Р 52029-2003 Вода. По новому ГОСТу жесткость выражается в градусах жесткости (°Ж), что соответствует концентрации щелочноземельного элемента, численно равной 1/2 его моля, выраженной в мг/дм3 (г/м3).
По величине общей жёсткости различают воду мягкую (до 2 мг-экв/л), средней жёсткости (2-10 мг-экв/л) и жёсткую (более 10 мг-экв/л).
Ну, и, в конце концов, иногда, когда вы пьёте хорошую воду из хорошего родника или из глубокой скважины, то она кажется намного вкуснее, чем обычная водопроводная. Почему? Потому что в ней мало солей, в частности — низкая жёсткость воды.
Жёсткость воды — достаточно вредная штука. Что же это такое?
Жёсткость воды — это растворённые в воде соли кальция и магния. Соли кальция, магния и карбонаты (соли уклекислого газа) при нагревании выпадают в осадок и образуют накипь. Или, другими словами, соли кальция, магния и карбонаты образуют при нагревании новое химическое соединение — мел. Мел, известняк, мрамор, накипь — это по сути одно и то же вещество, карбонаты кальция и магния, в различном состоянии. Из за того, что соли кальция и магния обуславливают жёсткость воды, они называются солями жёсткости. А поскольку карбонаты кальция и магния выпадают в осадок при нагревании, вода становится менее жёсткой (и более мягкой), а карбонаты кальция и магния называются временной жёсткостью. Временной — потому что она удаляется кипячением. Кстати, один из способов умягчения воды — это нагрев до определённой температуры. Кстати, другие технологии умягчения воды направлены главным образом на удаление именно временной жёсткости как наиболее опасного явления.
Однако, разнообразие солей жёсткости на этом не заканчивается. Существует ещё одна группа солей жёсткости — которые при нагревании не образуют осадок, накипь. Поэтому (потому что они не выпадают в осадок при нагревании), эти соли образуют группу постоянной жёсткости.
Для бытовых приборов, труб, чайников, форсунок душей кранов и т.д. опасность представляет только временная жёсткость. То есть, карбонаты кальция и магния. Почему? Потому что эти приборы имеют дело с горячей водой — и при наличии солей временной жёсткости выпадают в осадок, образуя корку накипи. Из-за которой впоследствии возникают многочисленные проблемы.
Электропроводность воды
Электропроводность воды (ЕС)Чтобы ваше хобби приносило вам только удовольствие и не доставляло проблем и хлопот ознакомьтесь с данной статьей и правильно подберите нобходимое оборудование.
В данной статье мы расскажем вам о электропроводности воды.
Электропроводность — это численное выражение способности водного раствора проводить электрический ток. Электрическая проводимость природной воды зависит в основном от степени минерализации и температуры.
Минерализация — показатель количества содержащихся в воде растворённых веществ (неорганические соли, органические вещества).
TDS (Total Dissolved Solids) — это суммарный количественный показатель концентрации растворенных в воде веществ (солей) или — общее солесодержание.
Существует несколько важных факторов в управлении питанием и поливом растений – электропроводность, уровень pH и температура раствора. Для измерения данных характеристик существуют специальные приборы. С помощью солеметра вы без труда сможете измерить уровень содержания солей в воде (ppm).
Проводимость раствора – значение, которое отражает то, насколько раствор способен проводить электрический ток. Например дистиллированная или де-ионизированная вода в целом вообще не проводит электрический ток, поэтому значение ЕС для такой воды равно нулю.
Особенно в гидропонике очень важно следить и контролировать уровень pH и ЕС, так как это значительно влияет на рост и развитие растений. Если раствор обладает подходящим для растения значением ЕС, всасывание питательных веществ и транспортировка их ко всем клеткам растения будут обеспечены на должном уровне. Благодаря измерениям — легко понять получают ли ваши растения правильное питание, или же страдают от нехватки питательных вещест. Тем более, важно учитывать, что для разных растений требуется различный уровень ЕС/TDS и своя программа питания на каждый период жизни растения — вегетативный рост, цветение, плодоношение.
При измерении EC важно помнить о том, что температура питательного раствора должна быть оптимальной, а также уровень рН должен находиться в допустимых пределах. Потребление питательных веществ растениями зависит от температуры — когда темперетура выше нормы, из растения воды испаряется больше, что провоцирует его на более активное поглощение воды. В итоге воды поглащается больше чем соли. При нормальной температуре поглощение влаги и солей примерно одинаково.
Увеличение уровня ЕС говорит о том, что нужно добавить в раствор воды, так как слишком высока концентрация солей. Понижение этого же показателя более чем на 30% указывает на то, что каких-то элементов в растворе не хватает. Поскольку неизвестно, каких именно питательных элементов растению не хватает, то обычно гроверу проще заменить питательный раствор.
Единицы измерения
Электропроводность может измеряться с помощью ряда единиц измерения, но международным стандартом является ЕС с единицей измерения миллисименс или микросименс (в 1 миллисименсе содержится 1000 микросименсов). Важно помнить, что «полноценно сильным» раствор можно назвать при значении ЕС 2-2.5 миллисименса (2мСм/см). Иногда ЕС выражают в других единицах измерения, например, CF или TDS. CF, в сущности, это та же ЕС, но умноженная на 10. Поскольку в этом случае не нужна десятичная доля, в некоторых системах эта единица измерения предпочтительнее самой ЕС. TDS – общее число растворенных солей (от англ. Total dissolved salts), считается в частях на миллион (parts per million или ppm). Эта единица часто используется в США, причем для измерения этого значения используется тот же самый прибор, что и для измерения ЕС, просто в нем есть внутренний корректирующий фактор, который переводит единицы ЕС в TDS. И здесь есть свои неприятные особенности: в зависимости от производителя, корректирующие факторы в приборах различаются: некоторые используют фактор 500ppm на мСм/см, некоторые – 700 ppm.
Приборы:
В нашем магазине вы можете найти простой и удобный прибор для измерения электропроводности раствора.
Принцип действия солеметра TDS 3 основан на прямой зависимости электропроводности раствора (силы тока в постоянном электрическом поле, создаваемом электродами прибора) от количества растворенных в воде соединений (parts per million, ppm; 1 ppm=1мг/л).
За единицу уровня минерализации (TDS) приняты миллиграмм на литр (мг/л). Это означает вес растворённых веществ в граммах, растворённых в 1 литре воды.
Также уровень минерализации может выражаться в частицах на миллион частиц воды — сокращенно ppm (parts per million — частиц на миллион). Такую аббревиатуру можно встретить в зарубежных источниках.
Это означает количество частиц растворенных в 1 миллионе частиц воды.
Как перевести единицы измерения TDS (ppm) в EC (mS/cm) самостоятельно
Для перевода единицы измерения EC (мкСм/см) в TDS (ppm) необходимо значение в мкСм/см умножить на коэффициент TDS метра (0.5, 0.7 или другой).
Для перевода единицы измерения TDS (ppm) в EC (мкСм/см) необходимо поделить измеренное значение на коэффициент TDS-метра (0.5, 0.7 или другой).
Как определить коэффициент преобразования TDS-метра
Коэффициент преобразования TDS-метра можно определить в том случаи, если прибор одновременно является и EC-метром. В таком случаи, для одного и того же раствора, необходимо измерять показания минерализации (ppm) и электропроводности (мкСм/см). Далее мы делим значение минерализации (ppm) на значение электропроводности (мкСм/см). Полученное число является коэффициентом преобразования данного TDS-метра.
| EC-метр | TDS-метр | |||
|
mS/cm (мСм/см) |
µS/cm (мкСм/см) |
0.5 ppm | 0.64 ppm | 0.70 ppm |
| 0.1 | 100 | 50 ppm | 64 ppm | 70 ppm |
| 0.2 | 200 | 100 ppm | 128 ppm | 140 ppm |
| 0.3 | 300 | 150 ppm | 192 ppm | 210 ppm |
| 0.4 | 400 | 200 ppm | 256 ppm | 280 ppm |
| 0.5 | 500 | 250 ppm | 320 ppm | 350 ppm |
| 0.6 | 600 | 300 ppm | 384 ppm | 420 ppm |
| 0.7 | 700 | 350 ppm | 448 ppm | 490 ppm |
| 0.8 | 800 | 400 ppm | 512 ppm | 560 ppm |
| 0.9 | 900 | 450 ppm | 576 ppm | 630 ppm |
| 1.0 | 1000 | 500 ppm | 640 ppm | 700 ppm |
| 1.1 | 1100 | 550 ppm | 704 ppm | 770 ppm |
| 1.2 | 1200 | 600 ppm | 768 ppm | 840 ppm |
| 1.3 | 1300 | 650 ppm | 832 ppm | 910 ppm |
| 1.4 | 1400 | 700 ppm | 896 ppm | 980 ppm |
| 1.5 | 1500 | 750 ppm | 960 ppm | 1050 ppm |
| 1.6 | 1600 | 800 ppm | 1024 ppm | 1120 ppm |
| 1.7 | 1700 | 850 ppm | 1088 ppm | 1190 ppm |
| 1.8 | 1800 | 900 ppm | 1152 ppm | 1260 ppm |
| 1.9 | 1900 | 950 ppm | 1216 ppm | 1330 ppm |
| 2.0 | 2000 | 1000 ppm | 1280 ppm | 1400 ppm |
| 2.1 | 2100 | 1050 ppm | 1334 ppm | 1470 ppm |
| 2.2 | 2200 | 1100 ppm | 1408 ppm | 1540 ppm |
| 2.3 | 2300 | 1150 ppm | 1472 ppm | 1610 ppm |
| 2.4 | 2400 | 1200 ppm | 1536 ppm | 1680 ppm |
| 2.5 | 2500 | 1250 ppm | 1600 ppm | 1750 ppm |
| 2.6 | 2600 | 1300 ppm | 1664 ppm | 1820 ppm |
| 2.7 | 2700 | 1350 ppm | 1728 ppm | 1890 ppm |
| 2.8 | 2800 | 1400 ppm | 1792 ppm | 1960 ppm |
| 2.9 | 2900 | 1450 ppm | 1856 ppm | 2030 ppm |
| 3.0 | 3000 | 1500 ppm | 1920 ppm | 2100 ppm |
| 3.1 | 3100 | 1550 ppm | 1984 ppm | 2170 ppm |
| 3.2 | 3200 | 1600 ppm | 2048 ppm | 2240 ppm |
*Примечание: 1 mS/cm = 1000 μS/cm [1 мСм/см = 1000 мкСм/см]
Жесткость воды — InfoPool.ru
Жесткость воды
Автор: larry/creative.net (Larry Frank)
16 Дек 1997
Перевод на русский язык: Е.Л. (yevlem-at-nospam-yahoo.com)
Жесткость воды
Все источники пресной воды содержат кальций и магний в различных количествах. Эти элементы присутствуют в виде катионов с 2+ зарядом. Соединяясь с отрицательно-заряженными анионами, они образуют соли. Наиболее важными анионами являются бикарбонаты HCO 3-, карбонаты CO3 2- и сульфаты SO4 2- .
Общая жесткость (GH) измеряет катионы (положительный заряд) кальция и магния.
Карбонатная жесткость (KH) относится только к анионам бикарбоната и карбоната (отрицательный заряд), но не измеряет сульфаты и прочие анионы.
Карбонатная жесткость является достаточно запутанным термином потому что ссылается на жесткость, но в реальности имеет отношение к щелочности (способности раствора противостоять изменению pH при добавлении кислоты) карбонатного и бикарбонатного происхождения. (В нашей литературе щелочность воды обычно описывается термином буферная способность воды –прим.переводчика). Прочие анионы (такие как гидроксиды, бораты, силикаты и фосфаты) также могут влиять на щелочность. Чтобы быть абсолютно корректным, вам НИКОГДА не следует использовать термин ‘KH’; в то же время, он часто используется в литературе.
Справедливости ради следует отметить, что все таки бикарбонатная/карбонатная буферная система представляет основной источник щелочности.
KH и GH обычно близки между собой, но GH может быть такой же, большей или меньшей чем KH, в зависимости от содержания катионов и анионов в образце. Например, большое количество NaHCO3 поднимет показатель (KH), но не окажет влияния на (GH). Большое количество MgSO4 поднимет показатель (GH),но не (KH).
Обычно, в пресной воде большинство катионов представлены кальцием и магнием ( в пропорции 3:1) и большинство анионов – карбонатами. Уровни (GH) и (KH) часто будут похожими.
Единицы измерения
Было бы разумным измерять общую жесткость через количество ионов/литр или молярность, но эти единицы на практике не используются.
Общераспространенными единицами измерения, используемыми в литературе, являются градусы общей жесткости dGH (GH) из немецкой системы или промилле (ppm –parts per million – частиц на миллион) Ca из CaCO3.
Карбонатная жесткость (KH) –это термин, который не имеет ничего общего с жесткостью, но представляет собой количественный эквивалент карбоната и бикарбоната, который влияет на щелочность или емкость буфферной системы. (KH) соотносится с промилле CO3 из CaCO3.
Перевод из dGH и dKH в промилле CaCO3 может быть произведен путем умножения на 17.86
Как был получен коэффициент перевода:
По определению, 1dGH = 10 мг/литр CaO
Атомный вес Ca = 40, O = 16, CaO = 56
Таким образом, 10 мг/литр CaO содержит 40/56 *10 = 7.143 мг/литр Ca
По определению, промилле ( ppm )Ca определяют не элементарный кальций , но миллионые частицы CaCO3.
Атомный вес CaCO3 = 100
Таким образом, 7.143 мг/литр элементарного Ca будут выражены как 100/40 * 7.143 = 17.8575 мг/литр (промилле)CaCO3.
1dGH = 17.86 промилле CaCO3 и 7.143 промилле Ca2+.
(KH)
1 dGH определяется как 10 мг/литр CaO, что может быть выражено в промилле CaCO3 как указано выше.
Теперь определение для dKH должно быть сделано из количества карбоната в 17.86 промилле CaCO3 , что не имеет отношения к GH, определяемому через CaO!
Исторически, GH должно быть , во-первых, определялось через CaO, жесткость через промилле CaCO 3 в-вторых, затем KH в-третьих?
1dKH = 17.86 промилле CaCO3
Из вышесказанного; 1dKH = 17.8575 мг/литр CaCO3. 7.143 мг/литр из этого — Ca, остальное ;(17.8575-7.143)= 10.7145мг/литр CO3
1dKH = 10.7145 промилле CO3
Для бикарбоната:
CaCO3 формирует Ca(HCO3)2 в воде при уровне pH менее чем 10.25 . (Два бикарбоната формируются из каждого иона карбоната):
CaCO3 + h30 + CO2 —> Ca(HCO3)2
CO3 mw (молекулярный вес) = 60
HCO3 mw (молекулярный вес) = 61
Таким образом, 10.7145мг/литр CO3 из CaCO3 (каждый CO3 карбонатный анион формирует два HCO3 бикарбонатных аниона; 61/60*2 *10.7=21.8 мг/литр HCO3
Другой способ этого рассчета подразумевает использование молярности:
1dKH = 17.86 мг/литр CaCO3
mw CaCO3 = 100
17.86 мг/литр CaCO3 = 0.179 m (Моль) CaCO3
Это даст 2* .179 m Моль = .358 m Моль
Умножая моли *mw даст нам мг:
0.358*61(mw HCO3) = 21.8 мг/литр HCO3
1dKH = 21.8 промилле HCO3
Как использовать эти коэффициенты перевода:
Если Вам известна щелочность или жесткость в промилле (ppm), разделите на 17.86 чтобы получить градусы.
Если Вы хотите поднять щелочность на 1 dKH, используя CaCO3 — используйте 17,86 мг CaCO3
Если Вы хотите поднять щелочность на 1 dKH, используя NaHCO3 :
mw Na = 23
mw HCO3= 61
mw NaHCO3= 84
1dKH= 21.8 промилле HCO3
21.8 *84/61=30 мг/литр of NaHCO3
Используя молярность:
0.358 mМолей * 84(mwNaHCO3) = 30 мг/литр NaHCO3
CO2, Кислотность (pH) и Карбонатная Щелочность
CO2, pH и карбонаты взаимосвязаны при помощи следующих трех уравнений::
1. CO2 + h30 h3CO2 (Углекислота)
2. h3CO2 H+ + HCO3- (Бикарбонат)
3. HCO3- H+ + CO32- (Карбонат)
_____________________________________
(Промилле — ‰ отношение массы растворенного вещества к массе раствора, только выраженное в тысячных долях
Например, фраза «солёность воды составляет 11‰ (одиннадцать промилле)» означает, что из общей массы воды 0,011 (11 тысячных) занимают соли; так, если взять 1 кг воды, то в ней будет 0,011 ∙ 1 000 = 11 г солей. )
Новые статьи:
Старые статьи:
Жесткость воды — Atomizing Systems Inc
Сырая вода состоит не только из атомов водорода и кислорода, с которыми мы все так хорошо знакомы. Он также содержит комбинации кальция, магния, натрия, кремнезема и множества других растворенных минералов, отложенных из источников окружающей среды.
Жесткость воды — это в первую очередь измерение содержания в воде ионов кальция (Ca ++) и магния (Mg ++). В США твердость обычно измеряется в миллионных долях (миллионных долях) — молярной концентрации CaCO 3 , которая может быть определена большинством тестовых наборов.
Две другие единицы также используются для измерения жесткости: немецкие градусы жесткости (dH) и мг / л (гран / литр). Для эмпирического правила:
| Твердость | частей на миллион | dH | Мг / л |
| Очень мягкий | от 0 до 60 страниц в минуту | от 0 до 4 dH | |
| Мягкий | от 60 до 119 страниц в минуту | от 4 до 8 dH | 0-19 мг / л |
| средней твердости | от 120 до 179 страниц в минуту | от 8 до 12 dH | 20-50 мг / л |
| Жесткий | от 180 до 239 частей на миллион | от 12 до 18 dH | 51-120 мг / л |
| Очень жесткая | от 240 до 500 частей на миллион | от 18 до 30 dH | 121-174 мг / л |
| Чрезвычайно твердый | более 500 частей на миллион | более 30 dH | > 175 |
Национальная жесткость грунтовых вод по CaCO 3
Минеральные отложения образуются в результате ионных реакций, приводящих к образованию нерастворимого осадка.По мере накопления этих отложений водные примеси создают особые проблемы для отверстий наших форсунок (от 0,0045 до 0,015 диаметра). Даже в небольших количествах они изменяют расход через форсунку и форму распыления. Эта неочищенная вода после запотевания испаряется и оставляет тяжелые минеральные вещества в виде пыли, которая оседает на всех поверхностях. Более серьезной является ситуация с засорением отверстий форсунок, а также с образованием накипи на трубопроводах и трубках.
Картриджи фильтра для воды удаляют только твердые частицы и мусор из воды и не могут удалить жесткость.В то время как наши водные картриджи изготовлены из полиэтилена, чтобы не позволить бактериям питаться гофрированной средой (обычно используется с целлюлозными или бумажными фильтрами), в городских системах водоснабжения обычно всегда требуется очистка воды для удаления жесткости, которая может / в конечном итоге может засорить сопла и трубки .
Если вода слишком жесткая для определенного использования, ее можно смягчить с помощью коммерческих «умягчителей воды», которые удаляют ионы кальция из воды и заменяют их ионами натрия. Или его можно пропустить через установку обратного осмоса или деионизацию, которые удаляют почти все растворенные химические вещества из воды, включая кальций.Любой из этих процессов может производить воду с нулевой жесткостью, которая может подходить или не подходить для всех применений в целом.
Но для всего вышеперечисленного, а также для других приложений деионизация (DI) является очень эффективным решением. Поскольку примеси в воде существуют в виде ионов (минералы, соли с положительным или отрицательным электрическим зарядом), их можно легко обменять на ионы водорода и гидроксида. Это достигается пропусканием неочищенной воды через слои катионных и анионных смол.
В отличие от умягчения воды, при котором натрий (мягкий минерал) обменивается на магний и кальций (твердые минералы), DI фактически снижает общее количество растворенных твердых веществ в воде, выводя их из системы и удаляя их из конечного продукта. Водные системы типа DI или R / O следует рассматривать для любого применения, требующего чистой, бесперебойной воды, чтобы сократить длительное обслуживание. Все смачиваемые детали из нержавеющей стали требуются с DI water
Очистка воды обратным осмосом: R / O.это еще один комплексный метод отделения нежелательных материалов от воды. Разделение достигается путем прокачки воды из растений через специальную мембрану под высоким давлением, которая задерживает загрязнения и позволяет молекулам воды проходить. Очищенная вода собирается ниже по потоку для использования системой тумана, а отбракованные загрязнения смываются в канализацию за счет самоочищения. В процессе R / O из вашего обычного водоснабжения будет удалено следующее:
Взвешенные частицы (ржавчина, окалина) прибл.100% бактерий и водорослей прибл. 100% растворенных твердых веществ прибл. 97%
Для всех смачиваемых частей из нержавеющей стали может потребоваться слив воды.
Примечание. Вода обратного осмоса (R / O) обычно известна как «агрессивная», но ошибочно считается «коррозионной». Вода R / O обычно менее проводящая, чем вода из-под крана. Следовательно, R / O вода замедляет процесс гальванической коррозии и, следовательно, менее агрессивна, чем водопроводная вода. Однако вода R / O действует как лучший растворитель.
Когда медные трубы подвергаются коррозии, они образуют оксиды на стенках труб, которые в некоторых случаях закупоривают и закрывают любые отверстия для штифтов, которые могут присутствовать.Если вода для забора воды вводится в трубу, которая находилась в эксплуатации в течение определенного периода времени, вода для забора воды растворяет оксиды, образовавшиеся на трубе, и иногда отключает отверстия для штифтов, вызывая утечку. Здесь вода для снятия / вывода вызвала утечку не из-за коррозии трубы, а из-за прочистки существующих отверстий. Медные трубы, которые с самого начала использовались с водой для забора воды, могут фактически иметь увеличенный срок службы из-за более медленной скорости коррозии.
Жесткая вода по номерам в GPG
Если вы плохо знакомы с цифрами, связанными с жесткой водой, поиск лучших решений для смягчения воды может сбить с толку.Вот краткая информация о том, что вы можете ожидать от исследований по смягчению воды, и полезные ссылки на тот момент, когда вы установили систему в своем доме.
Знакомство с жесткой водой
Обсуждение жесткой воды может стать немного техническим. От математических преобразований до множественных нулей может происходить очень многое. Посмотрите, какие числа вы, скорее всего, увидите, и что они означают:
- Одно зерно на галлон (gpg) эквивалентно 17,14 частей на миллион (ppm).Жесткость воды можно измерить в gpg или ppm, но gpg является наиболее часто используемым показателем.
- 20 000–80 000: этот диапазон показывает вместимость зерна большинства имеющихся на рынке умягчителей воды. В зависимости от степени жесткости воды, ежедневного использования воды и количества людей в доме вам может потребоваться умягчитель с меньшей или большей емкостью зерна. Узнайте, какая емкость вам нужна здесь.
Тестирование воды
После успешного тестирования воды для определения числа жесткости ваш результат окажется где-то на шкале жесткости.После того, как вы проверите воду и получите свой номер, посмотрите, куда падает ваша вода, используя приведенное ниже руководство:
- 0–3: Если ваша тест-полоска для жесткой воды показывает, что ваша вода находится в диапазоне 0–3 г / г, ваша вода не требует смягчения.
- 3–7: Вода между 3–7 г / г умеренно жесткая, вызывает появление пятен на посуде и сухость кожи.
- 7–11: Жесткая вода богата минералами в количестве 7–11 г / г, и вы, вероятно, имеете дело с твердыми кранами и трубами и, возможно, красноватыми кольцами на фарфоре из-за избытка железа.
- 11–15: Считается очень жесткой, вода с расходом 11–15 галлонов на дюйм всегда проявляет все признаки жесткой воды.
- 15+: Чрезвычайно жесткая вода — более 15 г / г. Очки очень пятнистые, кожа выглядит очень скрипучей, а мыльная пена очень стойкая. А если вы используете колодезную воду, вы также можете увидеть другие признаки проблемной воды, такие как пятна от железа.
Номера для смягчителей воды
Вот несколько важных цифр, которые нужно знать теперь, когда вы установили в своем доме смягчитель воды:
- 5–10 дней: в среднем вы можете ожидать, что ваш смягчитель воды будет восстанавливаться каждые 5–10 дней.Это зависит от того, установлен ли у вас умягчитель воды по времени или по запросу, от используемой в вашем доме воды и вместимости умягчителя.
- 6–8 мешков. Умягчители воды по запросу, которые регенерируют только при необходимости, чрезвычайно эффективны, поэтому вам, вероятно, потребуется добавлять в кондиционер только один 40-фунтовый мешок соли каждые 6–8 недель.
- 4 доллара в год: приблизительная стоимость питания высокоэффективного умягчителя воды в течение одного года.
От общих цифр до цифр, связанных с умягчителем, когда он оказывается дома, кажется, что можно многому научиться.С помощью этого простого справочника вы в кратчайшие сроки станете профессионалом в области чисел жесткой воды.
формул преобразования | Промышленные испытательные системы
Что такое щелочность?
Щелочность определяется как мера буферной способности воды по нейтрализации сильной кислоты. Эта способность связана с основаниями, которые присутствуют в природных водах, включая OH — , HCO 3 — и CO 3 2-. Повышенная щелочность пробы воды означает большую буферную способность пробы воды.
Для определения щелочности ваших образцов образцы будут титроваться серной или соляной кислотой до определенной конечной точки pH (pH 8,3 для фенолфталеиновой щелочности и pH 4,5 для общей щелочности), а также объема кислоты, используемого для титрования. будет записан.
Что такое общая щелочность?
Общая щелочность — это количество кислоты, используемое для достижения pH 4,5. (мл) x 50000 (мг CaCO3 / экв) / объем образца (мл)
Вот пример того, как определить общую щелочность: 18 мл 0.Для титрования 50 мл образца до pH 4,5 требовалось 01M серной кислоты.
Общая щелочность = 18 (мл) x 0,02 (экв / л) x 50000 (мг CaCO3 / экв) / 50 (мл) = 360 (мг / л)
Продукты общей щелочности
Уровни жесткости воды
Мягкий: от 0 до 75 мг / л как CaCO3
Умеренное: от 76 до 150 мг / л в виде CaCO3
Жесткий: от 151 до 300 мг / л в виде CaCO3
Очень твердая: более 301 мг / л, как CaCO3
Общая жесткость = жесткость по кальцию + жесткость по магнию
Вода должна иметь общую жесткость от 75 до 85 мг / л по CaCO3 и жесткость по магнию менее 40 мг / л по CaCO3, чтобы минимизировать образование накипи при повышенных температурах.
Полосы общей твердости
Какая формула переводит мг / л в ppm?
1 мг / л = 1 ppm для разбавленных водных растворов. Например, концентрация хлора 1,8 мг / л эквивалентна 1,8 ppm хлора.
Как я могу преобразовать процентное пропускание в оптическую плотность или оптическую плотность в процентную пропускаемость?
Чтобы преобразовать значение процента пропускания (% T) в оптическую плотность, используйте следующее уравнение:
- Поглощение = 2 — log (% T)
- Пример: преобразовать 56% T в оптическую плотность:
- 2 — журнал (56) = 0.252 единицы абсорбции
Чтобы преобразовать значение оптической плотности в процент пропускания, используйте следующее уравнение:
- % T = antilog (2 — абсорбция)
- Пример: преобразовать оптическую плотность 0,505 в% T:
- антилогарифмический (2 — 0,505) = 31,3% T
Что такое зерно на галлон (gpg)?
Одно зерно эквивалентно 64,799 миллиграмма. Это историческая единица веса, когда-то использовавшаяся для ячменя. Зерно на галлон — это вес вещества в одном галлоне воды, аналогичный миллиграмму на литр.
Какова формула перевода зерен на галлон (gpg) в миллиграммы на литр (мг / л)?
Умножьте gpg на 17,1, чтобы получить мг / л (1 gpg = 17,1 мг / л). Например, результат теста на твердость 3 г / г для CaCO3 эквивалентен 51 мг / л для CaCO3. Какая формула переводит количество зерен на галлон в миллиграммы на литр? 1 зерно = 64,799 миллиграмма 1 галлон = 3,785 литра 64,799 разделить на 3,785 литра = 17,1 1 г / г = 17,1 мг / л
Наборы для заваривания
По какой формуле переводятся ppm карбоната кальция (как CaCO3) в ppm кальция (ионы)?
Умножьте ppm (как CaCO3) на 0.4
Преобразование частей на миллион карбоната кальция (как CaCO3) в градусы общей жесткости (dGH)
Просто умножьте ppm (как CaCO3) на 0,056
Как преобразовать ppm хлорида натрия (в виде NaCl) в хлорид (в виде Cl-1)?
Вы бы умножили ppm (как NaCl) на 0,6097
По какой формуле пересчитывают ppm диоксида хлора (как ClO2) в хлор (как Cl2)?
Умножьте ppm (как ClO2) на 0,5255, чтобы получить ответ
Как преобразовать ppm хлора (как Cl2) в ppm монохлораминов?
Умножьте ppm (как Cl2) на 0.7259, чтобы получить ответ
Диоксид хлора
По какой формуле переводятся ppm шестивалентного хрома (как Cr + 6) в ppm хромата натрия (как Na2CrO4)?
Вам нужно умножить ppm (как Cr + 6) на 3,115
Преобразование частей на миллион шестивалентного хрома (asCr + 6) в частей на миллион хромата (как CrO4):
Умножьте ppm (как Cr + 6) на 2,231
Как преобразовать ppm карбоната кальция (как CaCO3) в ион магния (как Mg + 2)?
Умножьте ppm (как CaCO3) на 0.2439
Какова формула преобразования частей на миллион карбоната кальция (в виде CaCO3) в хлорид магния (в виде MgCl2)?
Умножить ppm (как CaCo3) на 0,956
Магниевые продукты
Какова формула преобразования частей на миллион марганца (в виде Mn + 2) в перманганат калия (в виде KMn04)?
Умножить ppm (как Mn + 2) на 2,876
Какова формула преобразования частей на миллион марганца (в виде Mn + 2) в перманганат калия (в виде MnO4-)?
Умножьте ppm (как Mn + 2) на 2.165
Марганцевые продукты
Почему важно проводить анализ на марганец?
Длительное воздействие марганца может вызвать токсическое воздействие на нервную систему и симптомы, подобные болезни Паркинсона, особенно у детей, пожилых людей и беременных матерей. Итак, очень важно пройти тест на высокий уровень.
Один из наших любимых веб-сайтов, Wolfram Alpha, выполняет динамические онлайн-вычисления на основе обширного набора встроенных данных, алгоритмов и методов.
Список литературы
Snoeyink V. и Jenkins. Д. 1980. Химия воды. JOHN WILEY & SONS, Нью-Йорк. ISBN 0-471-05196-9
Water — Brewfather — docs
Введите значения отчета о воде в ppm (мг / л)
Таблицу, которую можно использовать для преобразования в значения воды для профиля, можно найти здесь.
Brewfather использует значения ppm для профиля воды, поэтому ваш отчет о воде должен быть преобразован в это. Ниже вы найдете справку по преобразованию ваших значений в ppm.
1 мг / л = 1 ppm
Щелочность ммоль / л до ppm Бикарбонат HCO3: умножить на 61 От Щелочность мг / л CaCO3 до ppm Бикарбонат HCO3: умножить на 1,22 От щелочности ммоль / л до мг / л CaCO3: умножить на 50 1000 мкг / л = 1 ppm мкг / л /1000 = ppm
Кальций в виде CaCO3 ppm * 0,401 = Кальций (Ca) ppm Магний в виде CaCO3 частей на миллион * 0.243 = Магний (Mg) частей на миллион Сульфат в виде серы, частей на миллион в виде SO4-S * 3 = Сульфат (SO4) частей на миллион Бикарбонат в виде CaCO3 частей на миллион * 1,22 = Бикарбонат (HCO3) частей на миллион Твердость США гран / галлон * 6,86 = Кальций (Ca) частей на миллион ° Кларк / ° e (английский) Твердость гран / имп галлон * 5,71 = Кальций (Ca) частей на миллион Немецкая жесткость (° dH, deutsche Härte) * 7,14 = Кальций (Ca) частей на миллион Кальциевая жесткость mEq / L или mval * 20 = Кальций (Ca) частей на миллион Карбонатная твердость dKH * 21.8 = Бикарбонат (HCO3) частей на миллион Щелочность мЭкв / л или мвал * 61 = Бикарбонат (HCO3) частей на миллион Минорные ионы (в настоящее время не используются) Карбонат как CaCO3 частей на миллион * 0,6 = карбонат (CO3) частей на миллион Нитрат как азот ppm как NO3-N * 4,43 = Нитрат (NO3) ppm
Справочник по воде — выражение аналитических результатов
ЧАСТЕЙ НА МИЛЛИОН (PPM)
Анализ воды включает обнаружение мельчайших количеств различных веществ.Выражение результатов в процентах потребует использования громоздких цифр. По этой причине результаты анализа воды обычно выражаются в частях на миллион (ppm), а не в процентах. Одна часть на миллион равна одной десятитысячной процента (0,0001%) или одной части (по весу) на миллион частей, например, 1 унция на 1000000 унций воды или 1 фунт на 1000000 фунтов воды. Не имеет значения, какие единицы используются, если оба веса выражены в одних и тех же единицах.
Когда элементы присутствуют в минутных или следовых количествах, использование частей на миллион приводит к небольшим десятичным значениям.Поэтому в этих случаях удобнее использовать доли на миллиард (ppb). Одна часть на миллиард равна одной тысячной части на миллион (0,001 ppm). Например, при исследованиях чистоты пара с использованием специального ионного электрода для измерения содержания натрия нередки такие низкие значения, как 0,001 ppm. Это более удобно, как 1,0 ppb.
В последнее время конвенция по представлению аналитических результатов смещается в сторону использования миллиграммов на литр (мг / л) в качестве замены частей на миллион и микрограммов на литр (мкг / л) в качестве замены частей на миллиард.
Процедуры испытаний и расчеты результатов основаны на миллилитрах (мл), а не на более распространенном кубическом сантиметре (куб. См или см 3 ). Разница между этими двумя терминами очень незначительна. По определению, миллилитр — это объем, занимаемый 1 г воды при 4 ° C, тогда как кубический сантиметр — это объем, заключенный в кубе размером 1 см с каждой стороны (1 мл = 1,000028 см 3 ).
МИЛЛИГРАММ НА ЛИТР (мг / л)
Условное обозначение миллиграммы на литр (мг / л) тесно связано с миллионными частями (ppm).Это соотношение определяется по:
частей на миллион x плотность раствора = мг / л
Таким образом, если плотность раствора близка или равна 1, то ppm = мг / л. Обычно это происходит с разбавленными водными растворами, типичными для промышленных водных систем. Контрольные испытания обычно проводят без измерения плотности раствора. Для обычных проб воды это не представляет большой неточности, поскольку плотность пробы составляет приблизительно 1. Миллиграммы на литр (мг / л) и доли на миллион (ppm) начинают расходиться при изменении плотности раствора от 1.Примерами этого являются плотный отстой из нижнего слива осветлителя (плотность более 1) или вода замкнутой системы охлаждения с высокими концентрациями органических соединений (плотность менее 1). Все аналитические методы, обсуждаемые в этом тексте, содержат вычисления, необходимые для получения результатов в миллиграммах или микрограммах на литр.
ЭКВИВАЛЕНТЫ НА МИЛЛИОН (EPM)
При составлении отчетов об анализе воды на ионной основе результаты также выражаются в эквивалентах на миллион (эпм).Этот подход, тесно связанный с использованием частей на миллион, сводит все составляющие к общему знаменателю — химическому эквивалентному весу.
Использование эквивалентов на миллион не рекомендуется для нормального контроля растений. Части на миллион — это более простая форма выражения результатов, которая принята в качестве общепринятой стандартной основы для составления отчетов по анализу воды. Однако всякий раз, когда необходимо выполнить обширные вычисления, использование эквивалентов на миллион значительно упрощает математику, потому что все составляющие находятся на основе химического эквивалента веса.В оставшейся части этого раздела обсуждаются части на миллион и эквиваленты на миллион для тех, кто желает получить практическое знание этих методов выражения для целей вычислений.
Единицы измерения ppm и epm обычно комбинируются в обычных отчетах по анализу воды, и многие различные составляющие часто указываются на основе общего веса единицы. Например, кальций (эквивалентная масса 20,0) указывается в терминах «кальций как CaCO3» (эквивалентная масса 50.0). Тест на кальций откалиброван по CaCO3, поэтому коэффициент преобразования 2,5 (50/20) не требуется. Жесткость, магний, щелочность и свободная минеральная кислота часто выражаются в CaCO3; указанное значение представляет собой массу CaCO3, которая химически эквивалентна количеству присутствующего материала. Среди этих веществ можно рассчитать ионный баланс. Когда компоненты имеют одинаковую единицу веса, их можно добавлять или вычитать напрямую. Например, общая жесткость ppm как CaCO3 минус ppm кальция как CaCO3 равна ppm магния как CaCO3.Однако ppm магния в виде Mg 2+ равно 12,2 (эквивалентная масса магния), разделенная на 50,0 (эквивалентная масса CaCO3), умноженных на ppm магния в виде CaCO3.
В каждом случае необходимо определить единицу веса результатов — «ч / млн щелочности как CaCO3» или «ч / млн сульфата как SO4 2-» или «ч / млн диоксида кремния как SiO2». Если единицы веса отличаются, расчеты должны основываться на использовании химических уравнений.
Следующие правила определяют, где можно использовать epm, а где ppm.Как правило, любой из них может использоваться, если известна точная химическая формула. Когда таких знаний нет, следует использовать ppm.
- Концентрация всех растворенных солей индивидуально определяемых ионов должна быть в ppm.
- Два или более иона с аналогичными свойствами, совместное действие которых измеряется с помощью одного определения (например, общая жесткость, кислотность или щелочность), могут быть представлены в ppm или epm.
- Концентрация нерастворенных или взвешенных твердых частиц должна указываться только в ppm.
- Концентрация органических веществ должна указываться только в ppm.
- Концентрация растворенных твердых веществ (при испарении) должна выражаться только в ppm.
- Общее количество растворенных твердых веществ расчетным путем может быть выражено в ppm или epm.
- Концентрация отдельных газов, растворенных в воде, должна указываться в ppm. Общая концентрация каждого газа при смешивании с водой может быть рассчитана с учетом его соответствующей ионной концентрации в ppm или epm.
РАСЧЕТ ОБЩЕГО РАСТВОРЕНИЯ ТВЕРДЫХ ПО ЭПМ
Начиная с достаточно полного анализа воды, общее количество растворенных твердых веществ может быть рассчитано как epm. В полном анализе воды эпм отрицательных ионов должно быть равно эпм положительных ионов. В случае избытка epm отрицательных ионов оставшаяся epm положительных ионов, скорее всего, будет натрием или калием (или обоими). Для удобства обычно предполагается, что это натрий. Если имеется избыток положительного epm, оставшееся отрицательное epm обычно считается нитратом.
Чтобы вычислить растворенные твердые вещества, преобразуйте различные составляющие из ppm в epm и просуммируйте различные катионы (положительно заряженные ионы) и анионы (отрицательные ионы). Катионы должны равняться анионам. Если нет, добавьте ионы натрия (плюс) или нитрата (минус), чтобы сбалансировать колонки. Преобразуйте ионную эпм каждого компонента в ppm и общее, чтобы получить ppm растворенных твердых веществ. Например, чтобы преобразовать 150 ppm кальция в виде CaCO3 в эпм (таблица 40-1), разделите на 50 (эквивалентный вес карбоната кальция) и получите 3.0 эпм. Чтобы преобразовать 96 частей на миллион сульфата как SO4 2- в эпм, разделите на 48 (эквивалентный вес сульфата) и получите 2,0 эпм. После уравновешивания катионов и анионов путем добавления натрия преобразуйте его в ионные ppm, умножив epm на конкретный ионный эквивалент веса. Например, чтобы преобразовать 3,0 ppm кальция в ppm кальция как Ca 2+ , умножьте на 20 (эквивалентный вес кальция) и получите 60 ppm кальция как Ca 2+ . Чтобы получить содержание растворенных твердых веществ в миллионных долях, просуммируйте содержание отдельных ионов в миллионных долях.
Таблица 40-2. Таблица преобразования
Таблица 40-2: Таблица преобразования
ИксФормула | Количество эквивалентов | Эквивалентная масса | ||
ПОЛОЖИТЕЛЬНЫЕ ИОНЫ | ||||
Алюминий | Al +3 | 3 | 9.0 | |
Аммоний | NH 4 + | 1 | 18,0 | |
Кальций | Ca 2+ | 2 | 20,0 | |
Медь | Cu 2+ | 2 | 31.8 | |
Водород | H + | 1 | 1,0 | |
Ион железа | Fe 2+ | 2 | 27,9 | |
Ион железа | Fe 3+ | 3 | 18.6 | |
Магний | мг 2+ | 2 | 12,2 | |
Марганец | млн 2+ | 2 | 27,5 | |
Калий | К + | 1 | 39.1 | |
Натрий | Na + | 1 | 23,0 | |
ОТРИЦАТЕЛЬНЫЕ ИОНЫ | ||||
Бикарбонат | HCO 3 — | 1 | 61.0 | |
Карбонат | CO 3 2- | 2 | 30,0 | |
Хлорид | Класс — | 1 | 35,5 | |
Фторид | Ф. — | 1 | 19.0 | |
Йодид | Я — | 1 | 126,9 | |
Гидроксид | ОН — | 1 | 17,0 | |
Нитрат | НЕТ 3 — | 1 | 62.0 | |
Фосфат (трехосновный) | PO 4 3- | 3 | 31,7 | |
Фосфат (двухосновный) | HPO 4 2- | 2 | 48,0 | |
Фосфат (одноосновный) | H 2 PO 4 — | 1 | 97.0 | |
Сульфат | СО 4 2- | 2 | 48,0 | |
Бисульфат | HSO 4 — | 1 | 97,1 | |
Сульфит | СО 3 2- | 2 | 40.0 | |
Бисульфит | HSO 3 — | 1 | 81,1 | |
Сульфид | С 2- | 2 | 16,0 | |
СОЕДИНЕНИЯ | ||||
Квасцы | Al 2 (SO 4 ) 3 18H 2 O | 6 | 111.0 | |
Сульфат алюминия (безводный) | Al 2 (SO 4 ) 3 | 6 | 57,0 | |
Гидроксид алюминия | AI (OH) 3 | 3 | 26,0 | |
Оксид алюминия | Al 2 O 3 | 6 | 17.0 | |
Аммиак | NH 3 | 1 | 17,0 | |
Алюминат натрия | Na 2 AI 2 O 4 | 6 | 27,3 | |
Бикарбонат кальция | Ca (HCO 3 ) 2 | 2 | 81.1 | |
Карбонат кальция | CaCO 3 | 2 | 50,0 | |
Хлорид кальция | CaCl 2 | 2 | 55,5 | |
Гидроксид кальция | Са (ОН) 2 | 2 | 37.0 | |
Оксид кальция | CaO | 2 | 28,0 | |
Сульфат кальция (безводный) | CaSO 4 | 2 | 68,1 | |
Сульфат кальция (гипс) | CaSO 4 2H 2 O | 2 | 86.1 | |
Фосфат кальция | Ca 3 (PO 4 ) 2 | 6 | 51,7 | |
Двуокись углерода | CO 2 | 2 | 22,0 | |
Хлор | Класс 2 | 2 | 35.5 | |
Сульфат железа (безводный) | FeSO 4 | 2 | 76,0 | |
Сульфат железа | Fe 2 (SO 4 ) 3 | 6 | 66,6 | |
Оксид магния | MgO | 2 | 20.2 | |
Бикарбонат магния | мг (HCO 3 ) 2 | 2 | 73,2 | |
Карбонат магния | MgCO 3 | 2 | 42,2 | |
Хлорид магния | MgCl 2 | 2 | 47.6 | |
Гидроксид магния | Мг (OH) 2 | 2 | 29,2 | |
Фосфат магния | мг 3 (PO 4 ) 2 | 6 | 43,8 | |
Сульфат магния (безводный) | MgSO 4 | 2 | 60.2 | |
Сульфат магния (английская соль) | MgSO 4 . 7H 2 O | 2 | 123,2 | |
Гидроксид марганца | Mn (OH) 2 | 2 | 44,5 | |
Кремнезем | SiO 2 | 2 | 30.0 | |
Бикарбонат натрия | NaHCO 3 | 1 | 84,0 | |
Карбонат натрия | Na 2 CO 3 | 2 | 53,0 | |
Хлорид натрия | NaCl | 1 | 58.4 | |
Гидроксид натрия | NAOH | 1 | 40,0 | |
Нитрат натрия | NaNO 3 | 1 | 85,0 | |
Тринатрийфосфат | Na 3 PO 4 . 12ч 2 0 | 3 | 126,7 | |
Тринатрийфосфат (безводный) | Na 3 PO 4 | 3 | 54,7 | |
Динатрийфосфат | Na 2 HPO 4 . 12H 2 O | 2 | 179,1 | |
Динатрийфосфат (безводный) | Na 2 HPO 4 | 2 | 71,0 | |
Фосфат натрия | NaH 2 PO 4 . H 2 O | 1 | 138,0 | |
Фосфат натрия (безводный) | NaH 2 PO 4 | 1 | 120,0 | |
Силикат натрия | Na 2 SiO 3 | 2 | 61.0 | |
Серная кислота | H 2 SO 4 | 2 | 49,0 | |
Метафосфат натрия | NaPO 3 | 1 | 102,0 | |
Сульфат натрия | Na 2 SO 4 | 2 | 71.0 | |
Сульфит натрия | Na 2 SO 3 | 2 | 63,0 | |
Таблица 40-1: Расчет растворенных твердых веществ
Иксстр. / Мин | (+) Катионы | (-) Анионы | Ион. Частей на миллион | |||
Кальций в виде CaCO 3 | 150 = | 3.0 | = | 60 | как Ca | |
Магний как CaCO 3 | 50 = | 1,0 | = | 12 | как Mg | |
Сульфат как SO 4 | 96 = | 2.0 | = | 96 | как SO 4 | |
Хлорид в виде Cl ¯ | 18 = | 0,5 | = | 18 | как Cl | |
Бикарбонат в виде CaCO 3 | 120 = | 2.4 | = | 146 | как HCO 3 | |
Натрий (разница) в виде Na | 0,9 | = | 21 | как Na | ||
Всего растворенных твердых веществ | 4.9 | 4,9 | 353 | |||
Конверсии и Руководства — Эквиваленты CaCO3 в химии воды | Нанкред Инжиниринг
Умножьте мг / л веществ, перечисленных ниже, на соответствующие коэффициенты, чтобы получить мг / л как CaCO3. Например, 70 мг / л Mg + + будет (70) (4 10) = 287 мг / л в пересчете на CaCO3. Также см. Наш полезный онлайн-калькулятор общей твердости.
| вещество | фактор | вещество | фактор |
| Al + + + | 5,56 | К + | 1,28 |
| Al2 (SO4) 3 (а) | 0,88 | KCl | 0,67 |
| Al2 (SO4) 3 (а) | 0,88 | KCl | 0,67 |
| AlCl3 | 1,13 | K2CO3 | 0,72 |
| Al (OH) 3 | 1.92 | мг + + | 4,10 |
| Ba + + | 0,73 | MgCl2 | 1,05 |
| Ba (OH) 2 | 0,59 | MgCO3 | 1,19 |
| BaSO4 | 0,43 | Мг (HCO3) 2 | 0,68 |
| Ca + + | 2,50 | MgO | 2,48 |
| CaCl2 | 0,90 | Мг (OH) 2 | 1.71 |
| CaCO3 | 1,00 | Мг (NO3) 2 | 0,67 |
| Ca (HCO3) 2 | 0,62 | MgSO4 | 0,83 |
| CaO | 1,79 | Пн + + | 1,82 |
| Са (ОН) 2 | 1,35 | Na + | 2,18 |
| CaSO4 (а) | 0,74 | NaCl | 0,85 |
| Класс — | 1.41 | Na2CO3 | 0,94 |
| CO2 | 2,27 | NaHCO3 | 0.60 |
| CO – 3 | 1,67 | NaNO3 | 0,59 |
| Cu + + | 1,57 | NaOH | 1,25 |
| Cu + + + | 2,36 | Na2SO4 (а) | 0,70 |
| CuSO4 | 0,63 | Nh4 | 2.94 |
| Ф- | 2,66 | Nh5 | 2,78 |
| Fe + + | 1,79 | Nh5OH | 1,43 |
| Fe + + + | 2,69 | (Nh5) 2SO4 | 0,76 |
| Fe (OH) 3 | 1,41 | НО-3 | 0,81 |
| FeSO4 (а) | 0,66 | OH | 2,94 |
| Fe2 (SO4) 3 | 0.75 | ПО — 4 | 1,58 |
| FeCl3 | 0,93 | SO – 4 | 1,04 |
| H + | 50,0 | Zn + + | 1,54 |
| HCO-3 | 0,82 |
(а) Anydrous
Вы также можете воспользоваться нашими счетчиками промышленной воды:
Нужна техническая вода? Кто-то может спроектировать или определить размеры промышленного оборудования для очистки воды? Свяжитесь с нами по info @ nancrede.com или позвоните нам по телефону +1 888 56-WATER (569-2837) для получения запасных частей или обслуживания сегодня же! Мы обслуживаем Индианаполис, Индиану, Средний Запад и всю территорию США
Свяжитесь с нами сейчас Получить предложение
Жесткая вода и информация о жесткости воды
Что такое жесткая вода?
Жесткая вода — это вода с высоким содержанием растворенных минералов, в основном кальция (Ca). и в меньшей степени магний (Mg). По мере того, как дождевая вода стекает по мягким камням, таким как мел и известняк, некоторые минералы в породах становятся растворяется в воде, делая ее «жесткой».Твердые породы, такие как гранит, с трудом растворяются в воде, поэтому участки с твердыми породами, например В Шотландии и на юго-западе Англии вода мягкая.
Как измеряется жесткость воды?
Жесткость воды измеряется количеством минералов жесткости, кальция (Ca) и магния (Mg), растворенных в воде. Чем больше растворенных минералов, тем жестче вода.
В Великобритании жесткость воды обычно выражается в миллиграммах на литр эквивалента карбоната кальция (мг / л CaCO 3 ).Эквивалент карбоната кальция — это выражение общего количества кальция, магния и других минералов с незначительной жесткостью в данном объеме воды.
Другие измерения жесткости воды включают в себя градусы общей жесткости (dGH), немецкие градусы (° dH), английские градусы (° e), Французские градусы (° F), градусы Кларка (° Кларк), доли на миллион (ppm) и зерна на галлон (gpg). И эти различные измерения указывают на то, что количество эквивалента карбоната кальция (CaCO 3 ), количество оксида кальция (CaO) или количество кальция (Ca 2+ ) в заданном объеме воды.
| Жесткость | мг / л CaCO 3 |
|---|---|
| Очень жесткая | Более 300 |
| Жесткая | 201-300 |
| Средняя | — 200|
| Слегка твердый | 101-150 |
| Умеренно мягкий | 51-100 |
| Мягкий | 0-50 |
Как узнать, есть ли у меня жесткая вода?
Шестьдесят процентов домов в Великобритании имеют жесткую воду.Чтобы узнать, живете ли вы в районе с жесткой водой, посмотрите нашу карту ниже или выполните простой тест на мыло. Чтобы провести тест на мыло, возьмите пустую бутылку на 500 мл, наполните ее на четверть водопроводной водой, добавьте десять капель жидкость для стирки, закройте крышку и встряхните. Если бутылка наполнена пеной, проблем с жесткой водой нет. Как вариант, поищите на дне чайника белые известковые чешуйки — верный признак жесткой воды.
Каковы последствия жесткой воды?
Когда жесткая вода нагревается выше 61 ° C или остается испариться, растворенные минералы жесткости выпадает из воды и образует известковый налет.Накипь забивает трубы и насадки для душа, снижает эффективность нагревательных элементов, оставляет неприглядное образование белого налета в чайниках и кранах, а также полосы на посуде, столовых приборах и стаканах. Жесткая вода также затрудняет использование мыла пенится и оставляет накипь в раковинах, бассейнах и ваннах.
Можно ли пить жесткую воду?
Хотя жесткая вода вредна для сантехнических систем и кухонных приборов, нет никаких доказательств того, что она вредна для вашего здоровье.