3.1 Определение щелочности воды
Щелочность воды определяются присутствием соединений, взаимодействующих с сильными кислотами. Это могут быть свободные гидроксиды (в производственных сточных водах) или соли, образованные слабыми кислотами и сильными основаниями (например, гидрокарбонаты, карбонаты, силикаты, сульфиды, ацетаты щелочных металлов). Щелочность, обусловленная наличием растворимых гидроксидов (ионами ОН—), называется гидратной щелочностью.
В природных водах щелочность обычно вызывается гидрокарбонатами НСО3— (гидрокарбонатная), в щелочных водах – также и карбонатами СО32- (карбонатная).
Щелочность воды характеризуется количеством кислоты, необходимым для нейтрализации 1 л воды. Выражается она в мг-экв/л.
Различают свободную и общую щелочностью воды. Если рН исследуемой воды более 8,3, то считается, что вода имеет свободную щелочность. Ее величина определяется количеством кислоты, необходимым для нейтрализации компонентов щелочности (
Определение щелочности воды проводится непосредственно после отбора пробы или не позднее 24 часов при условии хранения воды в закрытой посуде, заполненной под пробку.
Затруднения при проведении анализа и получение неточных результатов может быть вызвано наличием взвешенных веществ, свободной углекислоты, хлора и гипохлоритов, соединений, обуславливающих цветность воды. Мешающее влияние взвешенных веществ, устраняется фильтрованием воды. Гипохлориты и свободный хлор вызывают обесцвечивание кислотно-щелочных индикаторов, поэтому они предварительно восстанавливаются 0,1н раствором тиосульфата натрия, взятом в эквивалентном количестве. Иногда для удаления гипохлоритов используют 3%-ный раствор пероксида водорода. Цветность воды может быть снижена при фильтровании ее через слой активированного угля или макропористого анионита. Свободный углекислый газ удаляется путем продувания воздуха через анализируемую воду. Если в воде наряду с гидрокарбонатами в заметном количестве присутствуют гидросиликаты, силикаты, гидросульфиты, сульфиды или другие соединения, вызывающие щелочность воды, то для вычислений карбонатной (гидрокарбонатной) щелочности необходимо вычесть из полученного результата данные, полученные при определении этих компонентов (в мг-экв/л). Для вод с малой величиной щелочности для получения более точного результата (менее 0,2 мг-экв/л) необходимо использовать 0,05 н растворы кислот (соляной или серной).
Определение щелочности воды может проводиться объемным методом нейтрализации и электрометрическим (по величине рН).
3.1.1 Определение свободной щелочности
Свободная щелочность определяется объемным методом путем титрования пробы воды 0,1 н раствором соляной или серной кислоты в присутствии индикатора фенолфталеина.
При использовании электрического метода (для мутных и окрашенных вод) титрование пробы воды ведется до достижения величины рН. Равной 8,3.
а) Индикаторный метод
Реактивы:
1) 0,1 н раствор НСl;
2) фенолфталеин (1 %-ный раствор в 60 %-ном этиловом спирте).
Ход работы. В коническую колбу емкостью 250 мл отмерить 100 мл исследуемой воды. При значительной величине свободной щелочности объем пробы воды уменьшается и доводится до 100 мл прокипяченной дистиллированной водой. Прибавить 5-8 капельфенолфталеина. Пробу титровать 0,1 н раствором соляной кислоты до исчезновения розовой окраски. И рассчитать свободную щелочность по формуле:
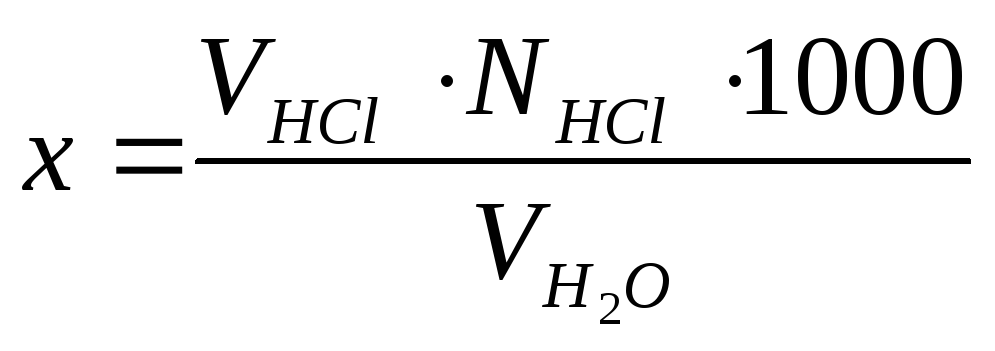 ,
,
где х – свободная щелочность воды, мг-экв/л
VHCl – объем рабочего раствора НСl, пошедший на титрование пробы, мл;
NHCl – нормальность рабочего раствора НСl, г-экв/л;
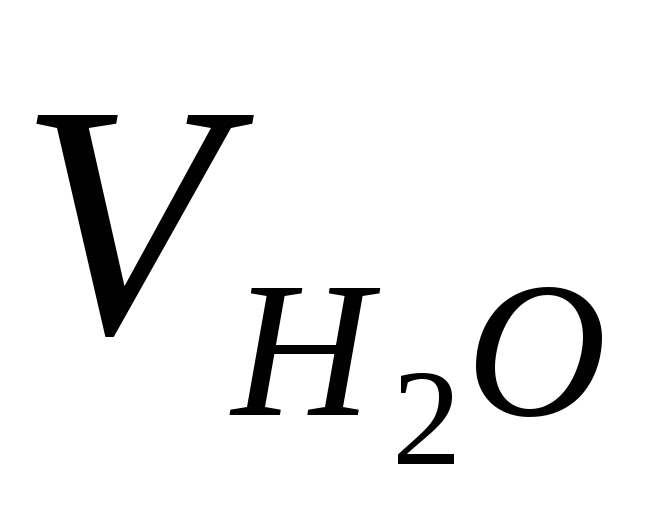 –
объем
пробы исследуемой воды, мл.
–
объем
пробы исследуемой воды, мл.б) Электрометрический метод
Приборы и реактивы:
рН–метр лабораторный;
магнитная мешалка;
0,1 н раствор HCl.
Ход работы. В химический стакан отмерить 100 см3 исследуемой воды и опустить в нее электроды рН–метра. В пробу воды при постоянном перемешивании (магнитной мешалкой) добавлять по каплям 0,1 н раствор НСl до достижения величины рН, равной 8,3. (Электроды после выполнения работы тщательно промыть и опустить в стакан с дистиллированной водой). Расчет общей щелочности ведется по вышеприведенной формуле.
Методика определения щёлочности питательной воды и ее составляющих котловых вод, исходной и охлаждающей воды
Лабораторная работа №1
Тема: Методика определения щёлочности питательной воды и ее составляющих котловых вод, исходной и охлаждающей воды
Методика предназначена для определения общей щелочности. Общая щёлочность воды Що – суммарная концентрация в воде растворимых гидроксидов и анионов слабых кислот HCO3 – CO2 за вычетом концентрации ионов водорода. (В котловой воде также – фосфатов и силикатов). Общую щёлочность выражают миллиграмм-эквивалентах на дм
Нормы точности измерений
Допустимые значения погрешности результатов определения щёлочности с доверительной вероятностью Р=0,95 приведены в таблице 1.1:
Таблица 1.1 — Допустимые значения погрешности результатов определения щёлочности
При титровании 0,1н раствором кислоты | При титровании 0,01н раствором кислоты | ||
Щёлочность мг-экв/дм3 | Погрешность % | Щёлочность мг-экв/дм3 | Погрешность % |
0,1 0,02 0,5 1,0 2,0 5,0 10,0 | 20-30 15-20 10-15 5-10 2-5 1-2 | 20 50 100 200 500 1000 | 30-40 15-20 7-8 3-5 1,5-2 0,5-1 |
Методы измерений
Определение щелочности воды основано на титровании воды кислотой в присутствии индикаторов: фенолфталеина, метилоранжа, смешанного состоящего из метиленового голубого и метиленового красного в определённых соотношениях. Значения рН, при изменении окраски этих, индикаторов таковы:
для фенолфталеина-8,2;
для метиленового оранжевого – 4,4;
для смешанного – 5,6.
Соляная или серная кислота, фиксанал;
Фенолфталеин;
Метиловый оранжевый;
Метиловый красный;
Метиленовый голубой;
Спирт этиловый;
Вода дистиллированная или конденсат;
Пипетки измерительные на 100см3;
Колба мерная на 100, 1000см3;
Цилиндр 100 см ;
Колба коническая на 250см3;
Бюретка для титрования на 25см3;
Воронка;
Весы лабораторные общего назначения 1 и 2 классов точности;
Весы аналитические;
Фильтры беззольные.
Требования безопасности
К работе в лаборатории допускается персонал, который прошел инструктаж по ТБ (технике безопасности), теоретическую подготовку по новой профессии с обучением на рабочем месте 1 месяц, проверке знаний действующих правил техники безопасности и специальных инструкций.
При работе с концентрированными кислотами необходимо:
Работать под вытяжным шкафом.
Работать в защитных средствах (очки, фартук прорезиненный, перчатки).
Иметь нейтрализующие средства.
При попадании кислоты на кожу необходимо:
снять кислоту тампоном ваты или бинта;
промыть поражённое место сильной струёй воды;
нейтрализовать 2%-ным раствором питьевой соды.
При попадании кислоты в глаза:
промыть сильной струёй воды;
нейтрализовать 0,5%-ным раствором питьевой соды;
отправить пострадавшего к врачу.
Разлитую кислоту засыпать немедленно песком, нейтрализовать известью, мелом или кальцинированной содой.
Требования к обслуживающему персоналу
К выполнению анализа допускаются персонал имеющий среднее, среднетехническое или высшее образование. При отсутствии специального химического образования необходимо пройти теоретическую подготовку по новой профессии с обучением на рабочем месте в течение месяца, изучить правила эксплуатации электрических станций, сдать экзамен и пройти дублирование в течение 2-х недель на рабочем месте.
Подготовка к проведению измерений
Выполнение анализа проводится при температуре 23 +/- 2 оС при атмосферном давлении.
Если в анализируемой воде присутствуют взвешенные вещества, то пробу необходимо отфильтровать.
Титрованный раствор соляной или серной кислоты 0,1н концентрации готовят из соответствующего фиксанала:
Раствор 0,01 концентрации готовят разбавлением 0,1н раствора. Каждый раствор переливают в склянку с присоединенной к ней бюреткой. Растворы устойчивы.
Раствор индикатора фенолфталеина 1%-ной концентрации: Растворяют 1г индикатора в 80 см3 этилового спирта и доводят до 100 см3 дистиллированной водой.
Раствор устойчив, его хранят в склянке с хорошо закрывающейся пробкой. Для повседневного расхода часть раствора индикатора отливают в капельницу.
Раствор индикатора метилового оранжевого 0,1%-ной концентрации: растворяют 0,1г индикатора в мерной колбе вместимостью 100 см3 в 80 мл горячей дистиллированной воды;
после охлаждения доводят объём до метки дистиллированной водой. Тщательно перемешивают.
Раствор устойчив, его хранят в склянке с хорошо закрывающейся пробкой. Для повседневного расхода часть раствора индикатора отливают в капельницу.
Раствор смешанного индикатора готовят смешиванием равных объёмов раствора индикатора метилового красного и метиленового голубого.
Раствор индикатора метилового красного: растворяют 0,2 г метилового красного в 100 см3 этилового спирта. Раствор устойчив, его хранят в склянке с хорошо закрывающейся пробкой.
Раствор индикатора метиленового голубого: Растворяют при слабом нагревании 0,1 г метиленового голубого в 100 см3 этилового спирта. Раствор устойчив, его хранят в склянке с хорошо закрывающейся пробкой.
Выполнение измерений
В коническую колбу вместимостью на 250 см. куб. пипеткой или мерным цилиндром отбирают 100см3 анализируемой воды прибавляют индикатор и титруют раствором соляной или серной кислоты.
Титрование выполняют 0,1 н раствором кислоты из обычной бюретки, если щёлочность анализируемой жидкости превышает 1мг-экв/дм3. Титрование выполняют из микробюретки и применяют 0,01 н раствор кислоты, при определении щелочности меньше 1мг-экв/дм3.
При титровании в присутствии фенолфталеина (5-7 капель) первоначальная розовая или красно-малиновая окраска, раствора должна полностью исчезнуть.
При титровании в присутствии смешанного индикатора (3-5капель) первоначальная зелёная окраска раствора в эквивалентной точке изменяют в фиолетовую.
При титровании в присутствии метилового оранжевого (3-5капель) первоначальная желтая окраска переходит в апельсиновую (достижение красной окраски свидетельствует об излишке прибавленной кислоты – проба перетитрована).
Для получения более надёжных результатов рекомендуется проводить титрование двух параллельных проб анализируемой воды. Расхождение между параллельными определениями не должно превышать 0,1 см. куб. титрованного раствора кислоты.
Вычисление результатов
Величина щелочности по взятому индикатору определяется по формуле:
а х 0,1 х 1000 а х 0,01 х 1000 х 1000
М=_____________________ М1=________________________________
V V
где М – щёлочность, мг-экв/дм3;
М1 – щёлочность, мкг-экв/дм3;
а – расход кислоты на титрование со взятым индикатором, см3;
V – объем воды, взятой для анализа, см3;
0,1 и 0,01 – концентрации титрованных растворов кислот;
1000 х 1000 – пересчёт к 1 дм3.
Щелочность воды: что это такое, норма, расчет

11 сентября 2018 / 9788 просмотров
Когда заходит речь о качестве питьевой воды, мы, прежде всего, обращаем внимание на отсутствие вредных примесей, цвет, запах и т.п. А вот о важности такого показателя как щёлочность воды знают далеко не все. В этой статье мы попробуем разобраться, почему норма щёлочности воды так важна для нашего с вами здоровья, как она определяется и как достичь оптимальных показателей щёлочности воды.
Определение щёлочности: немного теории
Для начала попробуем разобраться, что же собственно такое «щёлочность воды». Справочная литература предлагает такое определение щёлочности: это общее число содержащихся в воде гидроксильных ионов, а также анионов слабых кислот. Щёлочность воды может быть гидратная, карбонатная, бикарбонатная, в зависимости от наличия в ней определённых веществ. Также следует разграничить понятие «щёлочность воды» и её водородный показатель (pH). Он показывает концентрацию в воде свободных ионов водорода. Если pH низкий (< 7), то мы говорим о кислой среде, если высокий (>7) – о щелочной. Взаимосвязь pH и щёлочности прямопропорциональна: чем больше щёлочность воды, тем выше показатель pH. Щёлочность измеряется в ммоль/дм3, а рН – просто число единиц.
Согласно Государственным санитарным нормам, оптимальный показатель pH для питьевой воды от 6,5 до 8,5 единиц. Это совпадает с требованиями, применяющимися для контроля качества питьевой воды в США. Нормативы ЕС в этом вопросе отличаются несущественно (от 6,5 до 9,5). Показатель дистиллированной воды – 7 единиц. Это условно нейтральная вода. Показатели pH питьевой воды строго контролируются во всех странах.
А вот нормы щёлочности воды украинскими Государственными санитарными нормами не регулируются. Хотя и учитываются на предприятиях водоснабжения для правильного расчета реагентов, которые используют для обработки воды.
Относительно расчёта щёлочности воды стоит отметить, что оптимальные нормы немного отличаются в зависимости от того, для каких нужд используется вода.

Значение нормы щёлочности воды
Давайте попробуем разобраться, почему такое большое значение придаётся нормам щёлочности воды? Оказывается, от щёлочности воды напрямую зависит состояние нашего организма. Оптимальная норма щёлочности воды поможет наладить такие функции организма:
- обменные процессы
- восстановление микрофлоры кишечника
- активизация мозговой деятельности за счёт обогащения мозга кислородом
- укрепление иммунитета
Это неудивительно, поскольку в самом организме человека преобладают нейтральные или слабощелочные жидкости. Интересно, что pH человеческой крови составляет 7,43 (т.е. практически нейтрален).
Поэтому очень важным является определение щёлочности питьевой воды и контроль этих показателей.
Японские учёные установили, что если человек постоянно употребляет воду щёлочностью 6,5 – 7, то продолжительность жизни увеличивается на 20 – 30%. Дело в том, что кислая среда (низкая щёлочность воды) создаёт идеальные условия для развития различных болезней.
Для поддержания нормального кислотно-щелочного баланса и хорошего самочувствия важно «не закислять» организм. Но проблема в том, что большинство продуктов имеют кислую среду. А значит, для поддержания баланса важно пить воду, именно она способствует тому, что кровь может переносить больше кислорода. Но полезна не всякая вода. В первую очередь нужно обращать внимание на её щёлочность. Лучше, если она близка к нейтральной. Государственные санитарные нормы регламентируют щёлочность питьевой бутилированной воды и воды из бюветов на уровне 6,5 ммоль/дм3. Норма щёлочности воды, поступающей в централизованные водопроводные системы, регулируется ещё на этапе водоподготовки. Повышенная кислотность может наблюдаться в сильно загрязнённых природных водах (например, после сброса отходов промышленных предприятий, когда в воду попадает большое количество сильных кислот и их солей).

Кстати, вода повышенной щёлочности также не слишком полезна. Так, после водных процедур в такой воде может появляться:
- зуд на коже
- высыпания
- раздражения на слизистых
Расчёт щёлочности воды и регулирование уровня рН
В разных регионах уровень pH водопроводной воды колеблется от 5,5 до 10 единиц. При необходимости этот показатель можно и нужно регулировать. Для измерения рН в домашних условиях можно использовать специальные тестеры. А вот для определения щёлочности воды понадобиться сдать образцы на анализ воды в специализированную лабораторию. После того, как вы получите результаты исследования, специалисты «УкрХимАнализ» дадут необходимые рекомендации. Если вода имеет повышенную щёлочность, то эффективным способом её снижения может стать фильтр. Хорошо справляются с данной проблемой, в частности, системы обратного осмоса. Они помогают не только снизить щёлочность воды, но и нормализовать её состав в целом, уменьшить минерализацию и жёсткость.
У Вас есть вопросы или Вам нужна консультация?
Заполните форму и получите бесплатную консультацию!
Читайте похожие статьи:
Ph воды — щелочность воды, нормы и расчет
Человек оценивает качество питьевой воды по двум основным показателям – цвету и запаху. Но есть не менее важные свойства, которые напрямую влияют на то, можно ли считать воду пригодной для питья. Особенно это касается щелочности, о которой осведомлены далеко не все. В данной статье мы постараемся разобраться в том, какая норма допустима, как ее определить и каким образом привести уровень щелочности к оптимальным показателям.

Что такое щелочность воды?
Во-первых, следует определиться с тем, что из себя представляет данное понятие. Если обращаться к учебникам, щелочность – это число гидроксильных ионов, которые содержатся в воде, и анионов слабых кислот. Следует отметить, что щелочной называется та среда, в которой водородный показатель превышает значение 7. Все, что ниже – это кислая среда. При этом щелочность и pH связаны напрямую – чем больше первый показатель, тем выше и второй. Щелочность измеряется в ммоль/дм³, pH – в единицах.
В соответствии с европейскими санитарными нормами допустимым значением pH для питьевой воды является диапазон 6,5-8,5 единиц, дистиллированной, то есть условно нейтральной – 7 единиц. Предельно допустимой концентрацией по щелочности согласно нормам СанПиН является значение 4,4 ммоль/дм³. Это касается нецентрализованных источников водоснабжения.
Каким образом показатели щелочности могут влиять на организм?
Нормам щелочности придается большое значение и тому есть важная причина – ее уровень напрямую влияет на состояние организма. Оптимальный показатель поможет стабилизировать различные функции организма, включая обменные процессы, а также активизировать мозговую деятельность.

Однако, в случае превышения установленной нормами концентрации возможно возникновение ряда проблем: зуда, высыпания, раздражения слизистой оболочки. Именно поэтому столь важно определять щелочность питьевой воды и контролировать эти показатели.
Сохранение кислотно-щелочного баланса возможно благодаря оптимизации рациона, однако сложность в том, что большая часть продуктов имеет в своем составе кислую среду, поэтому важно также пить и воду, что увеличит объем переносимого кровью кислорода. Но подойдет не всякая вода, а со значениями, близкими к нейтральным.
Определение щелочности и регулирование уровня pH
Уровень pH может колебаться и зависит от региона. В случае превышения допустимых значений необходимо уделить внимание их стабилизации. Для измерения уровня pH в домашних условиях используются специальные тестеры, но для определения щелочности не обойтись без услуг профессиональных лабораторий, оснащенных современным оборудованием и имеющих необходимый уровень аккредитации.
После проведения исследования специалисты предоставят рекомендации по поддержанию уровня щелочности. В случае его превышения – помогут выбрать решение для его снижения за счет использования специальных фильтров. В частности, с этой проблемой эффективно справляются системы обратного осмоса, которые не только стабилизируют показатели, но также нормализуют состав воды, уменьшая жесткость и минерализацию.
Подробная информация об услуге в разделеАнализ водыМетодика определения щелочности
Щелочность природной и химической воды обусловливается наличием в ней солей слабых органических кислот.
Щелочность котловой воды обусловлена присутствием в ней едких щелочей, соды. Количество кислоты, требующиеся на полную нейтрализацию щелочных соединений в присутствии метилового оранжевого, содержащихся в 100 мл воды дает щелочность воды.
Реактивы:
1)раствор HCl или H2SO4 (0,1H или 0,01 Н конц)
2)Индикаторы: 1% раствор фенолфталеина,
0,1% раствор метилоранжа.
Приготовление растворов:
1% раствор фенолфтолеина.
Взвешиваем навеску 1 г фенолфталеина, переносим в мерную колбу и доводим до 100 мл спиртом.
0,1% раствора метилового оранжевого
0,1 г метилоранжа переносим в колбу и растворяем в 100 мл горячей воды.
Определение щелочности химически очищенной и сырой воды.
Отмеряем 100 мл Н2О, переливаем в колбу на 250 мл. Туда же добавляем 2 капли фенолфталеина и 2 капли метилоранжа и титруем при интенсивном помешивании раствором кислоты до перехода желтой окраски в оранжевую.
Щ = a K N 1000
V
a – объем кислоты, пошедшей на титриванние.
K – поправочный коэффициент (К=1)
N – нормальная концентрация кислоты
V – объем взятой пробы.
Определение щелочности котловой воды
Взятую пробу нужно охладить до 300С.
Берем 100 мл котловой воды и помещаем в колбу на 250 мл. Добавляем 2 к фенолфталеина и при появлении малиновой окраски титруем 0,1 Н раствором кислоты до обесцвечивания. Отмечаем расход кислоты, затем в эту же воду добавляем 2к метилоранжа, получаем желтое окрашивание. Титруем 0,1 Н раствором кислоты до перехода окраски в оранжевую, затем вычитываем расход кислоты, суммируя результаты подсчетов.
Титрирование ведется при интенсивном помешивании пробы.
Щоб = Щпоф\ф + Щ м.о
(по фенолфталеину) (по метилоранжу)
Общий анализ щелочности складывается из 2-х показателей щелочности: Щ поф-ф показывали содержание гидратной щелочности, Щ по м.о – наличие карбонатной и бикорбанатной щелочности.
Определение содержания хлоридов воде
Реактивы:
1)AgNO3 нитрат серебра4)10% раствор K2CrO4 хромат калия
2)0.1H NaOH 5)NaCl
3)0.1 H H2SO4 6)1% раствор фенолфталеина
Метод основан на титрировании воды, содержащей хлориды, раствором AgNO3 в присутствии K2CrO4. После того, как все ионы Cl осаждаются в виде AgCl, индикатор реагирует с избытком AgNO3 с образованием окрашиваемого в бурый цвет хромата Ag, появление которого указывает на конец реакции.
NaCl + 2AgNO3=AgCl + NaNО3
K2CrO4 + 2AgNO3=2KNO3 + Ag2CrO4
Анализ:
берем 100 мл воды в колбу на 250 мл, добавляем 10 капель K2CrO4, тируем азотнокислым серебром ( AgNO3)до перехода окраски от желтой к грязно-бурой.
Cl = a*10
Cl = a*Т*1000
V
a – объем пошедшего на титрирование AgNO3
V – объем взятой пробы
Т – титр ( равен 1)
При определении хлоридов в котловой воде, до проведения основного анализа, пробу необходимо проверить на наличие щелочной среды по фенолфталеину и кислой – по метилоранжу ( Пробу можно проводить капельным методом). Если среда щелочная, ее нейтрализуют 0,1Н раствором H2SO4, если кислая 0,1 Н раствором NaOH.
При определении хлоридов в котловой воде, берут 100 мл воды, добавляют 2к феноллфталеина, тирируют 0,1 Н H2SO4, затем добавляют 10 капель K2CrO4 и титруют до изменения окраски от желтой до бурой.
Приготовление реактивов:
раствор AgNo3
Навеску 4,8 г переносим в мерную колбу доводим до 1 литра дистиллированной водой.
0,1Н раствор NaOH
0.1H раствор H2SO4 используют готовые
NaCl
3.10 % раствор K2CrO4. Хромат калия
Навеску массой 10 гр переносим в мерную колбу и доводим до 100 мл дистиллированной водой.
Определение титра AgNo3
Поправочный коэффициент AgNo3 (или титр) определяем по раствору NaCl, который содержит 1 мг Cl в 1 мл.
Для этого в 2-3 колбы на 250 мл отбираем точно по 10 мл раствора NaCl, прибавляем по 90 мл дистиллированной воды, добавляем по 5 капель 10 % раствора K2CrO4. и титруем раствором AgNo3 до появления грязно-бурого цвета. Для расчета принимаются совпадающие результаты титрирования.
К=10
а
а – расход AgNo3, пошедшего на титрирование
10 – количество NaCl, взятого для титрироания.
Определение солесодержания в питат. воде.
Берем 250 мл воды. В 100 мл определяем щелочность, оставшиеся 150 мл пропускают через лабораторный фильтр. Первую порцию в 100 мл сбрасывают, а в двух других по 25 мл определяем кислотность. Для этого в колбы, в обе пробы добавляют по 2 капли метилоранжа и титруют 0,1 Н раствором NaOH до появления желтого окрашивания.
К п.в = 4а
К п.в = a*N*1000
V
а – объем щелочи, пошедшего на титрирование
К п.в – коэффициент питат. воды, рассчитывается по формуле:
С п.в = (Щ п.в+К п.в)*700 в мг/л
Определение солесодержания в котловой воде лабораторным фильтром.
Из пробы котловой воды вначале определяем щелочность. Берем 50 мл котловой воды и разбавляем 100 мл дистиллированной воды. Разбавленную пробу котловой воды пропускают через лабораторный фильтр. Первые порции сбрасывают. Затем берем 2 пробы по 25 мл, добавляем по 2 капли метилоранжа и титруем 0,1 Н раствором NaOH до перехода окраски.
К в.п = а*12
а- количество NaOH, пошедшего на титрирование.
Подсчитываем солесодержание котловой воды.
С кв = (Щ кв+К кв)*70 мг/кг
Определение содержания О2 в воде.
Применяемые реактивы:
Глицериновый раствор метиленового голубого
30 % водный раствор КОН (ГИДРОКСИД КАЛИЯ)
Восстановленный раствор метиленового голубого
Стандартный раствор метиленового голубого.
Проба воды должна быть отобрана таким образом, чтобы вода не соприкасалась с воздухом.
Берется колба объёмом 250 мл и ставится на дно ведерка или кувшина. На дно колбы опускаем резиновый шланг, другой конец которого одевается на пробоотборник. В этом месте не должно быть присосов воздуха.
Открываем пробоотборный кран и вода через шланг поступает в колбу вытесняя из неё воздух, постепенно заполняя ведёрко. Как только слой воды поднимется над колбой, то не вынимая колбу из воды, добавляем пипеткой раствор метиленового голубого из расчета 2 мл. на 100 мл. воды. Затем под водой закрываем колбу пробкой и после этого достаем колбу и встряхиваем.Сравниваем цвет со шкалой стандартов. Интенсивность окрашивния от бледно-зеленоватого до ярко-синего.
ПРИГОТОВЛЕНИЕ РЕАКТИВОВ
Норма щелочности воды — что это такое и расчет
В таблицах СанПиН РФ («Питьевая вода») предельно допустимая концентрация по щелочным показателям не указывается, поэтому большинство источников при определении нормы щёлочности воды ссылаются на стандарты ВОЗ, директиву ЕС или санитарные правила стран со сходным нормативным порядком.
Так, величина в 30 мг НСО3-/л устанавливается в ЕС-директиве при определении качества предназначенной для потребления человеком воды. В украинских актуальных правилах ГСанПиН для водопроводной воды параметр не устанавливается, а величина в < 6,5 ммоль/м3 указывается только для фасованной и бюветной воды. Приведённые в российских тематических источниках значения чаще всего варьируются в пределах от 0,5 до тех же 6,5 ммоль/м3.
При этом существует ГОСТ 31957-2012 – Межгосударственный стандарт, подписанный органами по стандартизации 6 стран и модифицированный по отношению к другим международным стандартам. Россия, наряду с Арменией, Казахстаном, Киргизией, Таджикистаном, Узбекистаном, входит в число стран, подписавших документ, в котором описываются методы определения щёлочности в концентрации 0,1-100 ммоль/дм3.
Определение и содержание понятия
Щёлочностью воды («Щ» в формулах) называют сумму содержащихся в ней веществ – гидроксильных ионов/анионов слабых кислот, – вступающих с сильными кислотами в реакцию с разделением на:
- бикарбонатную (Щб),
- карбонатную (Щк),
- гидратную (Щг),.
Единица измерения – миллиграмм-эквивалент кислоты, записывающийся как мг-экв/л. Общая щёлочность как сумма анионов слабых кислот – силикатов, боратов, карбонатов, гидрокарбонатов, сульфидов, гидросульфидов, сульфитов, гидросульфитов, фосфатов, анионов гуминовых кислот) – это способность связывать сильные кислоты (их эквивалентное количество). Концентрация некоторых ионов незначительна, поэтому, когда говорят об общей щёлочности, то имеют в виду, главным образом, карбонатный тип (определяющийся ионами угольной кислоты), где гидролизованные анионы образуют гидроксид-ионы:
Щелочной показатель для поверхностных вод связывают с присутствием в них в основном гидрокарбонатов щелочноземельных металлов (и щелочных – в меньшей степени), и для природных вод с pH < 8,3 он определяется концентрацией гидрокарбонатов магния и кальция. При определённой обработке водоресурса и при pH >8,5 происходит возникновение гидратного типа.
Щелочной параметр необходим для:
- определения содержания карбонатов, а также баланса угольной кислоты (вместе с рН),
- дозирования химических веществ, применяемых в водоснабжении,
- реагентной очистке,
- установлении пригодности водоресурса для ирригации (при избытке щелочноземельных металлов).
Северные районы России с низкими щелочными показателями и pH для природной воды характеризуются повышенной коррозионной агрессивностью, от которой страдают трубопроводы и конструкции из черных металлов и бетона.
По мнению японских исследователей, в районах, где пьют более щелочную воду (выше показателя 6,5, но ниже 9) продолжительность жизни выше на 20-30%. В целом щелочные показатели должны быть достаточными для прохождения химической коагуляции, однако при этом они не должны быть слишком высокими, чтобы не провоцировать физиологические расстройства у водопотребителей. Минимальные щелочные значения составляют +/- 30 мг/л, а максимальные в пределах 450-500 мг/л.
Распространившееся среди обладателей различных модифицированных аэраторов мнение об их влиянии на щелочные свойства гидропотока не подтверждается. Эти аэраторы-экономители (http://water-save.com/) позволяют сократить водорасход, но не влияют на химические характеристики водоресурса.
Методы определения концентрации карбонатов
В межгосударственном стандарте описаны 2 титриметрических метода расчёта щёлочности воды:
- Свободная и общая щёлочность. Для питьевой – расфасованной (негазированной) и из источников питьевого водоснабжения, – природной, а также сточной вод путём титрования (постепенного смешивания) до значения pH 8,3, а также 4,5. Полученные значения применяются для расчётов концентрации карбонатов (в диапазоне 6-6000 мг/дм3) и гидрокарбонатов (6,1-6100 мг/дм3).
- Карбонатная щёлочность. Для воды питьевой, природной, технической на разных стадиях технологических процессов путём титрования до pH 5,4 ед.
Конечная точка титрования определяется при изменении значения на рН-метре или окраски индикатора:
- рН-переход от розового к бесцветному при 8,3-8,0 даёт величину параметра «по фенолфталеину»,
- рН-переход от оранжевого к жёлтому при 4,4 даёт величину параметра «по метиловому оранжевому».
Равным нулю параметр принимается, если для анализируемой пробы рН<4,5.
Читайте далее
Оставьте комментарий и вступите в дискуссию
| На главную | База 1 | База 2 | База 3 |
| Поиск по реквизитамПоиск по номеру документаПоиск по названию документаПоиск по тексту документа |
| Искать все виды документовДокументы неопределённого видаISOАвиационные правилаАльбомАпелляционное определениеАТКАТК-РЭАТПЭАТРВИВМРВМУВНВНиРВНКРВНМДВНПВНПБВНТМ/МЧМ СССРВНТПВНТП/МПСВНЭВОМВПНРМВППБВРДВРДСВременное положениеВременное руководствоВременные методические рекомендацииВременные нормативыВременные рекомендацииВременные указанияВременный порядокВрТЕРВрТЕРрВрТЭСНВрТЭСНрВСНВСН АСВСН ВКВСН-АПКВСПВСТПВТУВТУ МММПВТУ НКММПВУП СНЭВУППВУТПВыпускГКИНПГКИНП (ОНТА)ГНГОСТГОСТ CEN/TRГОСТ CISPRГОСТ ENГОСТ EN ISOГОСТ EN/TSГОСТ IECГОСТ IEC/PASГОСТ IEC/TRГОСТ IEC/TSГОСТ ISOГОСТ ISO GuideГОСТ ISO/DISГОСТ ISO/HL7ГОСТ ISO/IECГОСТ ISO/IEC GuideГОСТ ISO/TRГОСТ ISO/TSГОСТ OIML RГОСТ ЕНГОСТ ИСОГОСТ ИСО/МЭКГОСТ ИСО/ТОГОСТ ИСО/ТСГОСТ МЭКГОСТ РГОСТ Р ЕНГОСТ Р ЕН ИСОГОСТ Р ИСОГОСТ Р ИСО/HL7ГОСТ Р ИСО/АСТМГОСТ Р ИСО/МЭКГОСТ Р ИСО/МЭК МФСГОСТ Р ИСО/МЭК ТОГОСТ Р ИСО/ТОГОСТ Р ИСО/ТСГОСТ Р ИСО/ТУГОСТ Р МЭКГОСТ Р МЭК/ТОГОСТ Р МЭК/ТСГОСТ ЭД1ГСНГСНрГСССДГЭСНГЭСНмГЭСНмрГЭСНмтГЭСНпГЭСНПиТЕРГЭСНПиТЕРрГЭСНрГЭСНсДИДиОРДирективное письмоДоговорДополнение к ВСНДополнение к РНиПДСЕКЕНВиРЕНВиР-ПЕНиРЕСДЗемЕТКСЖНМЗаключениеЗаконЗаконопроектЗональный типовой проектИИБТВИДИКИМИНИнструктивное письмоИнструкцияИнструкция НСАМИнформационно-методическое письмоИнформационно-технический сборникИнформационное письмоИнформацияИОТИРИСОИСО/TRИТНИТОсИТПИТСИЭСНИЭСНиЕР Республика КарелияККарта трудового процессаКарта-нарядКаталогКаталог-справочникККТКОКодексКОТКПОКСИКТКТПММ-МВИМВИМВНМВРМГСНМДМДКМДСМеждународные стандартыМетодикаМетодика НСАММетодические рекомендацииМетодические рекомендации к СПМетодические указанияМетодический документМетодическое пособиеМетодическое руководствоМИМИ БГЕИМИ УЯВИМИГКМММНМОДНМонтажные чертежиМос МУМосМРМосСанПинМППБМРМРДСМРОМРРМРТУМСанПиНМСНМСПМТМУМУ ОТ РММУКМЭКННАС ГАНБ ЖТНВННГЭАНДНДПНиТУНКНормыНормы времениНПНПБНПРМНРНРБНСПНТПНТП АПКНТП ЭППНТПДНТПСНТСНЦКРНЦСОДМОДНОЕРЖОЕРЖкрОЕРЖмОЕРЖмрОЕРЖпОЕРЖрОКОМТРМОНОНДОНКОНТПОПВОПКП АЭСОПНРМСОРДОСГиСППиНОСНОСН-АПКОСПОССПЖОССЦЖОСТОСТ 1ОСТ 2ОСТ 34ОСТ 4ОСТ 5ОСТ ВКСОСТ КЗ СНКОСТ НКЗагОСТ НКЛесОСТ НКМОСТ НКММПОСТ НКППОСТ НКПП и НКВТОСТ НКСМОСТ НКТПОСТ5ОСТНОСЭМЖОТРОТТПП ССФЖТПБПБПРВПБЭ НППБЯПВ НППВКМПВСРПГВУПереченьПиН АЭПисьмоПМГПНАЭПНД ФПНД Ф СБПНД Ф ТПНСТПОПоложениеПорядокПособиеПособие в развитие СНиППособие к ВНТППособие к ВСНПособие к МГСНПособие к МРПособие к РДПособие к РТМПособие к СНПособие к СНиППособие к СППособие к СТОПособие по применению СППостановлениеПОТ РПОЭСНрППБППБ-АСППБ-СППБВППБОППРПРПР РСКПР СМНПравилаПрактическое пособие к СППРБ АСПрейскурантПриказПротоколПСРр Калининградской областиПТБПТЭПУГПУЭПЦСНПЭУРР ГазпромР НОПРИЗР НОСТРОЙР НОСТРОЙ/НОПР РСКР СМНР-НП СРО ССКРазъяснениеРаспоряжениеРАФРБРГРДРД БГЕИРД БТРД ГМРД НИИКраностроенияРД РОСЭКРД РСКРД РТМРД СМАРД СМНРД ЭОРД-АПКРДИРДМРДМУРДПРДСРДТПРегламентРекомендацииРекомендацияРешениеРешение коллегииРКРМРМГРМДРМКРНДРНиПРПРРТОП ТЭРС ГАРСНРСТ РСФСРРСТ РСФСР ЭД1РТРТМРТПРУРуководствоРУЭСТОП ГАРЭГА РФРЭСНрСАСанитарные нормыСанитарные правилаСанПиНСборникСборник НТД к СНиПСборники ПВРСборники РСН МОСборники РСН ПНРСборники РСН ССРСборники ценСБЦПСДАСДАЭСДОССерияСЗКСНСН-РФСНиПСНиРСНККСНОРСНПСОСоглашениеСПСП АССП АЭССправочникСправочное пособие к ВСНСправочное пособие к СНиПСправочное пособие к СПСправочное пособие к ТЕРСправочное пособие к ТЕРрСРПССНССЦСТ ССФЖТСТ СЭВСТ ЦКБАСТ-НП СРОСТАСТКСТМСТНСТН ЦЭСТОСТО 030 НОСТРОЙСТО АСЧМСТО БДПСТО ВНИИСТСТО ГазпромСТО Газпром РДСТО ГГИСТО ГУ ГГИСТО ДД ХМАОСТО ДОКТОР БЕТОНСТО МАДИСТО МВИСТО МИСТО НААГСТО НАКССТО НКССТО НОПСТО НОСТРОЙСТО НОСТРОЙ/НОПСТО РЖДСТО РосГеоСТО РОСТЕХЭКСПЕРТИЗАСТО САСТО СМКСТО ФЦССТО ЦКТИСТО-ГК «Трансстрой»СТО-НСОПБСТПСТП ВНИИГСТП НИИЭССтП РМПСУПСССУРСУСНСЦНПРТВТЕТелеграммаТелетайпограммаТематическая подборкаТЕРТЕР Алтайский крайТЕР Белгородская областьТЕР Калининградской областиТЕР Карачаево-Черкесская РеспубликаТЕР Краснодарского краяТЕР Мурманская областьТЕР Новосибирской областиТЕР Орловской областиТЕР Республика ДагестанТЕР Республика КарелияТЕР Ростовской областиТЕР Самарской областиТЕР Смоленской обл.ТЕР Ямало-Ненецкий автономный округТЕР Ярославской областиТЕРмТЕРм Алтайский крайТЕРм Белгородская областьТЕРм Воронежской областиТЕРм Калининградской областиТЕРм Карачаево-Черкесская РеспубликаТЕРм Мурманская областьТЕРм Республика ДагестанТЕРм Республика КарелияТЕРм Ямало-Ненецкий автономный округТЕРмрТЕРмр Алтайский крайТЕРмр Белгородская областьТЕРмр Карачаево-Черкесская РеспубликаТЕРмр Краснодарского краяТЕРмр Республика ДагестанТЕРмр Республика КарелияТЕРмр Ямало-Ненецкий автономный округТЕРпТЕРп Алтайский крайТЕРп Белгородская областьТЕРп Калининградской областиТЕРп Карачаево-Черкесская РеспубликаТЕРп Краснодарского краяТЕРп Республика КарелияТЕРп Ямало-Ненецкий автономный округТЕРп Ярославской областиТЕРрТЕРр Алтайский крайТЕРр Белгородская областьТЕРр Калининградской областиТЕРр Карачаево-Черкесская РеспубликаТЕРр Краснодарского краяТЕРр Новосибирской областиТЕРр Омской областиТЕРр Орловской областиТЕРр Республика ДагестанТЕРр Республика КарелияТЕРр Ростовской областиТЕРр Рязанской областиТЕРр Самарской областиТЕРр Смоленской областиТЕРр Удмуртской РеспубликиТЕРр Ульяновской областиТЕРр Ямало-Ненецкий автономный округТЕРррТЕРрр Ямало-Ненецкий автономный округТЕРс Ямало-Ненецкий автономный округТЕРтр Ямало-Ненецкий автономный округТехнический каталогТехнический регламентТехнический регламент Таможенного союзаТехнический циркулярТехнологическая инструкцияТехнологическая картаТехнологические картыТехнологический регламентТИТИ РТИ РОТиповая инструкцияТиповая технологическая инструкцияТиповое положениеТиповой проектТиповые конструкцииТиповые материалы для проектированияТиповые проектные решенияТКТКБЯТМД Санкт-ПетербургТНПБТОИТОИ-РДТПТПРТРТР АВОКТР ЕАЭСТР ТСТРДТСНТСН МУТСН ПМСТСН РКТСН ЭКТСН ЭОТСНэ и ТЕРэТССЦТССЦ Алтайский крайТССЦ Белгородская областьТССЦ Воронежской областиТССЦ Карачаево-Черкесская РеспубликаТССЦ Ямало-Ненецкий автономный округТССЦпгТССЦпг Белгородская областьТСЦТСЦ Белгородская областьТСЦ Краснодарского краяТСЦ Орловской областиТСЦ Республика ДагестанТСЦ Республика КарелияТСЦ Ростовской областиТСЦ Ульяновской областиТСЦмТСЦО Ямало-Ненецкий автономный округТСЦп Калининградской областиТСЦПГ Ямало-Ненецкий автономный округТСЦэ Калининградской областиТСЭМТСЭМ Алтайский крайТСЭМ Белгородская областьТСЭМ Карачаево-Черкесская РеспубликаТСЭМ Ямало-Ненецкий автономный округТТТТКТТПТУТУ-газТУКТЭСНиЕР Воронежской областиТЭСНиЕРм Воронежской областиТЭСНиЕРрТЭСНиТЕРэУУ-СТУказУказаниеУказанияУКНУНУОУРврУРкрУРррУРСНУСНУТП БГЕИФАПФедеральный законФедеральный стандарт оценкиФЕРФЕРмФЕРмрФЕРпФЕРрФормаФорма ИГАСНФРФСНФССЦФССЦпгФСЭМФТС ЖТЦВЦенникЦИРВЦиркулярЦПИШифрЭксплуатационный циркулярЭРД |
| Показать все найденныеПоказать действующиеПоказать частично действующиеПоказать не действующиеПоказать проектыПоказать документы с неизвестным статусом |
| Упорядочить по номеру документаУпорядочить по дате введения |