Щелочность
15
Щелочностью называется содержание в воде веществ, вступающих в реакцию с сильными кислотами. К этим веществам относятся:
– сильные основания;
– слабые основания: аммиак, анилин, пиридин и т.п.;
– анионы
слабых кислот: 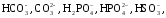
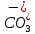
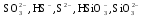 ,
анионы гуминовых кислот.
,
анионы гуминовых кислот.
Различают три формы щелочности: свободную, карбонатную и общую.
Свободная щелочность обусловлена гидроксильными и карбонатными ионами. Ее определяют количеством кислоты, идущей на титрование воды до pH 8,3.
Карбонатная щелочность зависит от наличия в воде только ионов угольной кислоты, т.е. карбонатных и гидрокарбонатных ионов, и определяется количеством кислоты, идущей на титрование воды до pH ≈ 4.
Общая щелочность обусловлена присутствием в воде анионов слабых кислот органического и неорганического происхождения, а также гидроксильных ионов.
В пресных незагрязненных водах карбонатная щелочность настолько велика по сравнению со щелочностью, вносимой другими анионами, что ее можно принимать равной общей щелочности.
Основным источником карбонатных и гидрокарбонатных ионов в поверхностных водах являются процессы химического выветривания и растворения карбонатных пород типа известняков, доломитов. Например,
СаСО3 + Н2О
+ СО2 ↔ Са2+ + 2 ;
;
МgCO3 + Н2О
+ СО2 ↔ Mg2+ + 2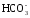 .
.
Некоторая часть гидрокарбонатных ионов появляется в результате метаморфизации продуктов химического выветривания изверженных пород:
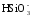
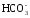 +
SiO2;
+
SiO2; OH– + CO2 →  .
.
Значительные количества гидрокарбонатных ионов поступают с атмосферными осадками и грунтовыми водами.
Гидрокарбонатные и карбонатные ионы выносятся в водоемы со сточными водами предприятий химической, силикатной, содовой промышленности и т.д.
По мере накопления гидрокарбонатных и особенно карбонатных ионов последние, образуя малорастворимые соединения с ионами кальция, могут выпадать в осадок:
Са(НСО3)2 → СаСО3↓ + Н2О + СО2;
Са2+ + 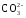 = СаСО3↓.
= СаСО3↓.
Этот процесс имеет очень важное значение в природе, поскольку от него зависит образование толщ карбонатных пород.
В поверхностных водах гидрокарбонатные и карбонатные ионы присутствуют главным образом в растворенном состоянии. Некоторая часть карбонатных ионов может находиться во взвешенном состоянии и близком к коллоидному состоянию в виде высокодисперсных частиц карбоната кальция.
В растворе между гидрокарбонатными и карбонатными ионами существует подвижное равновесие, определяемое константами диссоциации, характеризующими первую и вторую ступень диссоциации угольной кислоты
Н2СО3 ↔
Н+ + 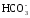 ↔
Н+ +
↔
Н+ + 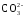 .
.
В
речных водах содержание гидрокарбонатных
ионов колеблется от 30 до 400 мг/дм3,
в озерах – от 1 до 500 мг/дм3.
Концентрация их в морских водах колеблется
в более узких пределах от 100 до 200 мг/дм
Щелочность является важной характеристикой поверхностных вод, по которой можно судить о важнейших гидрохимических и геохимических процессах, таких как формирование химического состава вод, эрозия земной поверхности, образование карбонатных пород и т.д.
В технике величина щелочности весьма существенна, поскольку от нее зависит коррозия бетона и выпадение карбонатной накипи в котлах, питающих различные паросиловые установки.
Для определения щелочности вод используют следующие методы: прямого титрования, обратного титрования и потенциометрические.
Методы прямого титрования основаны на титровании пробы воды сильной кислотой (НСl, H2SO4) в присутствии различных индикаторов, имеющих переход окраски в точке эквивалентности в области рН от 3 до 4. К ним относятся метиловый оранжевый, бромфеноловый синий, метиловый желтый. Недостатком этого наиболее простого и быстрого метода являются неопределенность значения рН в конечной точке титрования. Для определения свободной щелочности обычно используют фенолфталеин, имеющий интервал перехода рН и окраски индикатора 8,2 – 10,0.
Более
точны методы обратного титрования,
которые основаны на прибавлении к пробе
воды избытка сильной кислоты и его
титриметрическом определении в
присутствии индикатора. Эти методы
находят наибольшее распространение,
однако при анализе вод с низкой величиной
щелочности (менее 10 мг/дм3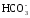 ),
а также окрашенных и мутных вод, возможны
значительные погрешности, составляющие
до 20 %.
),
а также окрашенных и мутных вод, возможны
значительные погрешности, составляющие
до 20 %.
В этих случаях предпочтительны различные варианты потенциометрических методов, в которых пробу исследуемой воды титруют сильной кислотой до определенного значения рН, определяемого с помощью рН-метра. На результаты не оказывают влияние следы активного хлора, мутность и окраска воды.
3.1.2 Определение общей щелочности
Общая щелочность воды определяется объемным или электрометрическим методами.
а) Объемный метод
При использовании объемного метода титрование пробы воды ведется в присутствии метилоранжа или смешанного индикатора.
Для получения более точных результатов в процессе титрования через исследуемый раствор продувается воздух.
Реактивы:
0,1 М раствор НСl;
метилоранж (0,003 %-ный водный раствор) или смешанный индикатор (0,03 г метилового красного и 0,2 г бромкрезолового зеленого) растворяется в 150 мл 96 %-ного этанола.
Ход работы. В коническую колбу отмерить 100 мл (или другой соответствующий объем) исследуемой воды, прибавить 2-3 капли метилоранжа. Титровать 0,1 н раствором соляной кислоты до перехода желтой окраски раствора в оранжевую (желто-розовую) и рассчитать щелочность воды по формуле:
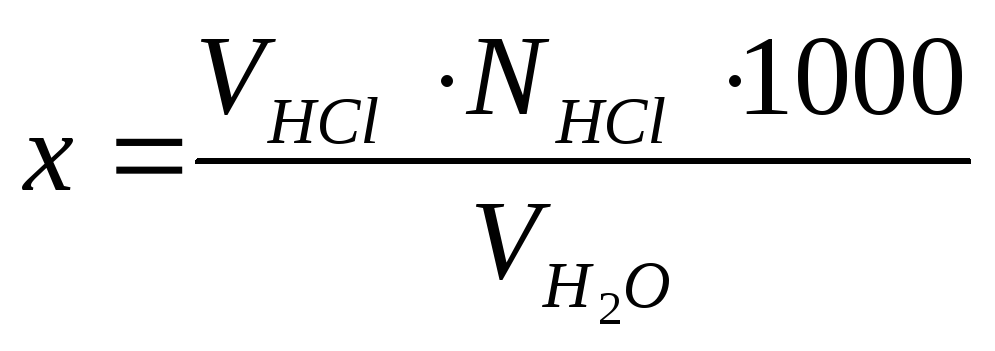 ,
,
VHCl– объем рабочего раствора НСl, пошедший на титрование пробы, мл;
NNCl – нормальность рабочего раствора НСl, г-экв/л;
 – объем
пробы воды, мл.
– объем
пробы воды, мл.
б) Электрометрический метод
Приборы, реактивы:
рН – метр лабораторный;
магнитная мешалка;
0,1 н раствор HCl.
Электрометрическое определение общей щелочности проводится по изменению величины рН.
Методика выполнения анализа аналогична методике определения свободной щелочности, но титрование ведется до установления величины рН, равной 4,5.
Вопросы к отчету лабораторной работы №3
1) Какие вещества, присутствующие в воде, обуславливают щелочность воды?
2) Виды щелочности и их значение для оценки качества воды?
3) Методы определения свободной и общей щелочности?
Лабораторная работа №4
Определение жесткости воды. Определение концентрации ионов кальция и магния в воде
Цель работы: изучить методики по определению жесткости воды и определения концентрации ионов кальция и магния.
4.1 Определение жесткости воды
Ионы Ca2+, Mg2+, Fe2+, Fe3+ и др. обуславливают жесткость природных вод. Так как концентрация этих ионов в воде (за исключением Ca2+ и Mg2+) крайне незначительна, то общая жесткость природных вод характеризуется суммой ионов Ca2+ и Mg2+, выраженной в мг-экв/л. 1 мг-экв/л соответствует содержанию в 1 дм3 воды 20,04 мг Ca2+ или 12,156 мг Mg2+ , или 1 градусу жесткости (10 Ж).
Ионы Ca2+ и Mg2+могут быть связаны с различными анионами (НСО3—, SO42-, Cl—, CO32-, HSiO3— и др.). Гидрокарбонаты кальция и магния и их карбонаты определяют карбонатную жесткость. При нагревании воды нарушается карбонатное равновесие (уменьшается содержание СО2), вследствие чего гидрокарбонаты переходят в карбонаты:
Ca(HCO3)2 → CaCO3 + CO2 + H2O
Растворимость карбонатов кальция и магния значительно меньше, чем гидрокарбонатов, поэтому при нагревании жесткость воды снижается. Жесткость воды, обусловленная гидрокарбонатами кальция и магния, называется устранимой (временной). Разность между общей и устранимой жесткостью называется неустранимой, или постоянной жесткостью. Карбонатную жесткость нельзя отождествлять с устранимой жесткостью, так как карбонаты, хотя и незначительно, но растворимы в воде. Разность между карбонатной и устранимой жесткостью есть остаточная жесткость, обусловленная карбонатами, остающимися в растворе. Сульфаты, хлориды, гидросиликаты и другие соли кальция и магния определяют некарбонатную жесткость.
Соотношение между видами жесткости зависит от типа природных вод. В большинстве вод содержание НСО3— < (Ca2+ + Mg2+) и соответствует устранимой жесткости. В щелочных водах НСО3— > (Ca2+ + Mg2+) и общую жесткость условно принимают за карбонатную. Жесткость питьевой воды, согласно СанПиН 2.1.4.1074-01, не должна превышать 7 мг–экв/л.
Наиболее точный и распространенный метод определения общей жесткости – комплексометрический, основанный на образовании ионами Ca+2 и Mg+2 прочных внутрикомплексных соединений с трилоном Б. В качестве индикатора при определении общей жесткости используется эрихром черный или кислотный хром темно–синий.
Лабораторная работа № 2 Определение щелочности воды
Под щелочностью понимают способность некоторых компонентов, содержащихся в воде связывать, эквивалентное количество сильной кислоты. Щелочность создают все катионы, которые в воде были уравновешены гидроксильными ионами, анионами слабых кислот (например, карбонаты, гидрокарбонаты). Щелочность определяется количеством сильной кислоты, необходимой для замещения этих анионов. Расход кислоты эквивалентен их общему содержанию в воде и выражает общую щелочность воды.
В природных водах щелочность зависит в основном от присутствия гидрокарбонатов щелочноземельных металлов, в меньшей степени щелочных. В этом случае значение рН-воды не превышает 8,3. Растворимые карбонаты и гидрокарбонаты повышают значение рН (более 8,3).
Титриметрическое определение
Принцип метода. Определение щелочности основано на титровании воды сильной кислотой. Количество раствора необходимое для достижения рН 8, эквивалентно свободной щелочности, а для достижения рН 4,5 — общей щелочности. При рН воды меньше 4,5 ее щелочность равна нулю.
Конечную точку при титровании находят визуально или электрометрически последнее предпочтительно при анализе загрязненных или окрашенных вод. Щёлочность, особенно свободную, следует определять не позднее чем через 24 часа после отбора пробы.
Результаты выражают в миллиграмм-эквивалентах на 1л, что соответствует количеству миллилитров 0,1 н хлористоводородной кислоты, израсходованной на титрование 100 мл исследуемой воды.
При визуальном титровании мешает интенсивная окраска воды. Ее устраняют, прибавляя активированный уголь и фильтруя пробы. Мутные воды фильтруют через бумажный или стеклянный фильтр. Мешает определению свободный хлор, обесцвечивающий индикатор. Хлор удаляют прибавлением эквивалентного количества тиосульфата натрия.
Для более точного определения щелочности вытесняют свободный диоксид углерода, продувая воздух, так как его концентрации мешают обнаружить переход окраски при титровании так же, как и диоксид углерода, выделяющийся при высоком содержании карбонатов. Силикат-фосфат-, борат-, сульфид-ионы, ионы гуминовых и других слабых кислот титруются вместе с карбонат- и гидроксил-ионами. В природных водах их обычно очень мало.
Реактивы:
1. НС1 — 0,1 н. раствор. При установлении титра раствор необходимо продувать воздухом, как при анализе пробы.
Фенолфталеин, 0,5% раствор. В 50 мл 96% этанола растворяют 0,5 г фенолфталеина и разбавляют 50 мл дистиллированной воды, добавляют по каплям 0,01 и гидроксид натрия до появления заметной розовой окраски.
Метиловый оранжевый индикатор, 0,05% раствор.
Смешанный индикатор. В 150 мл 96% этанола растворяют 0,03 г метилового красного и 0,2 г бромкрезолового зеленого и рН раствора устанавливают так, чтобы индикатор имел грязно-серую окраску.
Ход определения
Свободная шелочность. Отмеривают 25 мл исследуемой воды (при высокой щелочности берут меньший объем и разбавляют до 100 мл прокипяченной и охлажденной дистиллированной водой), прибавляют 0,1 мл (2 капли) 0,5% фенолфталеина и титруют на белом фоне 0,1 н. хлористоводородной кислотой до полного обесцвечивания. Для более четкого улавливания конца титрования определение следует вести с контролем, для чего рядом с титруемой пробой ставят вторую порцию исследуемой воды, добавляя такое же количество индикатора.
Общая щелочность. Отмеривают 100 мл пробы, прибавляют 0,15 мл (3 капли) смешанного индикатора или 0,1 мл (2 капли) метилового оранжевого, затем продувают воздух в течение 2-3 мин и титруют 0,1 н. хлористоводородной кислоты на белом фоне в присутствии контрольного раствора до момента, когда зеленая окраска смешанного индикатора перейдет в грязно-серую (или до начала перехода окраски метилового оранжевого из желтой в оранжевую). Вновь продувают воздух 2-3 мин, и если возвращается первоначальная окраска, то дотитровывают. Титрование считают законченным, если после продувания окраска раствора не меняется. Воздух, продолжают продувать, и через 5 мин, если возвращается первоначальная окраска, то дотитровывают.
Расчет свободной (Р) и общей (М) щелочности (мг-экв/л) проводят по формулам:
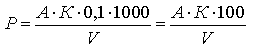
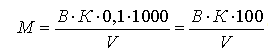
где А — объем 0,1 н. хлористоводородной кислоты, израсходованной на титрование по фенолфталеину, мл;
В — то же по смешанному индикатору или метиловому оранжевому, мл;
К — поправочный коэффициент к 0,1н. раствору хлористоводородной кислоты; V — объем пробы, взятой для определения, мл.
Расчет содержания карбонат- и бикарбонат-ионов
Ввиду того что общая и свободная щелочность находится в стехиометрической зависимости от содержания гидрокарбонат-, карбонат- и гидроксил- ионов, по величине свободной и общей щелочности можно косвенно вычислить, количество этих ионов.
Расчет основан на предположении, что щелочность вызывается в основном ионными формами диоксида углерода и меньше гидроксильными. Эта предпосылка редко соответствует действительности, и расчет дает приближенные результаты. Рассчитывать нельзя, если в воде присутствуют мешающие вещества или исследуют сильнозагрязненные воды. В зависимости, от соотношения между свободной (Р) и общей (М) щелочностью возможны 5 случаев расчета (см. таб. 1).
Величина свободной щелочности равна величине карбонатной жесткости (мг-экв/л). Умножая Р на 30, получаем содержание карбонат-ионов (мг/л).
Величина общей щелочности равна величине гидрокарбонатной жесткости (мг-экв/л) умножая М на 61,02, получаем содержание гидрокарбонатного иона (мг/л).
Соотношения для вычисления ионных форм по щелочности
Таблица 1
Отношение между свободной (Р) и общей (М) щелочностью | Гидрокарбонаты, мг- экв/л | Карбонаты, мг-экв/л |
Р=0 2Р<М 2Р=М 2Р>М Р=М | М М-2Р О О О | О 2Р 2Р 2 (М — Р) О |
Лабораторная работа № 5 Определение общей и свободной щёлочности воды
Цель работы: уяснить, чем обусловлена щёлочность воды, и виды щёлочности.
Под щелочностью воды понимают содержание в ней веществ, вступающих в реакцию нейтрализации с сильными кислотами.
Щелочность природных и сточных вод обусловлена присутствием в ней гидроксид-ионов, находящихся не только в свободном, но и в связанном состоянии, способных вступать в реакцию нейтрализации с сильными кислотами.
Гидроксид-ионы, обусловливающие щёлочность воды, образуются при диссоциации свободных оснований (сильных и слабых), а также вследствие гидролиза солей, образованных сильными основаниями и слабыми кислотами.
Концентрация реально присутствующих ионов ОН— в растворе при данных условиях характеризуется активной щёлочностью, которая устанавливается при колориметрическом и потенциометрическом определении рН.
Концентрация ионов ОН—, которая определяется в процессе проведения реакции нейтрализации, характеризует общую щёлочность воды.
Общая щёлочность воды определяется в лабораторных условиях методом кислотно-основного титрования. В качестве титранта используют титрованный раствор соляной или серной кислоты в присутствии индикатора – метилоранжа. Общая щёлочность определяется количеством титрованного раствора сильной кислоты (ммоль-экв/л), которое необходимо для полной нейтрализации исследуемого раствора по достижении рН 4,5. Точка эквивалентности, соответствующая окончанию реакции нейтрализации, определяется визуально по изменению окраски индикатора.
Общая щёлочность включает сумму растворённых веществ, реагирующих с сильными кислотами.
В природных и сточных водах при рН > 8,3 щёлочность в основном создаётся присутствием гидратов (ОН−), гидрокарбонатов (НСО3−), карбонатов (СО32−), гуматов и силикатов металлов.
Що = ЩГ + ЩГК + ЩК + ЩГУМ..,
где Що – общая щёлочность, ммоль-экв/л;
ЩГ – гидратная щёлочность, ммоль-экв/л;
ЩГК – гидрокарбонатная щёлочность, ммоль-экв/л;
ЩК – карбонатная щёлочность, ммоль-экв/л;
ЩГУМ..- гуматная щёлочность, ммоль-экв/л;
Каждая из этих составляющих существует в строго определённом интервале рН.
Гидрокарбонатная составляющая существует в основном в интервале рН от 4,5 до 8,3 (в этом интервале в окрашенных водах может быть и гуматная щёлочность). В интервале рН от 8,3 до 12,4 щелочность создаётся как гидрокарбонатной, так и карбонатной составляющими. При рН > 12,4 существуют только гидратная и карбонатная составляющие. Если рН ≤ 4,5, то её общая щёлочность равна нулю.
Та часть общей щёлочности, которая соответствует количеству кислоты, необходимому для понижения рН воды до 8,3, называется свободной щёлочностью. Свободная щёлочность определяется титрованием воды кислотой в присутствии фенолфталеина и выражается в мг-экв/л.
Если рН воды ≤ 8,3, то свободная щёлочность отсутствует.
Следовательно, общая и свободная щёлочность определяются методом нейтрализации, т.е. титрование воды сильными кислотами и выражаются в ммоль-экв/л.
Оборудование и реактивы:
Титровальная установка (штатив, бюретка, титровальные колбы, вспомогательная колба).
Мерный цилиндр (стакан) или пипетка на 100 мл.
0,1 н. раствор соляной (серной) кислоты.
0,1%-ный спиртовой раствор фенолфталеина.
0,05%-ный водный раствор метилоранжа.
водопроводная вода и контрольные образцы воды.
3.9.2 Определение общей щелочности воды
В коническую колбу емкостью 250 мл отмеряем пипеткой 100 мл исследуемой воды. Прибавляем 3 капли метилоранжа и титруем раствором кислоты до перехода желтой окраски в оранжевую. Проводим параллельно три титрования.
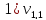 = 3,9 мл(объем кислоты,
израсходованной на титрование)
= 3,9 мл(объем кислоты,
израсходованной на титрование)
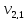 = 100 мл (объем воды,
взятой для исследования)
= 100 мл (объем воды,
взятой для исследования)
Н = 0,1 (нормальная концентрация рабочего раствора кислоты)
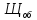 =
=  =
=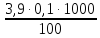 = 3,9 мг-экв/л (2)
= 3,9 мг-экв/л (2)
2) 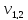 = 3,8 мл(объем кислоты, израсходованной
на титрование)
= 3,8 мл(объем кислоты, израсходованной
на титрование)
 = 100 мл (объем воды,
взятой для исследования)
= 100 мл (объем воды,
взятой для исследования)
Н = 0,1 (нормальная концентрация рабочего раствора кислоты)
 =
= 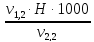 =
=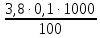 = 3,8 мг-экв/л (2)
= 3,8 мг-экв/л (2)
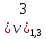 = 3,8 мл(объем кислоты,
израсходованной на титрование)
= 3,8 мл(объем кислоты,
израсходованной на титрование)
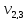 = 100 мл (объем воды,
взятой для исследования)
= 100 мл (объем воды,
взятой для исследования)
Н = 0,1 (нормальная концентрация рабочего раствора кислоты)
 =
= 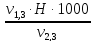 =
=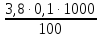 = 3,8 мг-экв/л (2)
= 3,8 мг-экв/л (2)
Рассчитываем среднюю общую щелочность
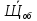 =
= 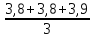 = 3,83 мг-экв/л
= 3,83 мг-экв/л
3.9.3 Определение общей жесткости воды
В коническую колбу наливаем 100 мл испытуемой воды. При этом суммарное содержание ионов кальция и магния во взятом объеме воды не должно превышать 0,5 ммоль. Затем прибавляем 5 мл буферного раствора, 0,1 г сухой смеси индикатора хромогена черного с сухим хлористым натрием и сразу же титруем при сильном взбалтывании 0,05 н. раствором трилона Б до изменения окраски в эквивалентной точке.
Окраску получили
синею. Появление этого окрашивания
свидетельствует об отсутствии ионов 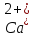 и
и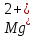 в растворе, т.е. о полном связывании их
с трилоном Б. Проводим параллельно три
титрования.
в растворе, т.е. о полном связывании их
с трилоном Б. Проводим параллельно три
титрования.
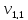 = 11,2 мл
= 11,2 мл
Так как на титрование ушло более 10 мл, то берем воду меньшего объема 50 мл и повторяем опыт заново.
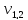 = 5,7 мл;
= 5,7 мл; 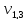 = 5,8 мл
= 5,8 мл
Общую жесткость воды вычисляют по уравнению(3)
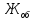 =
= 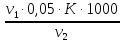
К – поправочный коэффициент к нормальной концентрации раствора трилона Б
 –количество
трилона Б, израсходованное на титрование
пробы
–количество
трилона Б, израсходованное на титрование
пробы
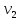 –объем воды,
взятой для определения общей жесткости
–объем воды,
взятой для определения общей жесткости
 =
= 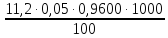 = 5,376 мг-экв/л
= 5,376 мг-экв/л
 =
= 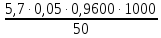 = 5,472 мг-экв/л
= 5,472 мг-экв/л
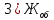 =
= 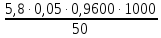 = 5,568 мг-экв/л
= 5,568 мг-экв/л
Рассчитываем среднюю общую жесткость и относительную погрешность
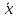 =
= 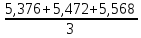 = 5,472
= 5,472
ᵟ
= 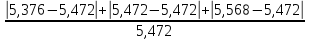 · 100%= 3,5%
· 100%= 3,5%
3.9.4 Определение рН воды с помощью стеклянного электрода
Промыть электроды и стакан для пробы дистиллированной водой. Налить в стакан для пробы исследуемый раствор. Включить прибор рН-метр. На потенциометре установить температуру раствора. Переключить mV/pH, установить в положение «рН». При помощи держателя погрузить электроды в стакан с исследуемым раствором. Запишем установившееся значение рН.
t = 24,00C
pH = 7,89
3.10 Определение показателей водопроводной воды с аммонием углекислым кислым
3.10.1 Определение общей кислотности воды
Растворяем в одном литре водопроводной воды 120 мг аммония углекислого кислого. В коническую колбу емкостью 250 мл отмеряем пипеткой 100 мл исследуемой воды, прибавляем 3 капли фенолфталеина. Пробу титруем раствором щелочи до появления слабо-розовой окраски, не исчезающей в течение 1-2 минут. Проводим параллельно три титрования.
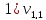 = 1,0 мл(объем щелочи,
израсходованной на титрование)
= 1,0 мл(объем щелочи,
израсходованной на титрование)
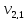 = 100 мл (объем воды,
взятой для исследования)
= 100 мл (объем воды,
взятой для исследования)
Н = 0,1 (нормальная концентрация рабочего раствора щелочи)
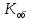 =
= 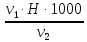 =
=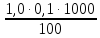 = 1,0 мг-экв/л (1)
= 1,0 мг-экв/л (1)
 = 1,1 мл(объем щелочи,
израсходованной на титрование)
= 1,1 мл(объем щелочи,
израсходованной на титрование)
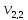 = 100 мл (объем воды,
взятой для исследования)
= 100 мл (объем воды,
взятой для исследования)
Н = 0,1 (нормальная концентрация рабочего раствора щелочи)
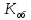 =
= 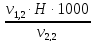 =
=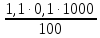 = 1,1 мг-экв/л (1)
= 1,1 мг-экв/л (1)
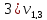 = 1,0 мл(объем щелочи,
израсходованной на титрование)
= 1,0 мл(объем щелочи,
израсходованной на титрование)
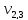 = 100 мл (объем воды,
взятой для исследования)
= 100 мл (объем воды,
взятой для исследования)
Н = 0,1 (нормальная концентрация рабочего раствора щелочи)
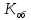 =
= 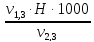 =
=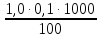 = 1,0 мг-экв/л (1)
= 1,0 мг-экв/л (1)
Рассчитываем среднюю общую кислотность
 =
=  = 1,03 мг-экв/л
= 1,03 мг-экв/л
3.15.2 Определение общей щелочности воды
В коническую колбу емкостью 250 мл отмеряем пипеткой 100 мл исследуемой воды. Прибавляем 3 капли метилоранжа и титруем раствором кислоты до перехода желтой окраски в оранжевую.
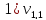 = 3,7 мл(объем кислоты,
израсходованной на титрование)
= 3,7 мл(объем кислоты,
израсходованной на титрование)
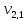 = 100 мл (объем воды,
взятой для исследования)
= 100 мл (объем воды,
взятой для исследования)
Н = 0,1 (нормальная концентрация рабочего раствора кислоты)
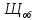 =
=  =
= = 3,7 мг-экв/л (2)
= 3,7 мг-экв/л (2)
2) 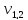 = 3,7 мл(объем кислоты, израсходованной
на титрование)
= 3,7 мл(объем кислоты, израсходованной
на титрование)
 = 100 мл (объем воды,
взятой для исследования)
= 100 мл (объем воды,
взятой для исследования)
Н = 0,1 (нормальная концентрация рабочего раствора кислоты)
 =
= 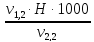 =
=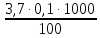 = 3,7 мг-экв/л (2)
= 3,7 мг-экв/л (2)
 = 3,8 мл(объем кислоты,
израсходованной на титрование)
= 3,8 мл(объем кислоты,
израсходованной на титрование)
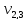 = 100 мл (объем воды,
взятой для исследования)
= 100 мл (объем воды,
взятой для исследования)
Н = 0,1 (нормальная концентрация рабочего раствора кислоты)
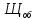 =
=  =
=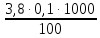 = 3,8 мг-экв/л (2)
= 3,8 мг-экв/л (2)
Рассчитываем среднюю общую щелочность
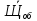 =
= 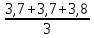 = 3,73 мг-экв/л
= 3,73 мг-экв/л
3.15.3 Определение общей жесткости воды
В коническую колбу наливаем 100 мл испытуемой воды. При этом суммарное содержание ионов кальция и магния во взятом объеме воды не должно превышать 0,5 ммоль. Затем прибавляем 5 мл буферного раствора, 0,1 г сухой смеси индикатора хромогена черного с сухим хлористым натрием и сразу же титруем при сильном взбалтывании 0,05 н. раствором трилона Б до изменения окраски в эквивалентной точке.
Окраску получили
синею. Появление этого окрашивания
свидетельствует об отсутствии ионов 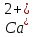 и
и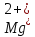 в растворе, т.е. о полном связывании их
с трилоном Б.
в растворе, т.е. о полном связывании их
с трилоном Б.
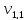 = 9,4 мл;
= 9,4 мл; 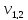 = 9,5 мл;
= 9,5 мл;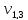 = 9,4 мл
= 9,4 мл
Общую жесткость воды вычисляют по уравнению (3)
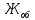 =
= 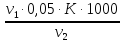
К – поправочный коэффициент к нормальной концентрации раствора трилона Б
 –количество
трилона Б, израсходованное на титрование
пробы
–количество
трилона Б, израсходованное на титрование
пробы
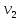 –объем воды,
взятой для определения общей жесткости
–объем воды,
взятой для определения общей жесткости
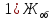 =
=  = 4,512 мг-экв/л
= 4,512 мг-экв/л
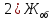 =
= 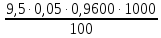 = 4,560 мг-экв/л
= 4,560 мг-экв/л
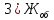 =
= 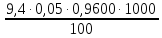 = 4,512 мг-экв/л
= 4,512 мг-экв/л
Рассчитываем относительную погрешность
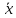 =
= 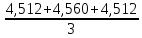 = 4,528
= 4,528
ᵟ
= 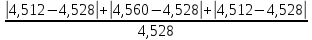 · 100%= 1,41%
· 100%= 1,41%
3.15.4 Определение рН воды с помощью стеклянного электрода
Промыть электроды и стакан для пробы дистиллированной водой. Налить в стакан для пробы исследуемый раствор. Включить прибор рН-метр. На потенциометре установить температуру раствора. Переключить mV/pH, установить в положение «рН». При помощи держателя погрузить электроды в стакан с исследуемым раствором. Запишем установившееся значение рН.
t = 23,50C
pH = 9,17
3.16 Определение показателей качества водопроводной воды с калием-натрием углекислым k2co3·Na2co3
3.16.1 Определение общей кислотности воды
Растворяем в одном литре водопроводной воды 60 мг калий-натрий углекислый K2CO3·Na2CO3 . В коническую колбу емкостью 250 мл отмеряем пипеткой 100 мл исследуемой воды, прибавляем 3 капли фенолфталеина. Пробу титруем раствором щелочи до появления слабо-розовой окраски, не исчезающей в течение 1-2 минут.
Добавляя к пробе фенолфталеин раствор сразу же стал розового цвета, по этому кислотность не определяется. А для того чтобы определить кислотность мы берем пробу по больше 200 мл или титруемый раствор с большей концентрацией.
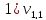 = 0,6 мл(объем щелочи,
израсходованной на титрование)
= 0,6 мл(объем щелочи,
израсходованной на титрование)
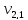 = 200 мл (объем воды,
взятой для исследования)
= 200 мл (объем воды,
взятой для исследования)
Н = 0,1 (нормальная концентрация рабочего раствора щелочи)
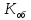 =
= 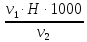 == 0,3 мг-экв/л (1)
== 0,3 мг-экв/л (1)
3.16.2 Определение общей щелочности воды
В коническую колбу емкостью 250 мл отмеряем пипеткой 100 мл исследуемой воды. Прибавляем 3 капли метилоранжа и титруем раствором кислоты до перехода желтой окраски в оранжевую.
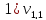 = 2,0 мл(объем кислоты,
израсходованной на титрование)
= 2,0 мл(объем кислоты,
израсходованной на титрование)
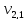 = 100 мл (объем воды,
взятой для исследования)
= 100 мл (объем воды,
взятой для исследования)
Н = 0,1 (нормальная концентрация рабочего раствора кислоты)
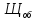 =
= 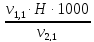 =
=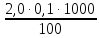 = 2,0 мг-экв/л (2)
= 2,0 мг-экв/л (2)
2) 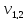 = 2,0 мл(объем кислоты, израсходованной
на титрование)
= 2,0 мл(объем кислоты, израсходованной
на титрование)
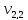 = 100 мл (объем воды,
взятой для исследования)
= 100 мл (объем воды,
взятой для исследования)
Н = 0,1 (нормальная концентрация рабочего раствора кислоты)
 =
= 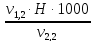 =
=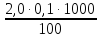 = 2,0 мг-экв/л (2)
= 2,0 мг-экв/л (2)
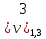 = 2,0 мл(объем кислоты,
израсходованной на титрование)
= 2,0 мл(объем кислоты,
израсходованной на титрование)
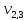 = 100 мл (объем воды,
взятой для исследования)
= 100 мл (объем воды,
взятой для исследования)
Н = 0,1 (нормальная концентрация рабочего раствора кислоты)
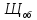 =
= 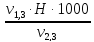 =
=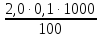 = 2,0 мг-экв/л (2)
= 2,0 мг-экв/л (2)
Рассчитываем среднюю общую щелочность
 =
= 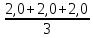 = 2,0 мг-экв/л
= 2,0 мг-экв/л
3.13.2 Определение общей щелочности воды
В коническую колбу емкостью 250 мл отмеряем пипеткой 100 мл исследуемой воды. Прибавляем 3 капли метилоранжа и титруем раствором кислоты до перехода желтой окраски в оранжевую. Проводим три параллельных титрования.
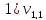 = 2,0 мл(объем кислоты,
израсходованной на титрование)
= 2,0 мл(объем кислоты,
израсходованной на титрование)
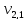 = 100 мл (объем воды,
взятой для исследования)
= 100 мл (объем воды,
взятой для исследования)
Н = 0,1 (нормальная концентрация рабочего раствора кислоты)
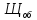 =
= 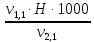 =
=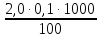 = 2,0 мг-экв/л (2)
= 2,0 мг-экв/л (2)
2) 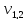 = 2,0 мл(объем кислоты, израсходованной
на титрование)
= 2,0 мл(объем кислоты, израсходованной
на титрование)
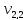 = 100 мл (объем воды,
взятой для исследования)
= 100 мл (объем воды,
взятой для исследования)
Н = 0,1 (нормальная концентрация рабочего раствора кислоты)
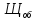 =
= 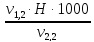 =
=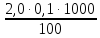 = 2,0 мг-экв/л (2)
= 2,0 мг-экв/л (2)
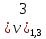 = 2,0 мл(объем кислоты,
израсходованной на титрование)
= 2,0 мл(объем кислоты,
израсходованной на титрование)
 = 100 мл (объем воды,
взятой для исследования)
= 100 мл (объем воды,
взятой для исследования)
Н = 0,1 (нормальная концентрация рабочего раствора кислоты)
 =
= 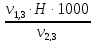 =
=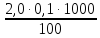 = 2,0 мг-экв/л (2)
= 2,0 мг-экв/л (2)
Рассчитываем среднюю общую щелочность
 =
= 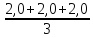 = 2,0 мг-экв/л
= 2,0 мг-экв/л
3.13.3 Определение общей жесткости воды
В коническую колбу наливаем 100 мл испытуемой воды. При этом суммарное содержание ионов кальция и магния во взятом объеме воды не должно превышать 0,5 ммоль. Затем прибавляем 5 мл буферного раствора, 0,1 г сухой смеси индикатора хромогена черного с сухим хлористым натрием и сразу же титруем при сильном взбалтывании 0,05 н. раствором трилона Б до изменения окраски в эквивалентной точке.
Окраску получили
синею. Появление этого окрашивания
свидетельствует об отсутствии ионов 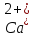 и
и в растворе, т.е. о полном связывании их
с трилоном Б.
в растворе, т.е. о полном связывании их
с трилоном Б.
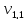 = 10,7 мл
= 10,7 мл
Так как на титрование ушло более 10 мл, то берем воду меньшего объема 50 мл и повторяем опыт заново.
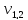 = 5,6 мл;
= 5,6 мл; 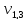 = 5,6 мл
= 5,6 мл
Общую жесткость воды вычисляют по уравнению (3)
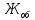 =
= 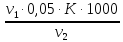
К – поправочный коэффициент к нормальной концентрации раствора трилона Б
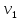 –количество
трилона Б, израсходованное на титрование
пробы
–количество
трилона Б, израсходованное на титрование
пробы
 –объем воды,
взятой для определения общей жесткости
–объем воды,
взятой для определения общей жесткости
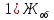 =
= 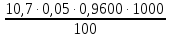 = 5,136 мг-экв/л
= 5,136 мг-экв/л
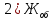 =
= 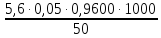 = 5,376 мг-экв/л
= 5,376 мг-экв/л
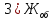 =
= 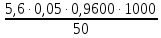 = 5,376 мг-экв/л
= 5,376 мг-экв/л
Рассчитываем относительную погрешность
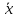 =
= 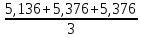 = 5,296
= 5,296
ᵟ
= 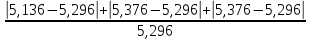 · 100%= 6,04%
· 100%= 6,04%
3.13.4 Определение рН воды с помощью стеклянного электрода
Промыть электроды и стакан для пробы дистиллированной водой. Налить в стакан для пробы исследуемый раствор. Включить прибор рН-метр. На потенциометре установить температуру раствора. Переключить mV/pH, установить в положение «рН». При помощи держателя погрузить электроды в стакан с исследуемым раствором. Запишем установившееся значение рН.
t = 24,20C
pH = 6,75
3.14 Определение показателей качества водопроводной воды с калием сернокислым кислым khso4
3.14.1 Определение общей кислотности воды
Растворяем в одном литре водопроводной воды 60 мг калий сернокислый кислый KHSO4. Растворяем в одном литре водопроводной воды 60 мг калия сернокислого кислого KHSO4 . В коническую колбу емкостью 250 мл отмеряем пипеткой 100 мл исследуемой воды, прибавляем 3 капли фенолфталеина. Пробу титруем раствором щелочи до появления слабо-розовой окраски, не исчезающей в течение 1-2 минут. Проводим три параллельных титрования.
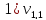 = 0,9 мл(объем щелочи,
израсходованной на титрование)
= 0,9 мл(объем щелочи,
израсходованной на титрование)
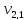 = 100 мл (объем воды,
взятой для исследования)
= 100 мл (объем воды,
взятой для исследования)
Н = 0,1 (нормальная концентрация рабочего раствора щелочи)
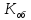 =
= 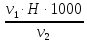 =
=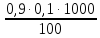 = 0,9 мг-экв/л (1)
= 0,9 мг-экв/л (1)
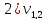 = 0,8 мл(объем щелочи,
израсходованной на титрование)
= 0,8 мл(объем щелочи,
израсходованной на титрование)
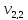 = 100 мл (объем воды,
взятой для исследования)
= 100 мл (объем воды,
взятой для исследования)
Н = 0,1 (нормальная концентрация рабочего раствора щелочи)
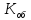 =
= 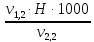 =
=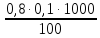 = 0,8 мг-экв/л (1)
= 0,8 мг-экв/л (1)
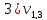 = 0,9 мл(объем щелочи,
израсходованной на титрование)
= 0,9 мл(объем щелочи,
израсходованной на титрование)
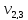 = 100 мл (объем воды,
взятой для исследования)
= 100 мл (объем воды,
взятой для исследования)
Н = 0,1 (нормальная концентрация рабочего раствора щелочи)
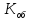 =
= 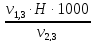 =
=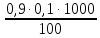 = 0,9 мг-экв/л (1)
= 0,9 мг-экв/л (1)
Рассчитываем среднюю общую кислотность
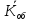 =
= 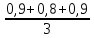 = 0,87 мг-экв/л
= 0,87 мг-экв/л